Preparación oral con liberación controlada.
Pella farmacéutica que comprende un núcleo esférico que contienen principio activo con superficie lisa y unrecubrimiento sobre el núcleo,
que controla la liberación de principio activo independientemente del pH, presentandoel núcleo una rugosidad media de menos de 10 μm y preferiblemente de menos de 7,5 μm y/o una rugosidad mediarelativa de menos del 2%.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/008700.
Solicitante: ADD ADVANCED DRUG DELIVERY TECHNOLOGIES, LTD.
Nacionalidad solicitante: Suiza.
Dirección: Kraftwerkstrasse 6 4133 Pratteln SUIZA.
Inventor/es: KOHLMEYER, MANFRED, SCHLUTERMANN, BURKHARD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
PDF original: ES-2434416_T3.pdf
Fragmento de la descripción:
Preparación oral con liberación controlada Campo de la invención La presente invención se refiere a nuevas pellas farmacéuticas, formas de administración multiparticuladas basadas en aquellas pellas, procedimientos para la preparación de pellas, así como procedimientos para la preparación de formas de administración usando las pellas. Las pellas y las formas de administración multiparticuladas basadas en las pellas destacan especialmente por una liberación de principio activo controlada.
Antecedentes de la invención En la administración por vía oral de fármacos, el principio activo se libera en el tubo gastrointestinal, y una proporción del principio activo es resorbida. Mediante el control de la liberación del principio activo puede influirse el grado de resorción y la duración de la acción. Correspondientemente se han hecho distintas propuestas para controlar la liberación de principio activo mediante formulación galénica adecuada del principio activo.
Un enfoque consiste en proveer formas de administración con recubrimientos, pudiendo influirse la liberación del principio activo en función de la solubilidad o permeabilidad de los recubrimientos. Los recubrimientos de este tipo pueden aplicarse, por ejemplo, sobre comprimidos o cápsulas. Sin embargo, una desventaja en este caso consistente en que un recubrimiento defectuoso o dañado puede conducir a que la liberación de la dosis total de principio activo no se controle en la forma deseada.
Como alternativa se ofrecen formas de administración multiparticuladas en las que la cantidad total de principio activo está distribuida en un mayor número de unidades más pequeñas, como pellas. Si las pellas individuales se proveen de recubrimientos, entonces en el caso de un recubrimiento defectuoso en una pella, solo una proporción correspondientemente menor de la dosis total de principio activo no está sujeta a la liberación deseada.
Otra ventaja de las formas de administración de este tipo basadas en pellas consiste en que, después de la ingestión, pellas suficientemente pequeñas pasan relativamente rápido del estómago al intestino. Por el contrario, siempre y cuando no se disgreguen, los comprimidos también pueden permanecer durante más tiempo en el estómago, siendo el tiempo además bastante variable.
A pesar de las ventajas conocidas de las pellas o formas de administración multiparticuladas, es, sin embargo, difícil ajustar un comportamiento de liberación deseado. Esto está relacionado con que según el estado de la técnica es difícil proporcionar pellas recubiertas uniformes. Incluso los núcleos de pellas que se recubrirán presentan una calidad insuficiente. Especialmente las pellas que se preparan mediante extrusión son frecuentemente irregulares en su forma y tienen además una superficie rugosa y desigual, lo que dificulta el posterior recubrimiento con película y conduce además a que apenas puedan obtenerse películas de buena calidad.
Las películas o recubrimientos a las que se recurre para controlar la liberación pueden presentar distintas composiciones. Así, se han hecho propuestas para controlar la liberación en función del valor de pH, del tiempo o de enzimas bacterianas que están presentes en el intestino.
Sin embargo, en los sistemas controlados por pH, un problema consiste en que la liberación de principio activo se modifica por la ingesta de alimentos, que influye en el valor de pH en el tubo gastrointestinal. Además, hay diferencias considerables entre distintas personas en lo referente al valor de pH en el tubo gastrointestinal. También se ha informado de variabilidad en formas de administración enzimáticamente controladas con liberación controlada.
Por tanto, las formas de administración conocidas con liberación controlada no son completamente satisfactorias. Además, existe el problema de que no pueden ajustarse perfiles de liberación deseados (fijados) . Además, la preparación de formas de administración con liberación controlada es frecuentemente difícil. Por tanto, existe una necesidad de nuevas formas de administración con liberación controlada, así como también de nuevos procedimientos para la preparación de formas de administración con liberación controlada.
Objetivos y resumen de la invención Un objetivo de la presente invención consiste en proporcionar una pella farmacéutica en la que la liberación de principio activo pueda controlarse independientemente del valor de pH e independientemente de la acción de enzimas.
Otro objetivo consiste en proporcionar una pella farmacéutica en la que la liberación de principio activo siga un perfil con una fase de latencia. Además, un objetivo consiste en proporcionar una pella en la que la liberación de principio activo se realice después de una fase de latencia con una tasa fija. Según la invención, se prepararán además productos de pella o colectivos de pellas que comprenden una pluralidad de pellas individuales que satisfacen respectivamente los requisitos especificados. Finalmente, según la invención se proporcionarán procedimientos para la preparación de pellas, productos de pella y otras formas de administración.
Según la invención, ahora se ha establecido que pueden proporcionarse preparaciones en las que la liberación de principio activo se realiza independientemente del pH e independientemente de enzimas, cuando se usan pellas, que presentan un núcleo que contiene principio activo esférico con superficie lisa y un recubrimiento sobre el núcleo, presentando el núcleo una rugosidad media inferior a 10 µm y preferiblemente inferior a 7, 5 µm y/o una rugosidad media relativa de menos del 2%.
Breve descripción de las figuras
La invención se explica a continuación más detalladamente en relación con las figuras.
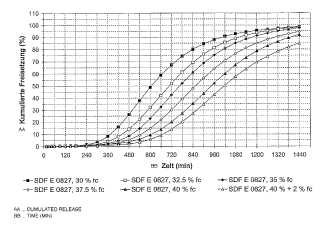
La Fig. 1 muestra la influencia del espesor del recubrimiento que controla la liberación en la liberación de principio activo en pellas que contienen el principio activo ADD 006, estando constituido el recubrimiento por poli (acetato de vinilo) y, referido al peso de poli (acetato de vinilo) , 10% en peso de citrato de trietilo y 10% en peso de talco. Se representa la liberación acumulada (%) frente al tiempo (minutos) . La cantidad en porcentaje del material de recubrimiento (poli (acetato de vinilo) , citrato de trietilo y talco en la composición previamente especificada) , referida al peso de los núcleos de pellas que contienen principio activo, para los lotes individuales, se especifica como la medida del espesor del recubrimiento.
La Fig. 2 muestra la influencia del espesor del recubrimiento que controla la liberación en la liberación de principio activo en pellas que contienen el principio activo ADD 006, estando constituido el recubrimiento por poli (acetato de vinilo) y, referido al peso del poli (acetato de vinilo) , 7, 5% en peso de citrato de trietilo y 10% en peso de talco. Se representa la liberación acumulada (%) frente al tiempo (minutos) . La cantidad en porcentaje del material de recubrimiento (poli (acetato de vinilo) , citrato de trietilo y talco en la composición previamente especificada) , referida al peso de los núcleos de pellas que contienen principio activo, para los lotes individuales, se especifica como la medida del espesor del recubrimiento.
La Fig. 3 muestra la influencia de la fuerza de compresión en la liberación de principio activo de comprimidos con un diámetro de 12 mm y un peso de 884, 2 mg que contienen 200 mg de ADD 006. Los comprimidos se prepararon respectivamente usando pellas que presentaban un núcleo de pella con el principio activo ADD 006. Sobre el núcleo de pella se aplicaron 40% en peso de un recubrimiento, referido al peso de los núcleos de pellas, de poli (acetato de vinilo) , citrato de trietilo (10% en peso, referido al peso de poli (acetato de vinilo) ) y talco (10% en peso, referido al peso de poli (acetato de vinilo) ) , así como un recubrimiento protector de hidroxipropilmetilcelulosa y dióxido de silicio coloidal (2% en peso de recubrimiento protector, referido al peso de las pellas con el recubrimiento de poli (acetato de vinilo) ) . Se representa la liberación acumulada (%) , representada frente al tiempo. Las curvas muestran la liberación de las propias pellas, así como de comprimidos, que se prepararon bajo diferentes condiciones.
La serie de medición A se refiere a comprimidos que se prepararon con una presión de compresión de 141 MPa y presentan una dureza de 80 N, así como un tiempo de disgregación inferior a 1 minuto. La serie de medición B se refiere a comprimidos que se prepararon con una presión de compresión de 168 MPa y presentan una dureza de 125 N, así como un tiempo de disgregación de 1 a 2 minutos. La serie de medición C se refiere a comprimidos... [Seguir leyendo]
Reivindicaciones:
1. Pella farmacéutica que comprende un núcleo esférico que contienen principio activo con superficie lisa y un recubrimiento sobre el núcleo, que controla la liberación de principio activo independientemente del pH, presentando el núcleo una rugosidad media de menos de 10 µm y preferiblemente de menos de 7, 5 µm y/o una rugosidad media relativa de menos del 2%.
2. Pella según la reivindicación 1, presentando el núcleo una relación longitud-anchura de, por ejemplo, menos de aproximadamente 1, 4, preferiblemente menos de aproximadamente 1, 3, más preferiblemente menos de aproximadamente 1, 2, todavía más preferiblemente menos de aproximadamente 1, 1 y especialmente menos de 1, 05.
3. Pella según la reivindicación 1 o 2, presentando el núcleo un diámetro en el intervalo de 0, 2 a 2 mm, especialmente de 0, 4 a 1, 6 mm, y muy especialmente de 0, 4 a 1, 4 mm.
4. Pella según una de las reivindicaciones precedentes, conteniendo el recubrimiento un polímero que se selecciona de entre copolímero de metacrilato de amonio, acetato-butirato de celulosa, acetato de celulosa, acetato-propionato de celulosa, etilcelulosa, poli (acrilato de etilo-acrilato de metilo) y poli (acetato de vinilo) .
5. Pella según una de las reivindicaciones precedentes, estando previsto adicionalmente un recubrimiento protector externo que contiene un formador de película soluble en agua, preferiblemente hidroxipropilmetilcelulosa, y/o estando previsto entre el núcleo que contienen principio activo y el recubrimiento que controla la liberación de principio activo una capa intermedia que contiene un formador de película soluble en agua, preferiblemente hidroxipropilmetilcelulosa.
6. Pella según una de las reivindicaciones precedentes, estando construido el núcleo de un núcleo semilla libre de principio activo y de una capa que contiene principio activo que se encuentra sobre el mismo, conteniendo el núcleo semilla preferiblemente uno o varios hidratos de carbono y estando seleccionado de entre perlas de azúcar y perlas de celulosa microcristalina.
7. Pella según la reivindicación 6, conteniendo la capa que contiene principio activo el 50% o más, preferiblemente el 70% o más, de principio activo.
8. Pella según una de las reivindicaciones 1 a 5, conteniendo el núcleo el principio activo en distribución homogénea, y conteniendo el núcleo, además del principio activo, un vehículo y/o un aglutinante.
9. Pella según una de las reivindicaciones precedentes, tratándose en el caso del principio activo de un principio activo soluble en agua o una sal soluble en agua de un principio activo difícilmente soluble.
10. Pella según una de las reivindicaciones precedentes, siguiendo la liberación del principio activo un perfil con una fase de latencia de 60 minutos a 840 minutos, preferiblemente de 60 minutos a 540 minutos, liberándose durante la fase de latencia una proporción del 5% en peso o menos del principio activo y/o liberándose después de una fase de latencia en el transcurso de 60 minutos al menos el 80% en peso del principio activo todavía restante.
11. Pella según una de las reivindicaciones 1 a 10, liberándose el principio activo de la pella con un perfil de manera que después de una fase de latencia la liberación del principio activo ascienda a entre el 3 y el 25% en peso por hora, preferiblemente entre el 3 y el 15% en peso por hora, especialmente entre el 3 y el 6, 5% en peso por hora.
12. Colectivo de pellas, correspondiéndose al menos el 90% con la definición según una de las reivindicaciones precedentes, presentando las pellas preferiblemente una distribución de tamaños de partícula tal que el 90% de las pellas tengan un diámetro que se desvía del diámetro medio no más de la mitad del diámetro medio.
13. Colectivo de núcleos, cumpliendo al menos el 90% los requisitos de los núcleos según una de las reivindicaciones 1 a 3.
14. Procedimiento para la preparación de una pella según una de las reivindicaciones 1 a 11 precedentes, comprendiendo el procedimiento las siguientes etapas:
(a) Proporcionar un núcleo de pella que contiene principio activo con una relación longitud-anchura de menos de aproximadamente 1, 4 y una rugosidad media de menos de 10 µm y/o una rugosidad media relativa de menos del 2%;
(b) Pulverizar una disolución o dispersión acuosa u orgánica que contiene un formador de película que
controla la liberación de principio activo independientemente del pH.
15. Procedimiento para la preparación de un comprimido que comprende las siguientes etapas:
(a) Mezclar las pellas según una de las reivindicaciones 1 a 5 con uno o varios constituyentes, seleccionados de entre cargas, aglutinantes, disgregantes, reguladores del flujo y lubricantes, con formación de una mezcla; 5 y
(b) Comprimir la mezcla con formación de un comprimido, disgregándose durante la etapa de compresión preferiblemente una proporción de las pellas, de manera que la liberación del principio activo de los comprimidos no muestre ninguna fase de latencia.
16. Comprimidos que pueden prepararse según un procedimiento según la reivindicación 15. 10
Patentes similares o relacionadas:
Unidad de dosificación farmacéutica sólida desintegrante por vía oral que contiene una sustancia de control de partos, del 22 de Julio de 2020, de Oxytone Bioscience B.V: Unidad de dosificacion farmaceutica solida desintegrante por via oral que tiene un peso de entre 50 y 1.000 mg, donde dicha unidad de dosificacion consiste en: • 5-100 […]
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]
COMPOSICIONES DE ALPRAZOLAM AMORFO CON ACTIVIDAD ANSIOLÍTICA, CON ETILCELULOSA Y CROSPOVIDONA, Y PROCEDIMIENTOS CORRESPONDIENTES, del 18 de Junio de 2020, de LABORATORIOS BAGO S.A.: Composición de alprazolam amorfo con actividad ansiolítica que comprende: a) una premezcla que contiene: - entre 0,33 y 0,66% p/p de alprazolam; - entre […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Composiciones de polifenol, del 3 de Junio de 2020, de Nugerontix Limited: Enoteína B para uso en terapia para tratar, prevenir o retrasar la aparición de disfunción endotelial donde el tratamiento, prevención o retraso comprende […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]