Polipéptidos y procedimiento para la detección específica de anticuerpos en pacientes con una infección por Borrelia.
Proteína que comprende un primer polipéptido de OspC, caracterizada porque el primer polipéptido de OspC está unidoa través de un puente disulfuro con un segundo polipéptido de OspC,
formándose el puente disulfuro por unión de unacisteína que no está alejada más de 100 posiciones de aminoácidos del extremo N-terminal del polipéptido de OspC,presentando el primer y el segundo polipéptido de OspC una identidad de aminoácidos de al menos el 70% con la SEC IDNº: 3, SEC ID Nº: 6 o SEC ID Nº: 9.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08021660.
Solicitante: EUROIMMUN MEDIZINISCHE LABORDIAGNOSTIKA AG.
Nacionalidad solicitante: Alemania.
Dirección: SEEKAMP 31 23560 LÜBECK ALEMANIA.
Inventor/es: PROBST,Christian, KOMOROWSKI,Lars, JANSSEN,ANTHONINA, STOECKER,WINFRIED.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Spirochaetales (O), p. ej. Treponema, Leptospira.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
PDF original: ES-2421885_T3.pdf
Fragmento de la descripción:
Polipéptidos y procedimiento para la detección específica de anticuerpos en pacientes con una infección por Borrelia.
La presente invención se refiere a polipéptidos derivados de OspC (“Outer surface Protein C”) de bacterias del genero Borrelia, en especial a una proteína conforme a la reivindicación 1, que comprende un primer polipéptido de OspC, estando unido el primer polipéptido de OspC a través de un puente disulfuro con un segundo polipéptido de OspC. La invención se refiere también a un procedimiento para la detección de anticuerpos contra OspC conforme a la reivindicación 10 y a un procedimiento para la detección de una infección por Borrelia conforme a la reivindicación 11, en el que se utiliza una proteína conforme a la invención, precisamente como un kit de diagnóstico conforme a la reivindicación 13 y a una vacuna contra Borrelia conforme a la reivindicación 15.
Estado de la técnica Las bacterias del genero Borrelia están descritas como agentes patógenos de varias enfermedades humanas, en especial como agente patógeno de la borreliosis de Lyme y de la fiebre recurrente. La detección de una infección se realiza hoy en día mayoritariamente por medio de la determinación de anticuerpos específicos contra las bacterias en líquidos corporales humanos o animales. A este respecto, la presencia de anticuerpos específicos contra antígenos que solo se presentan en Borrelia indica una infección por Borrelia. Las fases tempranas de la infección, en especial infecciones recientes de hasta cuatro semanas después del primer contacto, se caracterizan por la presencia de anticuerpos de la clase IgM, en especial contra los antígenos OspC, p41 (flagelina) y P39 (BmpA) , mientras que fases tardías, en especial infecciones finalizadas, curadas o que se manifiestan crónicamente, conllevan la presencia de anticuerpos de la clase IgG, en especial contra los antígenos VisE, P83/P100, P58, OspA, p41 (flagelina) , P39, P18 y otros (Wilske y Fingerle, 2005) .
Un diagnóstico temprano de la enfermedad es especialmente importante ya que una terapia con antibióticos es más exitosa y sencilla en los estadios tempranos que en los estadios tardíos, así p.ej. en la fase temprana es posible todavía una terapia oral con antibióticos.
Como marcador más importante para una fase temprana de la enfermedad son válidos anticuerpos comunes contra OspC de la clase IgM. En el caso de la de OspC nativa se trata de una proteína de membrana de la familia de las lipoproteínas 6 con un ácido graso acilado que está anclada en la membrana celular exterior (Norris y col., 1992; Hagman y col., 1998) . El resto acilo, durante la expresión, paralelamente a la escisión de la secuencia señal por peptidasa de señal II, se adhiere a la única cisteína conservada presente en la secuencia de aminoácidos de la OspC (Wu y Tokunaga, 1986) . Sirve como anclaje a la membrana celular lipídica.
Como epítopo más importante para reacciones con anticuerpos humanos de la clase IgM dentro de la OspC vale en general un péptido C-terminal conservado de diez restos de aminoácidos cuyo grupo carboxilo terminal debe ser libremente accesible (Mathiesen y col., 1998a; Mathiesen y col., 1998b) como también se menciona en la publicación de patente PCT WO 9742221. Además de esto están descritos epítopos en la región central poco conservada de la OspC (Earnhart y col., 2005) .
Para la detección de los anticuerpos se utilizan normalmente antígenos purificados de Borrelia en ensayos inmunobioquímicos como ELISA, transferencia por líneas o de Western. En el procedimiento se unen habitualmente antígenos individuales o varios a una fase sólida con la que se pone en contacto un líquido corporal a analizar y los anticuerpos unidos se detectan por medio de una molécula informadora. Tales kits se comercializan p.ej. por EUROIMMUN AG como EUROLINE-WB y Anti-Borrelia-plus-VisE-ELISA. Procedimientos similares están descritos en la literatura (Hansen y col., 1988; Cutler y Wright, 1989; Fister y col., 1989) .
Los procedimientos que solo se basan en preparados no recombinantes solo pueden reproducirse con gran despliegue de medios y son por lo tanto muy costosos, ya que para el cultivo in vitro de Borrelia se utilizan esencialmente medios de cultivo complejos que contienen componentes naturales no definidos químicamente, como fracciones séricas de mamíferos que contienen proteínas y mezclas complejas de proteínas, p.ej. extractos musculares tratados proteolíticamente, extractos de levadura o gelatina. Un kit comercial basado en esto puede obtenerse p.ej. en Sigma Aldrich (Complete BSK-H) . Composiciones similares están descritas en la literatura con las denominaciones MKP y BSK II (Ruzic-Sabljic y Strie, 2004) .
Es un inconveniente que los componentes no definidos químicamente de estos medios sufren fuertes oscilaciones en sus composiciones de carga a carga, entrañan el riesgo de la impurificación con virus o micoplasmas y son muy costosos de producir. De forma correspondiente, las Borrelia cultivadas in vitro muestran habitualmente, dependiendo de los medios de cultivo respectivamente utilizados o dependiendo de los distintos componentes de los medios de cultivo respectivamente utilizados, fuertes oscilaciones de sus tasas de crecimiento y de su patrón de expresión génica. En especial se han encontrado genes de estas que se expresan in vivo en función del correspondiente organismo huésped (Pollack y col., 1993; Yang y col., 2001) . Esto es válido en especial para la OspC. Además también tienen la temperatura de cultivo así como la concentración de oxígeno y dióxido de carbono una influencia decisiva sobre el tipo y la cantidad de las proteínas expresadas (Seshu y col., 2004; Hy de y col., 2007) . De este modo pueden compararse entre sí con dificultad en especial los resultados de distintos laboratorios que cultiven Borrelia.
Los procedimientos que se basan en antígenos purificados individuales de Borrelia cultivadas in vitro son además propensas a reacciones inespecíficas que se producen por la presencia de otras impurezas no suficientemente reducidas. En especial en procedimientos que solo generan una señal, como por ejemplo ELISA o transferencia por lineas, se obtienen pues con regularidad falsos resultados positivos. Por el contrario, las transferencias de Western, que evitan este problema mediante la resolución local de las señales, presentan el inconveniente de que generan un coste adicional substancial debido a la necesaria electroforesis y la transferencia a una membrana.
En otros procedimientos se usan antígenos que se obtienen por técnicas recombinantes, p.ej. por expresión heteróloga de antígenos o fragmentos de antígenos en E, coli, como se menciona p.ej. en la publicación de patente europea EP 0506868. Son variantes que pueden obtenerse comercialmente p.ej. EUROLINE-WB y Anti-Borrelia-plus-VisE-ELISA (IgG) y la línea recombinante recomline Borrelia IgM (Mikrogen) . En la literatura están descritos procedimientos similares (Hauser y col., 1998; Lawrenz y col., 1999; Wilske y Fingerle, 2005) . En general los antígenos recombinantes presentan la ventaja de que pueden purificarse, p.ej. por fusión con polipéptidos de purificación, p.ej. con la marca de polihistidina (= His-tag) , de manera definida y con menor coste que los antígenos nativos.
Es posible la expresión heteróloga de OspC, incluso de la secuencia señal propia de él, en E. coli y la subsiguiente acilación, pero conduce sin embargo a una menos eficiencia de expresión (Fuchs y col., 1992) . Por ello se utilizan en general construcciones de deleción de la OspC con eficiencia de expresión incrementada en las que falta al menos la secuencia señal. A este respecto, en el estado de la técnica se delecionan al menos los primeros 19 aminoácidos de la OspC, incluso la cisteína presente en la secuencia de aminoácidos de la OspC (Fuchs y col., 1992; Wilske y col., 1993; Wilske y col., 1995; Eicken y col., 2001; Kumaran y col., 2001) y en algunos casos se completa por fusión N-terminal con pelipétidos heterólogos, por ejemplo con His-tag.
Tales variantes acortadas N-terminalmente se han utilizado también para la elucidación de la estructura espacial de la OspC (Kumaran y col., 2001; Eicken y col., 2001) . Para ello se delecionan los 31 primeros (Eicken y col., 2001) o 37 (Kumaran y col., 2001) restos de aminoácidos de la OspC en las variantes recombinantes de OspC para conseguir en especial una cantidad y pureza adecuadas de la OspC. De las dos estructuras espaciales de ejemplo se desprende que la OspC recombinante tiende a la dimerización. Esta dimerización se produce debido a las interacciones iónicas y enlaces de puente de hidrógeno, pero no por un enlace covalente.
Hay también... [Seguir leyendo]
Reivindicaciones:
1. Proteína que comprende un primer polipéptido de OspC, caracterizada porque el primer polipéptido de OspC está unido a través de un puente disulfuro con un segundo polipéptido de OspC, formándose el puente disulfuro por unión de una cisteína que no está alejada más de 100 posiciones de aminoácidos del extremo N-terminal del polipéptido de OspC, presentando el primer y el segundo polipéptido de OspC una identidad de aminoácidos de al menos el 70% con la SEC ID Nº: 3, SEC ID Nº: 6 o SEC ID Nº: 9.
2. Proteína conforme a la reivindicación 1, caracterizada porque el primer y/o el segundo polipéptido de OspC presenta una identidad de aminoácidos de al menos el 90% con la SEC ID Nº: 3, SEC ID Nº: 6 o SEC ID Nº: 9 y es reconocido específicamente por anticuerpos contra OspC de Borrelia.
3. Proteína conforme a la reivindicación 1 ó 2, caracterizada porque el primer y/o el segundo polipéptido de OspC comprende al menos un epítopo que es reconocido específicamente por anticuerpos contra OspC de Borrelia, comprendiendo el epítopo al menos una secuencia parcial de 10 aminoácidos consecutivos de la SEC ID Nº: 3, SEC ID Nº: 6 o SEC ID Nº: 9.
4. Proteína conforme a una de las reivindicaciones 1 a 3, caracterizada porque el primer y/o el segundo polipéptido de OspC C-terminal presenta una de las secuencias de aminoácidos según SEC ID Nº: 3, SEC ID Nº: 6 o SEC ID Nº: 9.
5. Proteína conforme a una de las reivindicaciones 1 a 4, caracterizada porque el primer y/o el segundo polipéptido de OspC no presenta ninguna secuencia de reconocimiento para una acilación.
6. Proteína conforme a una de las reivindicaciones 1 a 5, caracterizada porque el puente disulfuro se forma por unión de una cisteína que no está alejada más de 30 posiciones de aminoácidos del extremo N-terminal del primer y/o del segundo polipéptido de OspC.
7. Proteína conforme a una de las reivindicaciones 1 a 6, caracterizada porque el primer y/o el segundo polipéptido de OspC C-terminal presenta una secuencia según SEC ID Nº: 2, SEC ID Nº: 5 o SEC ID Nº: 6.
8. Proteína conforme a una de las reivindicaciones 1 a 7, caracterizada porque mediante el puente disulfuro se forma un homodímero de dos polipéptidos de OspC iguales o un heterodímero de distintos polipéptidos de OspC.
9. Proteína conforme a una de las reivindicaciones 1 a 8, caracterizada porque el reconocimiento del polipéptido por anticuerpos contra OspC de Borrelia se reduce al ponerlo en contacto con al menos un reactivo que contenga tiol, dado el caso en combinación con un haluro de alquilo.
10. Procedimiento para la detección de anticuerpos contra una proteína conforme a una de las reivindicaciones 1 a 9, en el que se pone en contacto una muestra biológica con la proteína conforme a una de las reivindicaciones 1 a 9 y se detecta la unión de anticuerpos a la proteína.
11. Procedimiento para el diagnóstico de una infección por Borrelia, caracterizado porque se pone en contacto una muestra biológica de un paciente con una proteína conforme a una de las reivindicaciones 1 a 9 y se detecta la unión de anticuerpos a la proteína, indicando una detección de la unión de anticuerpos una infección por Borrelia.
12. Procedimiento conforme a una de las reivindicaciones 10 u 11, caracterizado porque la unión de los anticuerpos se detecta con un ensayo de inmunofluorescencia, ELISA, ensayo de luminiscencia, transferencia de Western, transferencia por líneas o transferencia por puntos.
13. Kit para el diagnóstico de una infección por Borrelia que comprende una proteína conforme a una de las reivindicaciones 1 a 9.
14. Uso de una proteína conforme a una de las reivindicaciones 1 a 9 para la producción de una vacuna contra una infección por Borrelia.
15. Vacuna contra una infección por Borrelia que comprenda una proteína conforme a una de las reivindicaciones 1 a 9.
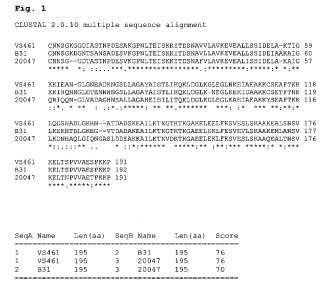
SecA Nombre Long (aa) SecB Nombre Long (aa) Puntuación
1 1 2 VS461 VS461 B31 195 195 195 2 3 3 B31 20047 20047 195 195 195 76 76 70
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]
Bebidas energéticas y otras ayudas nutricionales derivadas de licores a base de agave, del 1 de Julio de 2020, de Roar Holding, LLC: Una composición que comprende compuestos inhibidores de monoamino oxidasa (MAO), cuya composición se prepara mediante la eliminación de etanol de una bebida […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Marcadores celulares para el diagnóstico de la enfermedad de Alzheimer y para la progresión de la enfermedad de Alzheimer, del 17 de Junio de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un método para el diagnóstico de la probabilidad de la enfermedad de Alzheimer (EA) en un individuo examinado, que comprende: (i) medir los […]
Biomarcadores de TB, del 22 de Abril de 2020, de United Kingdom Research and Innovation: Un método para el diagnóstico de TB en un sujeto, comprendiendo el método: (a) proporcionar una muestra de dicho sujeto, siendo dicha muestra seleccionada […]
Procedimiento para detectar bacterias coliformes contenidas en la leche, del 15 de Abril de 2020, de ASAHI KASEI KABUSHIKI KAISHA: Procedimiento para lisar bacterias coliformes contenidas en la leche, que comprende la etapa de mezclar un agente de lisis que contiene lisozima, un surfactante aniónico […]