Polipéptidos de fusión y su utilización para la terapia tumoral antivascular.
Polipéptido de fusión, que comprende
a) un péptido que presenta de 3 a 30 aminoácidos,
que permite unir selectivamente los polipéptidos de fusión alas células endoteliales de los vasos tumorales; y
b) el factor tisular TF (Tissue Factor) o un fragmento del mismo, estando caracterizado el factor tisular y elfragmento porque pueden activar la coagulación sanguínea cuando el polipéptido de fusión se une a lascélulas endoteliales de los vasos tumorales,
en el que los péptidos a) y b) están unidos entre sí directamente o mediante un conector que presenta hastaaminoácidos, caracterizado porque el péptido, que permite unir selectivamente el polipéptido de fusión alas células endoteliales de los vasos tumorales está unido al extremo C del péptido, que puede activar lacoagulación sanguínea cuando el polipéptido de fusión se une a las células endoteliales de los vasostumorales.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/009364.
Solicitante: Berdel, Wolfgang.
Nacionalidad solicitante: Alemania.
Dirección: Raesfeldstrasse 40 48149 Münster ALEMANIA.
Inventor/es: BERDEL,WOLFGANG E, MESTERS,ROLF M.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de coagulación sanguínea o de fibrinolisis.
- C07K14/745 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de coagulación sanguínea o de fibrinolisis.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
PDF original: ES-2397922_T3.pdf
Fragmento de la descripción:
Polipéptidos de fusión y su utilización para la terapia tumoral antivascular.
La presente invención se refiere a polipéptidos de fusión que comprenden, por lo menos, dos péptidos. Un péptido consiste en de 3 a 30 aminoácidos y permite que el polipéptido de fusión se una selectivamente a las células endoteliales de los vasos tumorales. El otro péptido consiste en factor tisular TF (Tissue Factor) o un fragmento del mismo, estando caracterizado dicho factor tisular y su fragmento porque pueden activar la coagulación sanguínea tras la unión del polipéptido de fusión a las células endoteliales de los vasos tumorales. Los péptidos se pueden unir entre sí directamente o a través de un conector que presenta hasta 15 aminoácidos. La presente invención se refiere además a la utilización de estas proteínas de fusión en la terapia antivascular de enfermedades neoplásicas y a su utilización en la preparación de un medicamento para el tratamiento de enfermedades neoplásicas.
Antecedentes de la invención Una neovascularización adecuada es un prerrequisito para el crecimiento progresivo del tumor (1) . La neoangiogénesis resulta necesaria, particularmente, para mantener el crecimiento expansivo del tumor, ya que únicamente una oxigenación suficiente puede garantizar el suministro de nutrientes al tumor y la eliminación de sus productos de degradación.
En la técnica de tratamientos tumorales anterior, se han desarrollado estrategias terapéuticas antivasculares dirigidas a la destrucción de los vasos sanguíneos del tumor y al infarto tumoral asociado, además de estrategias terapéuticas antiangiogénicas, que atacan el complejo proceso de crecimiento y diferenciación de los vasos sanguíneos.
Una condición previa para llevar a cabo estas estrategias es la identificación de las estructuras diana del endotelio vascular del tumor que no se presentan en las otras células endoteliales del tejido normal. Estas estructuras diana específicas se podrían utilizar para aplicar agentes citostáticos o determinadas toxinas a las células endoteliales vasculares del tumor y, en menor medida, a las células tumorales en sí.
Entre las estructuras diana que se pueden utilizar para este propósito se encuentran el bFGF (factor de crecimiento básico de fibroblastos) , el VEGF (factor de crecimiento endotelial vascular) y el VEGFR-2 (receptor 2 de VEGF) , endoglina, endosialina, una isoforma de fibronectina (dominios ED-B) , las integrinas avß3, avß5, a1ß1 y a1ß2, aminopeptidasa N, proteoglicano NG2 y las metaloproteinasas de matriz 2 y 9 (MMP 2 y 9) (2-13) . Por ejemplo, Arap y otros (8) acoplaron péptidos que se unen específicamente a las integrinas alfa 1 a una sustancia activa que se estaba utilizando para quimioterapia en el estado de la técnica (doxorrubicina) . Se demostró en un modelo animal que el efecto antineoplásico de la doxorrubicina se podía mejorar mediante el acoplamiento a los péptidos.
Un enfoque terapéutico antivascular alternativo comprende la activación selectiva de la coagulación sanguínea en los vasos tumorales a fin de inducir la necrosis tumoral. Por ejemplo, se obtuvo un fragmento de anticuerpo biespecífico F (ab’) 2 y se dirigió contra el factor tisular truncado (truncated tissue factor, tTF) y un antígeno MHC de clase II. Tras la inducción experimental del antígeno en las células endoteliales del tumor, se pudo poner de manifiesto una terapia antivascular mediante la administración del anticuerpo en un modelo de neuroblastoma murino (14 y 47) . En un segundo estudio del mismo equipo, se utilizó un inmunoconjugado que une selectivamente el tTF a un marcador de origen natural del endotelio de los vasos tumorales, la VCAM-1 (molécula de adhesión de células vasculares 1) (15) .
En un enfoque muy parecido, se fusionó un fragmento de anticuerpo (scFv) , que es específico para el dominio oncofetal ED-B, con el tTF. Las proteínas de fusión generadas, scFv-tTF, dieron lugar a un infarto completo y selectivo en diversos tumores del modelo de ratón (16) .
Alternativamente, el tTF se unió a un inhibidor del antígeno de membrana específico de la próstata (17) . Esta proteína de fusión indujo una necrosis selectiva por infarto en un modelo de próstata de rata tras la administración intravenosa. La administración de esta proteína de fusión junto con una sustancia citotóxica (doxorrubicina) en dosis bajas dio lugar a la regresión masiva del tumor e incluso a su erradicación completa (17) . Recientemente se han descrito otras proteínas de fusión de tTF que consisten en fragmentos de anticuerpo contra VEGFR, endoglina y VCAM-1 (18) .
Sin embargo, las moléculas producidas para la terapia tumoral antivascular según el estado de la técnica presentan desventajas. Particularmente, hay que suponer que, debido a su tamaño, dichas moléculas son inmunógenas. Por consiguiente, el tratamiento de mamíferos con estas moléculas desencadena una reacción inmunitaria contra las mismas, de tal modo que resulta imposible administrarlas de forma reiterada.
Además, el tamaño de la pareja de acoplamiento, a través de la cual se debe dirigir hacia el tejido tumoral la porción peptídica capaz de activar la coagulación sanguínea, puede provocar impedimentos estéricos a la formación del complejo enzima-sustrato macromolecular factor VIIa/FX, importante para la coagulación. La formación del complejo también se puede ver obstaculizada si el péptido capaz de activar la coagulación sanguínea presenta una conformación modificada debido a las parejas de fusión relativamente grandes.
En el estado de la técnica (documento WO 03/035688) , también se conocen polipéptidos de fusión en los que un dominio de unión selectiva, por ejemplo, un dominio de fibronectina que se une a las integrinas, que comprende por ejemplo péptidos RGD, o el dipéptido D-ß-E, que se une a PSMA (antígeno de membrana específico de la próstata) , se une al extremo N de un polipéptido del factor tisular. Aunque se demostró in vitro un efecto amidolítico y proteolítico, los constructos, incluso combinados con el factor VIIa, sólo exhibieron un efecto antitumoral in vivo extremadamente débil. Los animales sólo sobrevivieron más tiempo en combinación con doxiciclina.
Hu et al. (46) describen diversas proteínas de fusión y su utilización para la obtención de trombosis en los vasos tumorales, incluida una proteína de fusión de un oligopéptido de 9 aminoácidos que contiene la secuencia RGD, que se unió a la forma truncada del factor tisular. De nuevo, los péptidos RGD se unieron al extremo N del tTF y se obtuvo RGD-tTF. El análisis funcional puso de manifiesto que la proteína de fusión que contenía RGD no producía ninguna inhibición significativa del crecimiento tumoral.
Así, los constructos conocidos en el estado de la técnica se construyeron de tal modo que el dominio de unión selectiva estaba unido al extremo N del polipéptido del factor tisular. Incluso se subrayó que esta estructura era la que se debía escoger, ya que, basándose en modelos estructurales, el extremo N se consideraba un sitio particularmente favorable para la unión, lo que no inhibiría el inicio de la trombosis.
Sumario de la invención Por consiguiente, teniendo en cuenta la técnica anterior, el problema consiste en dar a conocer sustancias trombógenas alternativas que puedan inhibir eficazmente el crecimiento tumoral in vivo.
Ahora, este problema se ha resuelto mediante polipéptidos de fusión que comprenden un péptido que presenta de 3 a 30 aminoácidos, lo que permite que el polipéptido de fusión se una selectivamente a las células endoteliales de los vasos tumorales, y el factor tisular TF (tissue factor) o un fragmento del mismo, caracterizándose el factor tisular y el fragmento porque son capaces de activar la coagulación sanguínea cuando el polipéptido de fusión se une a las células endoteliales de los vasos tumorales, uniéndose dichos péptidos entre sí directamente o a través de un conector que presenta hasta 15 aminoácidos. El péptido, que permite que el polipéptido de fusión se una selectivamente a las células endoteliales de los vasos tumorales, está unido al extremo C del péptido, que puede activar la coagulación sanguínea, cuando el polipéptido de fusión se une a las células endoteliales de los vasos tumorales. La presente invención se refiere además a medicamentos que contienen polipéptidos de fusión correspondientes y a su utilización para el tratamiento de tumores.
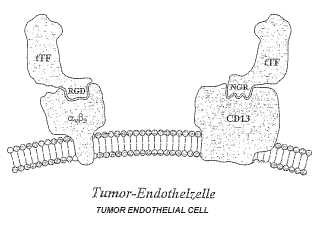
Descripción de las figuras Figura 1: Representación esquemática de la unión de las proteínas de fusión de tTF-RGD y tTF-NGR a avß3 y CD13. La selectividad tumoral se consigue gracias a la especificidad de la secuencia... [Seguir leyendo]
Reivindicaciones:
1. Polipéptido de fusión, que comprende a) un péptido que presenta de 3 a 30 aminoácidos, que permite unir selectivamente los polipéptidos de fusión a las células endoteliales de los vasos tumorales; y
b) el factor tisular TF (Tissue Factor) o un fragmento del mismo, estando caracterizado el factor tisular y el fragmento porque pueden activar la coagulación sanguínea cuando el polipéptido de fusión se une a las 10 células endoteliales de los vasos tumorales,
en el que los péptidos a) y b) están unidos entre sí directamente o mediante un conector que presenta hasta 15 aminoácidos, caracterizado porque el péptido, que permite unir selectivamente el polipéptido de fusión a las células endoteliales de los vasos tumorales está unido al extremo C del péptido, que puede activar la coagulación sanguínea cuando el polipéptido de fusión se une a las células endoteliales de los vasos tumorales.
2. Polipéptido de fusión según la reivindicación 1, que consiste en los péptidos a) y b) , y en un conector que presenta hasta 15 aminoácidos. 20
3. Polipéptido de fusión según la reivindicación 1, en el que los péptidos a) y b) están directamente unidos entre sí.
4. Polipéptido de fusión según una de las reivindicaciones 1 a 3, caracterizado porque el péptido, que puede activar
la coagulación sanguínea cuando el polipéptido de fusión se une a las células endoteliales de los vasos tumorales es 25 el factor tisular TF, que presenta la secuencia mostrada en SEC ID NO: 1.
5. Polipéptido de fusión según una de las reivindicaciones 1 a 3, caracterizado porque el péptido, que puede activar la coagulación sanguínea cuando el polipéptido de fusión se une a las células endoteliales de los vasos tumorales es un fragmento del factor tisular TF, que presenta preferentemente la secuencia mostrada en SEC ID NO: 2.
6. Polipéptido de fusión según una de las reivindicaciones 1 a 5, caracterizado porque el péptido que presenta de 3 a 30 aminoácidos, que permite unir selectivamente el polipéptido de fusión a las células endoteliales de los vasos tumorales presenta una estructura lineal o cíclica.
7. Polipéptido de fusión según una de las reivindicaciones 1 a 6, caracterizado porque el péptido que presenta de 3 a 30 aminoácidos, que permite unir selectivamente el polipéptido de fusión a las células endoteliales de los vasos tumorales comprende la secuencia de aminoácidos RGD o NGR.
8. Polipéptido de fusión según la reivindicación 7, caracterizado porque el péptido, que permite unir selectivamente el polipéptido de fusión a las células endoteliales de los vasos tumorales se selecciona de entre el grupo constituido por GRGDSP y GNGRAHA.
9. Polipéptido de fusión según la reivindicación 7, caracterizado porque el péptido, que permite unir selectivamente el polipéptido de fusión a las células endoteliales de los vasos tumorales se selecciona de entre el grupo constituido 45 por GCNGRCG, GCNGRCVSGCAGRC, GCVLNGRMEC y GALNGRSHAG.
10. Polipéptido de fusión según las reivindicaciones 1 a 9, caracterizado porque presenta una de las secuencias mostradas en SEC ID NO: 3-8.
11. Ácido nucleico, que codifica un polipéptido de fusión según una de las reivindicaciones 1 a 10.
12. Ácido nucleico según la reivindicación 11, caracterizado porque presenta una de las secuencias mostradas en SEC ID NO: 10-15.
13. Vector, que comprende un ácido nucleico según la reivindicación 11 o 12.
14. Célula, que comprende un ácido nucleico según la reivindicación 11 o 12, o un vector según la reivindicación 14.
15. Medicamento, que comprende un polipéptido de fusión según una de las reivindicaciones 1 a 10, un ácido 60 nucleico según la reivindicación 11 o 12, un vector según la reivindicación 13 o una célula según la reivindicación 14.
16. Medicamento según la reivindicación 15, que comprende además vehículos, excipientes o adyuvantes farmacéuticamente aceptables.
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]