Polimorfos de un principio activo farmacéutico.
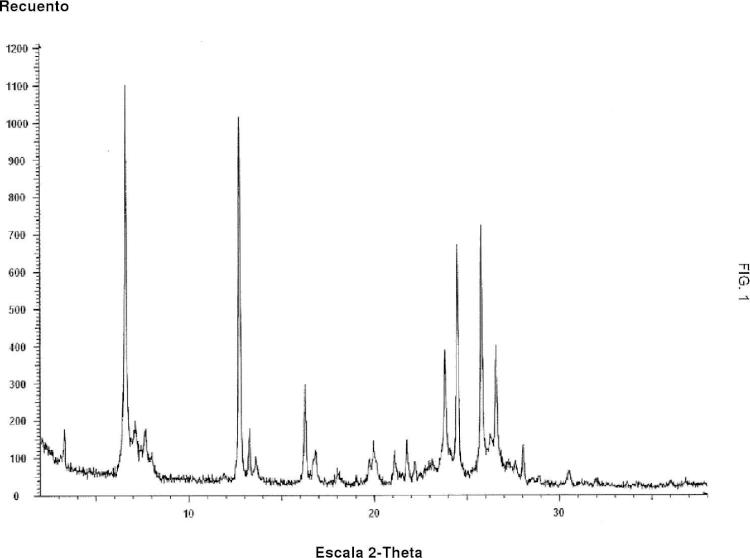
Composición farmacéutica que comprende una forma cristalina de Febuxostat con un patrón de difracción de polvo de rayos X medido utilizando radiación CuKα
1,2 a una longitud de onda de 0,15419 nm que comprende picos a ángulos 2-theta de 6,6 +- 0,2º, 12,8 +- 0,2º, 24,5 +- 0,2º, 25,8 +- 0,2º, 26,6 +- 0,2º, y que está caracterizada por un espectro IR que incluye bandas de absorción a los números de onda de 2960 +- 2 cm-1, 2874 +- 2 cm-1, 2535 +- 2 cm-1, 2229 +- 2 cm-1, 1673 +- 2 cm-1, 1605 +- 2 cm-1, 1509 +- 2 cm-1, 1422 +- 2 cm-1, 1368 +- 2 cm-1, 1323 +- 5 2 cm-1, 1274 +- 2 cm-1, 1166 +- 2 cm-1, 1116 +- 2 cm-1, 1045 +- 2 cm-1, 1013 +- 2 cm-1, 911 +- 2 cm-1, 820 +- 2 cm-1, 763 +- 2 cm-1 y 725 +- 2 cm-1 medido utilizando una celda de reflexión total atenuada (ATR) de diamante, yque adicionalmente comprende al menos un excipiente farmacéuticamente aceptable.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/060630.
Solicitante: SANDOZ AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: HOTTER,ANDREAS, GRIESSER,ULRICH, LANGES,CHRISTOPH, ADAMER,VERENA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/425 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Tiazoles.
- A61P19/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › Agentes antigotosos, p.ej.agentes antihiperuricémicos o uricosúricos.
- C07D277/56 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 277/00 Compuestos heterocíclicos que contienen ciclos de tiazol-1,3 o tiazol-1,3 hidrogenado. › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo más un enlace a halógeno.
PDF original: ES-2553574_T3.pdf


Patentes similares o relacionadas:
Composiciones con fragancia de liberación prolongada, del 29 de Abril de 2020, de AVON PRODUCTS, INC.: Una composición para proveer una liberación prolongada de fragancia que comprende: (a) un elastómero de silicona entrecruzado modificado hidrofílicamente;- […]
Análogos de quinolona y métodos relacionados con los mismos, del 29 de Abril de 2020, de Senhwa Biosciences, Inc: Un compuesto de fórmula (VIII), **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable del mismo; en donde: A y V son independientemente […]
ITE para la intervención y erradicación del cáncer, del 25 de Marzo de 2020, de Ariagen, Inc: Un agente terapéutico para el uso en el tratamiento del cáncer en un sujeto, en donde el cáncer se selecciona del grupo que consiste en cáncer […]
Síntesis eficiente de conjugados de etilendicisteína-azúcar para la obtención de imágenes y terapia, del 8 de Enero de 2020, de BOARD OF REGENTS THE UNIVERSITY OF TEXAS SYSTEM: Un procedimiento para preparar un conjugado de tiazolidina-azúcar que comprende mezclar un amino azúcar con un ácido tiazolidina-carboxílico, produciendo así el conjugado […]
Uso de aril- y hetarilcarboxamidas como endoparasiticidas, del 6 de Noviembre de 2019, de Bayer Intellectual Property GmbH: Compuestos de acuerdo con la fórmula (I)**Fórmula** en los que X representa fenilo, tienilo o furanilo sustituidos una o varias veces con M1; Q representa […]
Composiciones, formulaciones y métodos para tratar enfermedades oculares, del 23 de Octubre de 2019, de Aerpio Therapeutics Inc: Una composición farmacéutica que comprende un compuesto que activa Tie-2 y 2-hidroxipropil-beta ciclodextrina, para su uso en el tratamiento de una afección, […]
 Inhibidores de la ARN polimerasa I y usos de los mismos, del 31 de Julio de 2019, de Tel Hashomer Medical Research, Infrastructure And Services Ltd: Un compuesto representado mediante la Fórmula Ib:**Fórmula**
en donde G es hidrógeno, alquilo, arilo, haloarilo o alcoxilo.
Inhibidores de la ARN polimerasa I y usos de los mismos, del 31 de Julio de 2019, de Tel Hashomer Medical Research, Infrastructure And Services Ltd: Un compuesto representado mediante la Fórmula Ib:**Fórmula**
en donde G es hidrógeno, alquilo, arilo, haloarilo o alcoxilo.
Derivados de tetrahidroimidazopiridina como moduladores de la actividad TNF, del 10 de Julio de 2019, de UCB Biopharma SRL: Un compuesto de Fórmula (IIA) o un N-óxido del mismo, o una sal o un solvato farmacéuticamente aceptable del mismo:**Fórmula** en donde E representa -CH2-; Q representa […]