POLIMORFOS DE ESTER TERC-BUTILO DE LA ATORVASTATINA Y SU UTILIZACION COMO INTERMEDIARIOS PARA LA PREPARACION DE LA ATORVASTATINA.
Forma cristalina 1 del éster terc-butilo de atorvastatina de fórmula (II)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/003733.
Solicitante: KRKA, TOVARNA ZDRAVIL, D.D., NOVO MESTO.
Nacionalidad solicitante: Eslovenia.
Dirección: SMARJESKA CESTA 6,8501 NOVO MESTO.
Inventor/es: ZUPET,ROK, SMRKOLJ,MATEJ, STIMAC,ANTON, GRCMAN,MARIJA, JAKSE,RENATA.
Fecha de Publicación: .
Fecha Concesión Europea: 3 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07D207/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 207/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros no condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Clasificación PCT:
- C07D207/34 C07D 207/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Fragmento de la descripción:
Polimorfos del éster terc-butilo de la atorvastatina y su utilización como intermediarios para la preparación de la atorvastatina.
Campo de la invención
La presente invención se refiere a nuevas formas cristalinas 1 y 2 del éster butilo terciario del ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metil-etil)-3-fenil-4-[(fenilamino)carbonil]-1H -pirrol-1-heptanoico de fórmula (II)
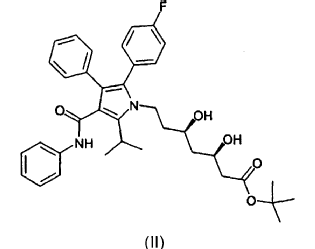
al que en adelante se denominará como éster tercbutilo de la atorvastatina (II).
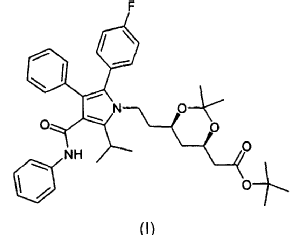
La presente invención se refiere asimismo a un procedimiento para la preparación de estas formas cristalinas que utiliza como material inicial el éster butilo terciario del ácido (4R-(cis)-6-{2-[2-(4-fluorofenil)-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]pirrol-1-il]etil}-2,2-dimetil-1,3-dioxano-4-acético de fórmula (I)
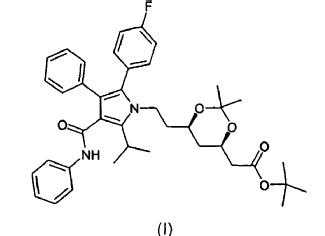
al que en adelante se denominará como cetal dimetilo del éster tercbutilo de la atorvastatina (I).
Más particularmente, la invención se refiere a la utilización de estos nuevos polimorfos como intermediarios para la preparación de sales farmacéuticamente aceptables de la atorvastatina.
Antecedentes de la invención
El éster terc-butilo de la atorvastatina (II) constituye un valioso y conocido precursor para la preparación del inhibidor atorvastatina de la HMG-CoA reductasa (ácido [R-(R*,R*)]-2-(4-fluorofenil)-ß,d-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonil]-1H-pirrol-1-heptanoico) y sus sales y ésteres farmacéuticamente aceptables, todos los cuales constituyen elementos del tipo de medicamentos denominados estatinas.
Las estatinas suprimen la biosíntesis del colesterol inhibiendo competitivamente la 3-hidroxi-3-metil-glutaril-coenzima A reductasa que cataliza la conversión del HMG-CoA a mevalonato, el cual es el paso determinante en la biosíntesis del colesterol. Constituyen habitualmente los medicamentos más terapéuticamente efectivos que están disponibles para el tratamiento de la hiperlipidemia y de la hipercolesterolemia, los cuales constituyen factores de riesgo para la enfermedad arterioesclerótica y las patologías coronarias. Los procedimientos para la preparación de la atorvastatina y los intermediarios clave se dan a conocer, por ejemplo, en las patentes US nº: 5.003.080; nº 5.097.045; nº 5.103.024; nº 5.124.482; nº 5.149.837; nº 5.155.251: nº 5.216.174; nº 5.245.047; nº 5.248.793; nº 5.280.126; nº 5.342.952; nº 5.397.792; nº 4.681.893; nº 5.273.995, y nº 5.298.627.
Además, K.L. Baumann et al, describen en Tetrahedron Lett 1992, 33, 2283-2284, la preparación del cetal dimetilo del éster terc-butilo de la atorvastatina (I) mediante una síntesis pirrólica Paal-Knoor utilizando una mezcla disolvente ternaria de tolueno-heptano-tetrahidrofurano (1:4:1) con catálisis mediante el ácido piválico y la conversión de (I) a la atorvastatina-hemicálcica sin aislar a ningún intermediario. Se informó de un procedimiento similar por Peter W.K. Woo et al en J. Label Compd. Radiopharm., 1999, vol. 42, parte II, 135-145 y por B.-C Chen et al., en J. Label. Compd. Radiopharm., 2000 vol. 43, parte III, 261-270.
Asimismo, el documento WO 02/059087 describe la conversión directa del cetal dimetil del éster terc-butilo de la atorvastatina (I) en atorvastatina no cristalina hemicálcica o en atorvastatina lactona sin aislar los productos intermediarios que aparecen.
H. T. Lee et al describen en J. Label Compd. Radiopharm., 1999, vol. 42, parte II, 129-133, la preparación del éster terc-butilo (II) mediante reducción del correspondiente ß-cetoéster.
Los documentos WO 02/083637 y WO/083638 dan a conocer que el tratamiento del cetal dimetil del éster terc-butilo de la atorvastatina (I) en metanol con ácido clorhídrico acuoso dio lugar a una complicada mezcla que contenía 5 intermediarios, tal como se dio a conocer mediante el análisis HPLC. Varió el porcentaje y distribución de los compuestos detectados en la mezcla reactiva, dependiendo de las condiciones de la reacción: Sin embargo, no se aisló ninguno de los intermediarios, incluyendo el éster terc-butilo de la atorvastatina (II), pero la solución reactiva se trató ulteriormente con solución diluida acuosa de hidróxido sódico.
Además, los documentos WO 02/43667 y WO 03/016317 informaron también de las dificultades surgidas durante la preparación de la atorvastatina hemicálcica, en particular durante la etapa de conversión del cetal dimetilo del éster terc-butilo de la atorvastatina (I), utilizando un catalizador ácido, al éster terc-butilo de la atorvastatina (II). Se demostró que el producto contenía otros compuestos, tales como la lactona de atorvastatina y la atorvastatina libre de ácidos, y se aisló, por ejemplo, como un aceite que indica que el éster terc-butilo de la atorvastatina (II) preparado de esta forma no es substancialmente puro. De este modo, estos procedimientos no fueron capaces de proporcionar un éster terc-butilo de la atorvastatina (II) en una forma cristalina bien definida de una gran pureza.
Lo que se explica anteriormente muestra que los procedimientos de la técnica anterior no son capaces de producir éster terc-butilo de la atorvastatina (II) en forma cristalina y por tanto, en una forma de gran pureza.
Además, estos procedimientos de la técnica anterior no conducen a la atorvastatina hemicálcica que posee una capacidad de filtrado y una pureza que son satisfactorias para la preparación de formulaciones farmacéuticas cuando se encuentran impurezas, que son difíciles de eliminar.
En consecuencia, es necesario todavía una mejora en el procedimiento para preparar la atorvastatina, particularmente en forma de su sal hemicálcica con una buena filtrabilidad y una alta pureza, que la hacen muy apropiada para la preparación de formulaciones farmacéuticas.
Además, son necesarios precursores que permitan la fácil preparación de las formas polimórficas de la atorvastatina y de sus sales farmacéuticamente aceptables o de la conversión a otras formas de atorvastatina y de sus sales farmacéuticamente aceptables.
Estos problemas son resueltos por la presente invención.
Descripción detallada de la invención
En primer lugar, la invención se refiere a dos formas polimórficas bien definidas del éster terc-butil de la atorvastatina (II) que se denominan formas cristalinas 1 y 2 que son intermediarios excelentes para la preparación de la atorvastatina y de sus derivados, en particular para la preparación de la atorvastatina hemicálcica amorfa. Estas dos formas polimórficas se caracterizaron mediante análisis con rayos X y calorimetría de escaneo diferencial.
Los patrones de difracción de los rayos X se obtuvieron mediante un difractómetro Phillips PW 3040/60 X'Pert PRO, utilizando una radiación CuKa de 1,541874 Å.
Las curvas DSC se registraron en un calorímetro de escaneo Perkin Elmer DSC 7. Se escanearon muestras de aproximadamente 3 mg a una tasa de calentamiento de 10ºC/min bajo atmósfera de nitrógeno en una charola DSC abierta de aluminio.
La forma cristalina 1 del éster terc-butilo de la atorvastatina (II) según la invención se caracteriza por un patrón de difracción de rayos X que muestra picos en: 6,10, 6,83, 10,77, 17,01
Se caracteriza preferentemente por un patrón de difracción de rayos X que muestra picos en: 6,10, 6,83, 10,77, 12,18, 16,20, 17,01, 17,65, 19,07, 19,80, 21,25, 21,64, 23,70, 27,60
Un patrón de difracción de rayos X típico de la forma cristalina 1 se proporciona en la Tabla 1 siguiente, listando los grados 2-theta junto con las intensidades correspondientes.
En la tabla, "s" designa una fuerte intensidad relativa del 30 al 100% y "m" designa una intensidad media relativa del 10 al 30%.

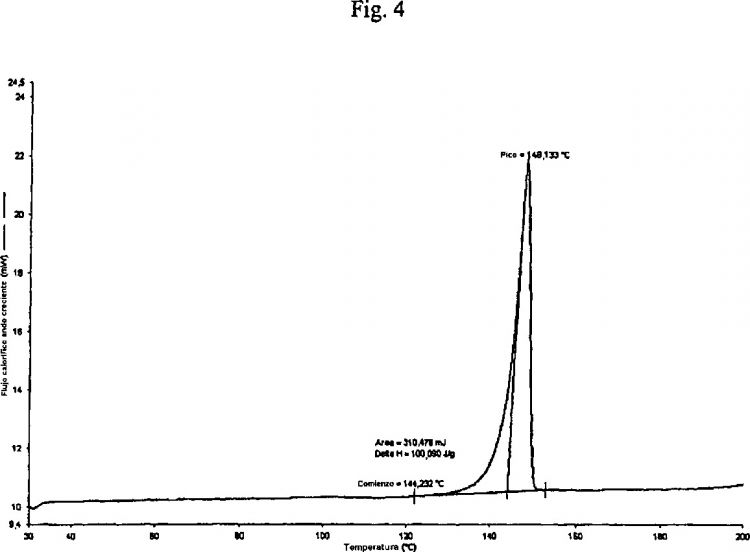
Además, la forma cristalina 1 del éster terc-butilo de la atorvastatina (II) según la invención, está caracterizada porque presenta la curva DSC que se muestra en la figura 3 con la temperatura inicial a aproximadamente...
Reivindicaciones:
1. Forma cristalina 1 del éster terc-butilo de atorvastatina de fórmula (II)

caracterizada porque presenta un patrón de difracción de rayos X que muestra picos en: 6,10, 6,83, 10,77, 17,01
2. Forma cristalina 1 según la reivindicación 1, caracterizada porque presenta un patrón de difracción de rayos X que muestra picos en: 6,10, 6,83, 10,77, 12,18, 16,20, 17,01, 17,65, 19,07, 19,80, 21,25, 21,64, 23,70, 27,60
3. Forma cristalina 1 del éster terc-butilo de atorvastatina de fórmula (II), caracterizada porque presenta la curva DSC que se muestra en la figura 3, con una temperatura de inicio de aproximadamente 97ºC.
4. Procedimiento para la preparación de la forma cristalina 1 según cualquiera de las reivindicaciones 1 a 3, que comprende
disolver cualquier forma de cetal dimetilo del éster terc-butilo de atorvastatina de fórmula (I)
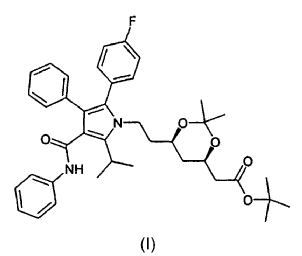
en un disolvente miscible en agua, y añadiendo una solución acuosa ácida, preferentemente de HCl, a entre 10 y 50ºC, preferentemente a entre 10 y 40ºC, más preferentemente a temperatura ambiente.
5. Procedimiento según la reivindicación 4, que comprende además continuar la reacción del cetal dimetilo del éster terc-butilo de atorvastatina (I) con el ácido durante entre 3 y 24 horas, a la misma temperatura, para finalizar la reacción.
6. Procedimiento según la reivindicación 5, que comprende además añadir agua a la mezcla reactiva, después de que la reacción finalice, para precipitar el éster terc-butilo de atorvastatina (II).
7. Procedimiento según la reivindicación 6, en el que el agua se añade a la mezcla reactiva en un volumen superior al volumen del disolvente miscible acuoso.
8. Procedimiento según las reivindicaciones 6 ó 7, en el que el agua se añade a la mezcla reactiva en un volumen superior al volumen de la mezcla reactiva.
9. Procedimiento según cualquiera de las reivindicaciones 4 a 8, en el que el disolvente miscible en agua y la solución acuosa ácida se utilizan en una proporción comprendida entre 10 y 1, preferentemente entre 6 y 1, y más preferentemente entre 4 y 1 partes por volumen.
10. Procedimiento según cualquiera de las reivindicaciones 4 a 9, en el que el disolvente miscible en agua es acetonitrilo.
11. Forma cristalina 2 del éster terc-butilo de atorvastatina de fórmula (II)
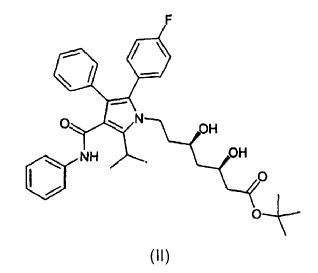
caracterizada porque presenta un patrón de difracción de rayos X que muestra picos en: 6,48, 12,15, 17,21, 18,34, 20,18, 20,47, 24,45
12. Forma cristalina 2 según la reivindicación 11, caracterizada porque presenta un patrón de difracción de rayos X que muestra picos en: 6,48, 7,59, 10,97, 12,15, 15,02, 17,21, 18,34, 20,18, 20,47, 21,59, 24,45, 26,07, 29,41
13. Forma cristalina 2 del éster terc-butilo de atorvastatina de fórmula (II)
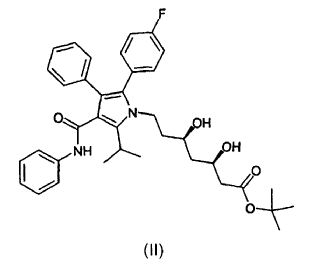
caracterizada porque presenta la curva DSC que se muestra en la figura 4, con una temperatura inicial de aproximadamente 144ºC.
14. Procedimiento para la preparación de la forma cristalina 2 del éster terc-butilo de atorvastatina según cualquiera de las reivindicaciones 11 a 13, que comprende
disolver cualquier forma de cetal dimetilo del éster terc-butilo de atorvastatina de fórmula (I)
en un disolvente miscible en agua, y añadir una solución acuosa de ácido, preferentemente de HCl, y calentar la mezcla a entre 50 y 100ºC, preferentemente a la temperatura de ebullición de la mezcla.
15. Procedimiento según la reivindicación 14, que comprende además continuar la reacción del cetal dimetilo del éster terc-butilo de atorvastatina (I) con el ácido durante entre 3 y 24 horas, a la misma temperatura, para finalizar la reacción.
16. Procedimiento según la reivindicación 15, que comprende además añadir agua a la mezcla reactiva, después de la finalización de la reacción, para precipitar el éster terc-butilo de atorvastatina (II).
17. Procedimiento según la reivindicación 16, en el que el agua se añade a la mezcla reactiva en un volumen superior al volumen del disolvente miscible en agua.
18. Procedimiento según las reivindicaciones 16 ó 17, en el que el agua se añade a la mezcla reactiva en un volumen superior al volumen de la mezcla reactiva.
19. Procedimiento según cualquiera de las reivindicaciones 14 a 18, en el que el disolvente miscible en agua es acetonitrilo.
20. Procedimiento según cualquiera de las reivindicaciones 14 a 19, en el que el disolvente miscible en agua y la solución acuosa de ácido se utilizan en una proporción de 10 a 1, preferentemente de 6 a 1, y más preferentemente de 4 a 1 partes por volumen.
21. Utilización de la forma cristalina 1 según cualquiera de las reivindicaciones 1 a 3, para la preparación de cualquier forma de atorvastatina, por ejemplo, la atorvastatina ácido libre, la atorvastatina lactona, o para la preparación de una sal de atorvastatina en forma cristalina o amorfa, o de su mezcla.
22. Utilización de la forma cristalina 2 según cualquiera de las reivindicaciones 11 a 13, para la preparación de cualquier forma de atorvastatina, por ejemplo, la atorvastatina ácido libre, la atorvastatina lactona, o para la preparación de una sal de atorvastatina en forma cristalina o amorfa, o de su mezcla.
23. Utilización según las reivindicaciones 21 ó 22, para la preparación de la atorvastatina hemicálcica.
24. Procedimiento para la preparación de cualquier forma de atorvastatina, preferentemente de atorvastatina hemicálcica, utilizando la forma cristalina 1 según cualquiera de las reivindicaciones 1 a 3 o la forma cristalina 2 según cualquiera de las reivindicaciones 11 a 13.
25. Procedimiento según la reivindicación 24, que comprende:
hacer reaccionar la forma cristalina 1 o la forma cristalina 2 con una base en una mezcla de éter metilo terc-butilo, metanol y agua, siendo el volumen de agua superior al volumen de éter metilo terc-butilo,
añadir una sal cálcica para llevar a cabo la formación de la atorvastatina hemicálcica, y
añadir agua a la mezcla reactiva para llevar a cabo la precipitación de la atorvastatina hemicálcica.
Patentes similares o relacionadas:
Proceso para la preparación de antagonistas de receptor androgénico e intermedios de los mismos, del 26 de Febrero de 2020, de ORION CORPORATION: Un proceso para la preparación de 2-cloro-4-(1H-pirazol-3-il)benzonitrilo de fórmula (V) **(Ver fórmula)** que comprende las etapas de […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 4 de Diciembre de 2019, de Janssen Sciences Ireland Unlimited Company: Un compuesto seleccionado entre los siguientes compuestos 1-102: Compuesto 1: (R)-4-(2-(sec-butilamino)-2-oxoacetil)-N-(4-fluoro-3-metilfenil)-1-metil-1H-pirrol-2-carboxamida; […]
Fenilpirrolcarboxamidas sustituidas con actividad terapéutica en VIH, del 6 de Noviembre de 2019, de NEW YORK BLOOD CENTER, INC.: Un compuesto representado por una fórmula A: **(Ver fórmula)** en donde Ph es fenilo opcionalmente sustituido; **(Ver fórmula)** […]
Compuestos de heteroarilo con una unidad acíclica como puente, del 31 de Julio de 2019, de INTERVET INTERNATIONAL B.V: Un compuesto de fórmula (I) y solvatos, N-óxidos y sales farmacéuticamente aceptables del mismo,**Fórmula** en la que R1 es halógeno, alquilo, […]
Formas de sal de de atorvastatina con benetamina, del 3 de Julio de 2019, de PFIZER PRODUCTS INC.: Una Forma A de atorvastatina con benetamina que tiene un patrón de difracción de rayos x en polvo que contiene los siguientes máximos 2θ medidos usando […]
Cristal de (S)-1-(2-Hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3-carboxamida, del 20 de Febrero de 2019, de DAIICHI SANKYO COMPANY, LIMITED: Un cristal de (S)-1-(2-hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3- carboxamida representado por el […]
Derivados de pirrol bicíclicos útiles como agonistas de GPR120, del 9 de Enero de 2019, de JANSSEN PHARMACEUTICA NV: Un compuesto de fórmula (I)**Fórmula** en el que R1 se selecciona del grupo que consiste de 3-fluorofenilo, 4-fluorofenilo, 2,4-difluorofenilo, […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 21 de Febrero de 2018, de Janssen Sciences Ireland UC: Un compuesto de Fórmula (IA)**Fórmula** o un estereoisómero o una forma tautomérica de este, donde: cada X representa independientemente CR7; R1, R2 […]