PÉPTIDOS ÚTILES EN EL TRATAMIENTO Y/O CUIDADO DE LA PIEL, MUCOSAS Y/O CABELLO Y SU USO EN COMPOSICIONES COSMÉTICAS O FARMACÉUTICAS.
Péptidos de fórmula general (I):
**FIGURA-01**
sus estereoisómeros,
mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, un procedimiento de preparación, composiciones cosméticas o farmacéuticas que los contienen y su uso para el tratamiento y/o cuidado de la piel, mucosas y/o cabello y el tratamiento y/o cuidado de aquellas condiciones, desórdenes y/o patologías que mejoren o sean prevenidas por una estimulación de las Hsp.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200930896.
Solicitante: LIPOTEC, S.A..
Nacionalidad solicitante: España.
Inventor/es: FERRER MONTIEL, ANTONIO, CEBRIAN PUCHE,JUAN, VAN DEN NEST,WIN, CARREÑO SERRAIMA,CRISTINA, SEMPERE BONETE,ANA, ALMIÑANA DOMENECH,NURIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/07 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Tetrapéptidos.
- A61K38/08 A61K 38/00 […] › Péptidos que tienen de 5 a 11 aminoácidos.
- A61K8/64 A61K […] › A61K 8/00 Cosméticos o preparaciones similares para el aseo. › Proteínas; Péptidos; Sus derivados o sus productos de degradación.
- A61P17/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de problemas dermatológicos.
- A61Q19/00 A61 […] › A61Q USO ESPECIFICO DE COSMETICOS O DE PREPARACIONES SIMILARES PARA EL ASEO. › Preparaciones para el cuidado de la piel.
- C07K5/103 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 5/00 Péptidos con hasta cuatro aminoácidos en una secuencia totalmente determinada; Sus derivados. › la cadena lateral del primer aminoácido es acíclica, p. ej. Gly, Ala.
- C07K5/117 C07K 5/00 […] › el primer aminoácido es heterocíclico, p. ej. Pro, His, Trp.
- C07K7/06 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
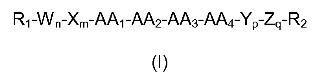
Fragmento de la descripción:
Péptidos útiles en el tratamiento y/o cuidado de la piel, mucosas y/o cabello y su uso en composiciones cosméticas o farmacéuticas.
Campo de la invención La presente invención se refiere a péptidos capaces de inducir la expresión de proteínas de choque térmico en la piel, mucosas y/o cabello y a composiciones cosméticas o farmacéuticas que contienen dichos péptidos de utilidad en el tratamiento y/o cuidado de la piel, mucosas y/o cabello, preferentemente para el tratamiento y/o cuidado de aquellas condiciones, desórdenes y/o patologías de la piel, mucosas y/o cabello que mejoren o sean prevenidas por una estimulación de la síntesis de las proteínas de choque térmico.
Antecedentes de la invención La piel, las mucosas y el cabello están constantemente expuestos a factores estresantes, tanto de naturaleza química como física. La radiación solar, la exposición a determinados agentes químicos o un exceso de temperatura pueden tener efectos nocivos sobre las células que constituyen la piel, acelerando el envejecimiento de ésta y confiriéndole una apariencia poco saludable. Los mecanismos por los que la radiación ultravioleta (UV) ejerce estos efectos comprende la formación de especies reactivas de oxígeno, los daños al ADN, y la desnaturalización de proteínas, entre otros.
La desnaturalización o cambio en la conformación de las proteínas puede implicar la exposición al exterior de residuos hidrofóbicos, situación en que las proteínas son susceptibles de formar agregados, perdiendo su funcionalidad. Esto supone un peligro para la integridad de la célula, y por ello ésta dispone de mecanismos especializados para combatir dichas situaciones: todos los organismos vivos cuentan con mecanismos para prevenir los daños causados por la acumulación de proteínas plegadas incorrectamente [Ananthan J., Goldberg A. L. y Voellmy R. (1986) "Abnormal proteins serve as eukar y otic stress signáis and trigger the activation ofheat shock genes" Science 232:522524].
Se ha visto que las células responden frente a una situación de estrés aumentando la síntesis de las denominadas proteínas de estrés. Dicha respuesta se inicia cuando la célula detecta una acumulación de proteínas anormalmente plegadas, dando lugar a un aumento en la transcripción de los genes de estrés térmico [Lis J. y Wu C. (1993) "Protein traffic on the heat shock promoter: parking, stalling, and trucking along" Cell 74:1-4]. Los productos de estos genes se clasifican en dos grandes grupos, las proteínas de choque térmico (Hsp o Heat shock protein) y las proteínas reguladas por glucosa (grp o glucose regulated protein) . La denominación "proteína de choque térmico" tiene su origen en la observación de un incremento de la síntesis de estas proteínas en células incubadas a temperatura anormalmente alta. Estas proteínas también ven incrementada su síntesis no sólo cuando las células se ven sometidas a un incremento de temperatura, sino también en otras situaciones de estrés tales como exposición a la radiación UV, estrés oxidativo, estrés osmótico, inflamación, hipoxia, exposición a contaminantes como los metales pesados, falta de alimentación y falta de hidratación [Lindquist S. (1986) "The heat-shock response" Annu. Rev. Biochem. 55:1151-1191].
Las Hsp es una familia de proteínas clasificadas según su peso molecular, las más estudiadas de las cuales son las de 60 kDa y 70 kDa, por su expresión constitutiva en todas las células y su participación directa en varios aspectos de la maduración proteica. Hsp70 comprende principalmente dos proteínas: Hsp73, la forma expresada constitutivamente, y Hsp72, la forma inducible, que está regulada transcripcionalmente por el factor de transcripción de choque térmico-1 (HSF1) . Estas proteínas se denominan también chaperonas moleculares, debido a su función dirigiendo el plegamiento de las proteínas recién sintetizadas desde una conformación tipo glóbulo fundido a una estructura compacta final, evitando la aparición de conformaciones susceptibles de formar agregados y, por tanto, asegurándose de su correcta funcionalidad. En condiciones normales, Hsp70 se localiza en núcleo y citoplasma e interacciona transitoriamente con las proteínas nacientes, facilita su plegado y promueve la traslocación de éstas a través del complejo de Golgi y retículo endoplasmático, en acción conjunta con Hsp60. En condiciones de estrés, en cambio, Hsp70 forma un complejo con las proteínas desplegadas o erróneamente plegadas, para rescatarlas de la degradación y de daños irreversibles, o lo contrario, para aumentar las posibilidades de un ataque proteolítico en caso de ser imposible su protección [Hayes S.
A. y Dice J. F. (1996) "Roles of molecular chaperones in protein degradation" J. Cell. Biol. 132:255-258; Gething M.
J. y Sambrook J. (1992) "Protein folding in the cell" Nature 355:33-45]. Ni Hsp70 ni Hsp60 acaban formando parte de la proteína final correctamente plegada, y tampoco poseen ninguna información específica del plegado; sólo impiden que se establezcan interacciones inapropiadas que puedan provocar un mal plegado o dar lugar a agregaciones y, por tanto, pérdida de funcionalidad. El mecanismo por el que la proteína acaba adoptando su conformación definitiva es, sin embargo, desconocido.
Además de las funciones de chaperona reestableciendo la conformación de proteínas mal plegadas, se ha descrito la participación de Hsp70 en procesos de protección como de reparación del ADN en caso de daños a éste generados por radiación UV o radiación ionizante [Bases R. (2006) "Heat shock protein 70 enhanced deoxyribonucleic acid base excisión repair in human leukemic cells after ionizing radiation" Cell Stress Chaperones 11:240-249; Niu P., Liu L., Gong Z., Tan H., Wang F., Yuan J., Feng Y., Wei Q., Tanguay R. M. y Wu T. (2006) "Overexpressed heat shock protein 70 protects cells against DNA damage caused by ultraviolet C in a dose-dependent manner" Cell Stress & Chaperones 11:162-169].
La respuesta al estrés constituye un mecanismo de defensa celular universalmente conservado, y ello queda reflejado en la llamada termotolerancia adquirida, fenómeno según el cual las células que sufren un choque térmico no letal son capaces, después de un período de recuperación a temperatura de crecimiento normal, de sobrevivir a un segundo choque térmico que hubiese sido letal en primer lugar [Subjeck J. R., Sciandra J. J. y Johnson R. J. (1982) "Heat shock proteins and thermotolerance; a comparison of induction kinetics" Br. J. Radiol. 55:579-584; Angelidis C. E., Lazaridis I. y Pagoulatos G. N. (1991) "Constitutive expression of heat-shock protein 70 in mammalian cells confers thermoresistance" Eur. J. Biochem.199:35-39; Li G. C., Li L. G., Liu Y. K., Mak J. Y., Chen L. L. y Lee W. M. (1991) "Thermal response of rat fibroblasts stably transfected with the human 70-kDa heat shock protein-encoding gene" Proc. Natl. Acad. Sci. USA 88:1681-1685]. Esta termotolerancia adquirida se ha visto que es transitoria, suele durar entre 12 y 24 horas en células en cultivo, y depende de los cambios inducidos por el choque de temperatura inicial, tales como los niveles de incremento de la expresión y acumulación de las proteínas de estrés. Dentro de la familia de las Hsp se ha comprobado que es Hsp70 la responsable de la inducción de la termotolerancia: inhibición específica tanto de la transcripción como de la síntesis de Hsp72 previene la aparición de los efectos protectores inducidos por el tratamiento térmico [Trautinger F., Kinda˚s-Mügge I., Barlan B., Neuner P. y Knobler R. M. (1995) "72-kD heat shock protein is a mediator of resistance to ultraviolet B light" J. Invest. Dermatol. 105:160-162; Simon M. M., Reikerstorfer A., Schwarz A., Krone C., Luger T.A., Jäättelä M. y Schwarz T. (1995) "Heat shock protein 70 overexpression affects the response to ultraviolet light in murine fibroblasts. Evidence for increased cell viability and suppression of cytokine release" J. Clin. Invest. 95:926-33].
Posteriormente se comprobó que cualquier agente o tratamiento capaz de inducir una respuesta al estrés confiere a la célula protección ante una subsiguiente exposición a un agente causante de estrés, independientemente del origen del estrés [Kampinga H. H., Brunsting J. F., Stege G. J. J., Burgman P. W. J. J. y Konings A. W. T (1995) "Thermal protein denaturation and protein aggregation in cells made thermotolerant by various chemicals: role of heat shock proteins" Exp. Cell Res. 219:536-546]. La inducción exógena de la expresión de proteínas de estrés es, por tanto, una estrategia plausible para prevenir daños en proteínas...
Reivindicaciones:
1. Un péptido de fórmula general (I)
sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, caracterizado porque:
AA1 es -His-;
AA2 se selecciona del grupo formado por -His-, -Leu-y -Pro-
AA3 es -Leu-;
AA4 se selecciona del grupo formado por -Arg-y -Asn-;
W, X, Y y Z se seleccionan independientemente entre sí del grupo formado por los aminoácidos codificados y los aminoácidos no codificados;
n, m, pyqse seleccionan independientemente entre sí y tienen un valor entre0y1;
n+m+p+q es menor o igual a 2;
R1 se selecciona del grupo formado por H, grupo alifático no cíclico sustituido o no sustituido, aliciclilo sustituido o no sustituido, heterociclilo sustituido o no sustituido, heteroarilalquilo sustituido o no sustituido, arilo sustituido o no sustituido, aralquilo sustituido o no sustituido y R5-CO-donde R5 se selecciona del grupo formado por H, grupo alifático no cíclico sustituido o no sustituido, aliciclilo sustituido o no sustituido, arilo sustituido o no sustituido, aralquilo sustituido o no sustituido, heterociclilo sustituido o no sustituido y heteroarilalquilo sustituido o no sustituido;
R2 se selecciona del grupo formado por -NR3R4, -OR3 y -SR3, donde R3 yR4 se seleccionan independientemente del grupo formado por H, grupo alifático no cíclico sustituido o no sustituido, aliciclilo sustituido o no sustituido, heterociclilo sustituido o no sustituido, heteroarilalquilo sustituido o no sustituido, arilo sustituido o no sustituido, y aralquilo sustituido o no sustituido;
con la condición de que cuando AA2 es -Leu-, AA4 es -Asn-eYes -Gln-entonces Z no es -Leu-;
y con la condición de que cuando AA2 es -His-, AA4 es -Arg-eYoZson -Tyr-entonces p+q no es 1.
2. Péptido según la reivindicación 1, caracterizado porque R1 se selecciona del grupo formado porHyR5-COdonde R5 se selecciona del grupo formado por alquilo C1-C24 sustituido o no sustituido, alquenilo C2-C24 sustituido o no sustituido, alquinilo C2-C24 sustituido o no sustituido, cicloalquilo C3-C24 sustituido o no sustituido, cicloalquenilo C5-C24 sustituido o no sustituido, cicloalquinilo C8-C24 sustituido o no sustituido, arilo C6-C30 sustituido o no sustituido, aralquilo C7-C24 sustituido o no sustituido, heterociclilo de 3-10 miembros de anillo sustituido o no sustituido y heteroarilalquilo sustituido o no sustituido de 2 a 24 átomos de carbono y de 1 a 3 átomos diferentes al carbono y una cadena alquílica de1a6 átomos de carbono.
3. Péptido según la reivindicación 2, caracterizado porque R1 se selecciona del grupo formado por H, acetilo, terc-butanoilo, hexanoilo, 2-metilhexanoilo, ciclohexancarboxilo, octanoilo, decanoilo, lauroilo, miristoilo, palmitoilo, estearoilo, oleoilo y linoleoilo.
4. Péptido según la reivindicación 1, caracterizado porque R2 es -NR3R4 o -OR3, donde R3 yR4 se seleccionan independientemente del grupo formado por H, alquilo C1-C24 sustituido o no sustituido, alquenilo C2-C24 sustituido o no sustituido, alquinilo C2-C24 sustituido o no sustituido, cicloalquilo C3-C24 sustituido o no sustituido, cicloalquenilo C5-C24 sustituido o no sustituido, cicloalquinilo C8-C24 sustituido o no sustituido, arilo C6-C30 sustituido o no sustituido, aralquilo C7-C24 sustituido o no sustituido, heterociclilo de 3-10 miembros de anillo sustituido o no sustituido, y heteroarilalquilo sustituido o no sustituido de 2 a 24 átomos de carbono y de 1 a 3 átomos diferentes al carbono y una cadena alquílica de1a6 átomos de carbono.
5. Péptido según la reivindicación 4, caracterizado porque R3 yR4 se seleccionan independientemente del grupo formado por H, metilo, etilo, hexilo, dodecilo y hexadecilo.
6. Péptido según la reivindicación 1, caracterizado porque R1 se selecciona del grupo formado por H, acetilo, lauroilo, miristoilo y palmitoilo, AA2 es -L-Leu-, AA4 es -L-Arg-, y R2 es -NR3R4 o -OR3 donde R3 yR4 se seleccionan independientemente de H, metilo, etilo, hexilo, dodecilo y hexadecilo.
7. Péptido según la reivindicación 1, caracterizado porque R1 se selecciona del grupo formado por H, acetilo, lauroilo, miristoilo y palmitoilo, AA2 es -L-Pro-, AA4 es -L-Arg-, y R2 es -NR3R4 o -OR3 donde R3 yR4 se seleccionan independientemente de H, metilo, etilo, hexilo, dodecilo y hexadecilo.
8. Péptido según la reivindicación 1, caracterizado porque n, m, pysson 0.
9. Péptido según cualquiera de las reivindicaciones1a8, para el tratamiento y/o cuidado de la piel, mucosas y/o cabello.
10. Péptido según la reivindicación 9, para el tratamiento y/o cuidado de aquellas condiciones, desórdenes y/o patologías de la piel, mucosas y/o cabello que mejoren o sean prevenidas por la estimulación de la síntesis de al menos una proteína de choque térmico.
11. Péptido según la reivindicación 10 caracterizado porque dicha proteína de choque térmico tiene un peso molecular comprendido entre 20 kDa y 110 kDa.
12. Péptido según la reivindicación 11 caracterizado porque dicha proteína de choque térmico es Hsp70.
13. Péptido según cualquiera de las reivindicaciones 9 a 12 caracterizado porque dicho tratamiento y/o cuidado disminuye, retrasa, y/o previene el daño celular inducido por la radiación UV, estrés térmico, estrés oxidativo, estrés osmótico, inflamación, hipoxia, exposición a contaminantes, falta de alimentación y falta de hidratación.
14. Péptido según cualquiera de las reivindicaciones 9 a 13 en el que dicho tratamiento y/o cuidado disminuye, retrasa y/o previene los signos del envejecimiento y/o fotoenvejecimiento.
15. Péptido según cualquiera de las reivindicaciones 9 a 14 en el que dicho tratamiento y/o cuidado retrasa y/o previene la caída del cabello o induce el crecimiento del cabello.
16. Péptido según cualquiera de las reivindicaciones 9 a 13 en el que dicho tratamiento y/o cuidado estimula la cicatrización y/o reepitelización de las heridas.
17. Péptido según la reivindicación 16, en el que dichas heridas son consecuencia de la diabetes.
18. Péptido según cualquiera de las reivindicaciones 10 a 16 en el que dichos desórdenes y/o patologías se seleccionan del grupo formado por epidermolisis bullosa y alopecia.
19. Péptido según las reivindicación 18 en el que la alopecia está causada por un tratamiento de quimioterapia para el cáncer.
20. Péptido según cualquiera de las reivindicaciones 9 a 19 en el que el tratamiento y/o cuidado se realiza por aplicación tópica, transdérmica, oral o parenteral de dicho péptido.
21. Péptido según la reivindicación 20 en el que la aplicación tópica o transdérmica se realiza por iontoforesis, sonoforesis, electroporación, presión mecánica, gradiente de presión osmótica, cura oclusiva, microinyecciones, por inyecciones sin agujas mediante presión, con parches microeléctricos o cualquier combinación de ellas.
22. Procedimiento de preparación de un péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables según cualquiera de las reivindicaciones 1 a 8, caracterizado porque se realiza en fase sólida o en solución.
23. Procedimiento de preparación de un péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables según cualquiera de las reivindicaciones 1 a 8, caracterizado porque los grupos protectores de los grupos amino libre se seleccionan del grupo formado por Boc, Fmoc, Trt, Troc, Teoc, Alloc, Mtt, Z, ClZ, Dnp, Dde, ivDde y Adpoc, los grupos protectores de los grupos carboxilo libre se seleccionan del grupo formado por ésteres de tBu, Bzl, cHx, All, Dmab, 2-fenilisopropilo, Fm y Trt, la cadena lateral de arginina se protege con un grupo protector seleccionado del grupo formado por Tos, Mtr, Pbf y Pmc, la cadena lateral de histidina se protege con un grupo protector seleccionado del grupo formado por Tos, Dnp, Trt y Mtt, y la cadena lateral de asparagina se protege con el grupo Trt o se emplea sin protección.
24. Composición cosmética o farmacéutica que comprende una cantidad cosmética o farmacéuticamente eficaz de al menos un péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, según cualquiera de las reivindicaciones 1 a 8, y al menos un excipiente o adyuvante cosmética o farmacéuticamente aceptable.
25. Composición según la reivindicación 24, caracterizada porque dicho péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, se encuentra a una concentración comprendida entre el 0, 000001% y el 20% en peso, con respecto al peso total de la composición.
26. Composición según la reivindicación 25, caracterizada porque dicho péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, se encuentra a una concentración comprendida entre el 0, 0001% y el 5% en peso, con respecto al peso total de la composición.
27. Composición según cualquiera de las reivindicaciones 24 a 26, caracterizada porque dicho péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, se encuentra incorporado a un sistema de vehiculización o a un sistema de liberación sostenida cosmética o farmacéuticamente aceptable seleccionado del grupo formado por liposomas, liposomas mixtos, oleosomas, niosomas, etosomas, milicápsulas, microcápsulas, nanocápsulas, esponjas, ciclodextrinas, vesículas, micelas, micelas mixtas de tensioactivos, micelas mixtas fosfolípido-tensioactivo, miliesferas, microesferas, nanoesferas, lipoesferas, microemulsiones, nanoemulsiones, minipartículas, milipartículas, micropartículas, nanopartículas, nanopartículas sólidas lipídicas y soportes lipídicos nanoestructurados.
28. Composición según la reivindicación 27, caracterizada porque dichas microemulsiones son microemulsiones de agua en aceite con estructura interna de micela inversa.
29. Composición según cualquiera de las reivindicaciones 24 a 28, caracterizada porque dicho péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, se encuentra adsorbido sobre un polímero orgánico sólido o soporte mineral sólido seleccionado del grupo formado por talco, bentonita, sílice, almidón y maltodextrina.
30. Composición según cualquiera de las reivindicaciones 24 a 29, caracterizada porque dicha composición se presenta en una formulación seleccionada del grupo formado por cremas, emulsiones múltiples, composiciones anhidras, dispersiones acuosas, aceites, leches, bálsamos, espumas, lociones, geles, geles crema, soluciones hidroalcohólicas, soluciones hidroglicólicas, hidrogeles, linimentos, sueros, jabones, champús, acondicionadores, serums, ungüentos, mousses, pomadas, polvos, barras, lápices, vaporizadores, aerosoles, cápsulas, cápsulas de gelatina, cápsulas blandas, cápsulas duras, comprimidos, comprimidos recubiertos de azúcar, formas granuladas, gomas de mascar, soluciones, suspensiones, emulsiones, jarabes, films de polisacáridos, jaleas y gelatina.
31. Composición según cualquiera de las reivindicaciones 24 a 30, caracterizada porque dicha composición se encuentra incorporada a un producto seleccionado del grupo formado por correctores de ojeras, fondos de maquillaje, lociones desmaquillantes, leches desmaquillantes, sombras de ojos, barras de labios, brillos labiales, protectores labiales y polvos.
32. Composición según cualquiera de las reivindicaciones 24 a 30, caracterizada porque dicho péptido de fórmula general (I) , sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente aceptables, se encuentra incorporado en un tejido, un tejido-no-tejido o un producto sanitario.
33. Composición según la reivindicación 32, caracterizada porque dicho tejido, tejido-no-tejido o producto sanitario se selecciona del grupo formado por vendas, gasas, camisetas, medias, calcetines, ropa interior, fajas, guantes, pañales, compresas, apositos, cubrecamas, toallitas, parches adhesivos, parches no adhesivos, parches oclusivos, parches microeléctricos y mascarillas faciales.
34. Composición según cualquiera de las reivindicaciones 24 a 33, caracterizada porque dicha composición comprende adicionalmente una cantidad cosmética o farmacéuticamente eficaz de al menos un adyuvante seleccionado del grupo formado por proteínas de choque térmico, otros agentes estimuladores de la síntesis de las proteínas de choque térmico, inhibidores de la agregación de los receptores de acetilcolina, agentes inhibidores de la contracción muscular, agentes anticolinérgicos, agentes inhibidores de elastasa, agentes inhibidores de las metaloproteasas de matriz, agentes estimuladores o inhibidores de la síntesis de melanina, agentes blanqueantes o despigmentantes, agentes propigmentantes, agentes autobronceantes, agentes antienvejecimiento, agentes inhibidores de la NO-sintasa, agentes inhibidores de la 5α-reductasa, agentes inhibidores de lisil-y/o prolil-hidroxilasa, agentes antioxidantes, agentes capturadores de radicales libres y/o anticontaminación atmosférica, agentes capturadores de especies reactivas carbonilo, agentes antiglicación, agentes antihistamínicos, agentes antivirales, agentes antiparasitarios, agentes emulsionantes, emolientes, disolventes orgánicos, propelentes líquidos, acondicionadores de la piel, humectantes, sustancias que retienen la humedad, alfahidroxiácidos, betahidroxiácidos, hidratantes, enzimas epidérmicas hidrolíticas, vitaminas, aminoácidos, proteínas, pigmentos o colorantes, tintes, polímeros gelificantes, espesantes, tensioactivos, suavizantes, agentes antiarrugas, agentes capaces de disminuir o tratar las bolsas bajo los ojos, agentes exfoliantes, agentes antimicrobianos, agentes antifúngicos, agentes fungistáticos, agentes bactericidas, agentes bacteriostáticos, agentes estimuladores de la síntesis de macromoléculas dérmicas o epidérmicas y/o capaces de inhibir o prevenir su degradación, agentes estimuladores de la síntesis de colágeno, agentes estimuladores de la síntesis de elastina, agentes estimuladores de la síntesis de decorina, agentes estimuladores de la síntesis de laminina, agentes estimuladores de la síntesis de defensinas, agentes estimuladores de la síntesis de aquaporinas, agentes estimuladores de la síntesis de ácido hialurónico, agentes estimuladores de la síntesis de fibronectina, agentes estimuladores de la síntesis de sirtuínas, agentes estimuladores de la síntesis de lípidos y componentes del estrato córneo, ceramidas, ácidos grasos, agentes inhibidores de la
degradación de colágeno, agentes inhibidores de la degradación de elastina, agentes inhibidores de proteasas de serina como catepsina G, agentes estimuladores de la proliferación de fibroblastos, agentes estimuladores de la proliferación de queratinocitos, agentes estimuladores de la proliferación de adipocitos, agentes estimuladores de la proliferación de melanocitos, agentes estimuladores de la diferenciación de queratinocitos, agentes estimuladores de la diferenciación de adipocitos, agentes inhibidores de la acetilcolinesterasa, agentes dermorelajantes, agentes estimuladores de la síntesis de glicosaminoglicanos, agentes antihiperqueratosis, agentes comedolíticos, agentes antipsoriasis, agentes reparadores del ADN, agentes protectores del ADN, estabilizantes, agentes antiprurito, agentes para el tratamiento y/o cuidado de pieles sensibles, agentes reafirmantes, agentes antiestrías, agentes astringentes, agentes reguladores de la producción de sebo, agentes lipolíticos o estimuladores de la lipólisis, agentes anticelulíticos, agentes antiperspirantes, agentes estimuladores de la cicatrización, agentes coadyuvantes de la cicatrización, agentes estimuladores de la reepitelización, agentes coadyuvantes de la reepitelización, factores de crecimiento de citoquinas, agentes calmantes, agentes antiinflamatorios y/o analgésicos, agentes anestésicos, agentes que actúen sobre la circulación capilar y/o la microcirculación, agentes estimuladores de la angiogénesis, agentes inhibidores de la permeabilidad vascular, agentes venotónicos, agentes que actúen sobre el metabolismo de las células, agentes destinados a mejorar la unión dermis-epidermis, agentes inductores del crecimiento del cabello, agentes inhibidores o retardantes del crecimiento del cabello, agentes retardantes de la caida del cabello, conservantes, perfumes, agentes quelantes, extractos vegetales, aceites esenciales, extractos marinos, agentes provenientes de un procedimiento de biofermentación, sales minerales, extractos celulares, filtros solares y agentes fotoprotectores de naturaleza orgánica o mineral activos contra los rayos ultravioleta A y/o B, o mezclas de ellos.
35. Composición según la reivindicación 34, caracterizada porque dicho adyuvante es de origen sintético o es un extracto vegetal o proviene de un procedimiento de biotecnológico o proviene de una combinación de un procedimiento sintético y un procedimiento biotecnológico.
36. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por agentes estimuladores de la síntesis de las proteínas de choque térmico.
37. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por agentes antiarrugas y/o agentes antienvejecimiento.
38. Composición según la reivindicación 37, caracterizada porque dichos agentes antiarrugas y/o agentes antienvejecimiento se seleccionan del grupo formado por Acetil Hexapéptido-8, Acetil Heptapéptido-4, Acetil Octapéptido3, Pentapéptido-18, Acetil Hexapéptido-25, Diaminopropionoil Tripéptido-33, Tripéptido-10 Citrulina, Acetil Tetrapéptido-5, Acetil Tripéptido-30 Citrulina, Acetil Tetrapéptido-30, Dimetilmetoxi Cromanol, Dimetilmetoxi Cromanil Palmitato, extracto del fermento de Pseudoalteromonas, antagonistas del canal de Ca2+, retinol y sus derivados, idebenona y sus derivados, Coenzima Q10 y sus derivados, ácido boswélico y sus derivados, GHK y sus derivados y/o sales, carnosina y sus derivados, enzimas reparadores del ADN, agonistas de canales de cloruro, la mezcla de Proteína de Trigo Hidrolizada, Proteína de Soja Hidrolizada y Tripéptido-1, la mezcla de Lisina HCI, Lecitina y Tripéptido-10 Citrulina y la mezcla de Extracto de Fermento de Pseudoalteromonas, Proteína de Trigo Hidrolizada, Proteína de Soja Hidrolizada, Tripéptido-10 Citrulina y Tripéptido-1.
39. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por agentes estimuladores de la cicatrización y/o reepitelización y agentes coadyuvantes de la cicatrización y/o reepitelización.
40. Composición según la reivindicación 39 caracterizada porque dicho agente estimulador de la cicatrización y/o reepitelización o agente coadyuvante de la cicatrización y/o reepitelización se selecciona del grupo formado por extracto de fermento de Pseudoalteromonas y Tripéptido-10 Citrulina.
41. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por agentes retardantes de la caída del cabello o inductores del crecimiento del cabello.
42. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por filtros solares.
43. Composición según cualquiera de las reivindicaciones 34 a 35 caracterizada porque dicho adyuvante se selecciona del grupo formado por proteínas de choque térmico.
44. Composición según la reivindicación 43 caracterizada porque dicha proteína de choque térmico es Hsp70.
Patentes similares o relacionadas:
Derivados de benzoxazinona para el tratamiento de enfermedades cutáneas, del 29 de Julio de 2020, de Sixera Pharma AB: Un compuesto según la Fórmula I **(Ver fórmula)** en donde R es -S-CH3 o -Cl, o una sal farmacéuticamente aceptable del mismo.
Pomada, del 29 de Julio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Pomada que comprende un compuesto de oxazol representado por la siguiente fórmula : **(Ver fórmula)** y un componente de base, en la […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Uso de un compuesto que comprende al menos una función nucleófila para la captura de compuestos de carbonilo que resultan de la reacción entre uno o más compuestos que constituyen el sebo y el ozono, del 22 de Julio de 2020, de L'OREAL: Compuestos A que tienen una o más funciones nucleófilas FA capaces de reaccionar con uno o más compuestos carbonílicos B que resultan de la reacción entre uno o más compuestos […]
Analógicos biaromáticos de vitamina D, del 15 de Julio de 2020, de DSM IP ASSETS B.V.: Compuesto según la fórmula (I) **(Ver fórmula)** en la que · X e Y son ambos -CH2-, o uno de X e Y es -CH2- y el otro es -O-; y · R1 es un grupo metilo […]
Composición tópica que comprende extractos de boldo y de reina de los prados, destinada a un animal, y sus aplicaciones, del 6 de Julio de 2020, de Virbac SA: Composición tópica para animales, caracterizada por que comprende en un medio fisiológicamente aceptable extractos de boldo Peumus boldus y extractos de reina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Composición a base de fenol y sus usos, del 26 de Junio de 2020, de Deprez, Philippe: La presente invención se refiere a una composición para uso en el tratamiento o prevención de una enfermedad de la piel, donde la composición […]