Péptidos que tienen actividades del factor de crecimiento epidérmico y sus usos.
Un péptido que tiene la actividad de crecimiento celular del factor de crecimiento epidérmico (EGF),
quecomprende la secuencia de aminoácidos representada por la siguiente fórmula 1:
Cys-Met-Tyr-Ile-Glu-Ligador-Arg-Gly-Asp (1)
en la que el ligador está representado por Xaa(n), Xaa es cualquier aminoácido y n es un número entero de 2-18.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2007/004895.
Solicitante: CAREGEN CO., LTD.
Nacionalidad solicitante: República de Corea.
Dirección: 690-3 GEUMJEONG-DONG GUNPO-SI GYEONGGI-DO 435-862 REPUBLICA DE COREA.
Inventor/es: CHUNG,YONG-JI, KIM,YOUNG DEUG, KIM,EUN MI, CHOI,JUN YOUNG, SONG,SANG SU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K14/485 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento epidérmico (EGF) (urogastrona).
PDF original: ES-2435723_T3.pdf
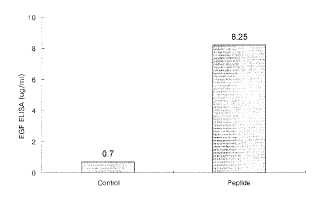
Fragmento de la descripción:
Péptidos que tienen actividades del factor de crecimiento epidérmico y sus usos Antecedentes de la invención Campo de la invención La presente invención se refiere a péptidos que tienen las actividades del factor de crecimiento epidérmico y sus usos.
Descripción de la técnica relacionada El factor de crecimiento epidérmico constituido por 53 residuos de aminoácidos fue aislado por primera vez por el Dr. Stanley Cohen de la glándula submandibular de ratón y se dedujo que aceleraba la apertura de los párpados en ratones prematuros (Cohen, S. (1962) J. Biol. Chem. 237, 1555-1562) . El Dr. Stanly Cohen recibió el premio Nobel de medicina en 1986 por los estudios sobre el EGF. El EGF, un polipéptido que tiene 3 puentes disulfuro (Savage, C.t., Jr. et al., (1973) J. Biol. Chem. 248, 7669-7672; Savage, C.R., Jr. et al., (1972) J. Biol. Chem. 247, 7612-7621) , desencadena una cascada de transducción de la señal a través del receptor del EGF para inducir el crecimiento y la división de células de mamífero, en particular de células de epitelio y de piel, de modo que estimula el crecimiento de las células epiteliales (Sporn, M. B. et al., (1985) Nature (London) 313, 745-747; Sporn M.B. et al., (1980) N. Engl. J. Med. 303, 878-880) . Además, se ha notificado que el EGF desempeña un papel central en la regulación molecular de la cicatrización de heridas ( (Buckley, A. et al., (1985) Proc. Natl. Acad. Sci. USA. 82, 7340-7344) .
El EGF está presente a niveles elevados en varios fluidos corporales tales como saliva, orina, leche, lágrimas y sangre. Tras sufrir una herida, el EGF suministrado en lugares dañados a través de la corriente sanguínea contribuye a la curación de las heridas sin dejar cicatriz. Además, el EGF junto con la FSH (hormona estimulante del folículo) está implicado en la maduración del huevo en el útero y el EGF es responsable de la regeneración de la córnea que es responsable de la degeneración debido a la ausencia de vasos sanguíneos. Además, el EFG desempeña un papel muy importante en la regeneración de la piel a través de las siguientes diversas acciones: estimular la proliferación de las células epiteliales y endoteliales; estimular la proliferación de fibroblastos para sintetizar colágeno en la dermis; estimular la angiogénesis en lugares dañados; inducir la secreción de factores implicados en la regeneración; y estimular la biosíntesis de la fibronectina para formar redes de tejidos cutáneos.
El cuerpo humano responde a la aparición de heridas y suministra EGF a tejidos dañados para la curación. No obstante, cuando el suministro de EFG no es suficiente en el cuerpo se deberá proporcionar EGF exógeno para volver a los estados normales y sanos. A este respecto, se considera que el EGF tiene una gran cantidad de aplicaciones. Por ejemplo, el EGF puede aplicarse a la úlcera del pie diabético, a quemaduras, heridas, lesiones corneales, laparotomía, exfoliación cosmética y envejecimiento cutáneo. Además de las potencias proliferativas de las células epiteliales, se ha sugerido que el hEGF es útil en el tratamiento de la úlcera gástrica evitando la secreción de ácido gástrico (or y , H., (1985) J. Cell Sci. Suppl. 3, 11-17) .
EN 1975, el Dr. Srarkey purificó y caracterizó el hEGF en orina; después se han realizado muchos esfuerzos para preparar el hEGF con un rendimiento y cantidad mucho mayores (Starkey, R. H. et al., (1975) Science 189, 800; Cohen. S. et al., (1975) Proc. Natl. Acad. Sci. USA 72, 1317) . Varios laboratorios han notificado el éxito de la clonación del gen del hEGF (Smith, J. et al., (1982) Nuclei Acids Res. 10, 4467-4482; Urdea, M. S. et al., (1983) Proc. Natl. Acad. Sci. USA 80, 7461-7465; Oka, T, et al., (1985) Proc. Natl. Acad. Sci. USA 82, 7212-7216) . No obstante, el hEGF preparado mediante tecnologías de recombinación genética todavía no se ha producido en grandes cantidades ni con actividades elevadas útiles en los campos de la industria.
La mayoría de los factores de crecimiento polipeptídicos presentes en sangre y tejidos tienen una semivida in vivo muy corta, de varios minutos. Probablemente, el EGF muestra poca estabilidad estructural. Además, dado que el EGF es biológicamente inestable y fisicoquímicamente heterogéneo, es probable que muestre menores eficacias del tratamiento. Su penetración en la piel es muy baja.
De acuerdo con lo anterior, sigue existiendo la necesidad de desarrollar nuevas sustancias que tengan mejor estabilidad y mejor potencia de penetración en la piel, además de poseer actividades inherentes al EGF.
Descripción detallada de la presente invención Para desarrollar péptidos que tienen acciones idénticas al factor de crecimiento epidérmico humano natural así como una estabilidad y penetración en la piel más potenciadas que el EGF natural, los presentes inventores han preparado y seleccionado una multitud de péptidos humanos derivados del EGF. Como resultado, los inventores han desarrollado finalmente péptidos con las excelentes características descritas anteriormente.
De acuerdo con esto, es un objetivo de la presente invención proporcionar un péptido que tenga la actividad del factor de crecimiento epidérmico (EGF) .
Es otro objetivo de la presente invención proporcionar una composición para prevenir o tratar un trastorno o afección
en el que el factor de crecimiento epidérmico es eficaz.
Otros objetivos y ventajas de la presente invención se pondrán de manifiesto a partir de la descripción detallada siguiente, junto con las reivindicaciones y figuras adjuntas.
En un aspecto de la presente invención se proporciona un péptido que tiene la actividad del factor de crecimiento epidérmico (EGF) , que comprende la secuencia de aminoácidos representada por la siguiente fórmula 1:
Cys-Met-Tyr-Ile-Glu-Ligador-Arg-Gly-Asp (1)
en la que el ligador está representado por Xaa (n) , Xaa es cualquier aminoácido y n es un número entero de 2-18.
También se describe una composición para prevenir o tratar un trastorno o afección en el que el factor de crecimiento epidérmico es eficaz, que comprende como principio activo el presente péptido que tiene la actividad del factor de crecimiento epidérmico (EGF) .
Para desarrollar péptidos que tienen acciones idénticas al factor de crecimiento epidérmico humano natural así como una estabilidad y penetración en la piel más potenciadas que el EGF natural, los presentes inventores han preparado y seleccionado una multitud de péptidos humanos derivados del EGF. Como resultado, los inventores han descubierto finalmente péptidos con las excelentes características descritas anteriormente.
Las estrategias de desarrollo de la presente invención son las siguientes: En primer lugar, los presentes péptidos están diseñados para comprender dos regiones, una secuencia derivada del EGF (es decir, la región activa del EGF) y una región de unión celular. La región activa del EGF se selecciona de la secuencia de aminoácidos del EGF natural. Para potenciar las actividades del EGF de los presentes péptidos, la región de unión celular se selecciona de fibronectina, una de las proteínas de la matriz extracelular.
La región activa del EGF seleccionada al final comprende la secuencia de aminoácidos "Cys-Met-Tyr-Ile-Glu" y la región de unión celular seleccionada al final comprende la secuencia de aminoácidos "Arg-Gly-Asp". Además, los presentes inventores han descubierto que se prefiere la unión indirecta de dos regiones mediante ligadores a la unión directa.
De acuerdo con las estrategias de desarrollo, se preparan péptidos que imitan al EGF representados por la fórmula 1.
El ligador para conectar la región activa del EGF y la región de unión celular comprende cualquier ligador disponible para un experto en la técnica. Preferentemente, el ligador comprende una pluralidad de aminoácidos. Los detalles de los ligadores peptídicos se encuentran en Huston, et al., Methods in Enzymology, 203:46-88 (1991) y Whitlow, et al., Protein Eng., 6:989 (1993) . En la presente invención, un ligador adecuado comprende aminoácidos que tienen cadenas laterales sin carga, preferentemente Gly o Gly o Ser. Preferentemente, el ligador tiene una longitud de 2 18 residuos de aminoácidos. Más preferentemente, el ligador comprende 12 -10 residuos de Gly. El ligador compuesto por residuos de aminoácidos, en particular residuos de Gly, contribuye a la estabilidad de los presentes péptidos.
Aunque los péptidos de la presente invención per se tienen una estabilidad más alta que la del EGF natural, su modificación permite tener una estabilidad mucho más alta. Preferentemente, los péptidos de la presente invención tienen un grupo de... [Seguir leyendo]
Reivindicaciones:
1. Un péptido que tiene la actividad de crecimiento celular del factor de crecimiento epidérmico (EGF) , que comprende la secuencia de aminoácidos representada por la siguiente fórmula 1:
Cys-Met-Tyr-Ile-Glu-Ligador-Arg-Gly-Asp (1) 5 en la que el ligador está representado por Xaa (n) , Xaa es cualquier aminoácido y n es un número entero de 2
18.
2. El péptido de acuerdo con la reivindicación 1, en el que el ligador comprende 2-10 residuos de Gly.
3. El péptido de acuerdo con la reivindicación 1, péptido que tiene en su extremo N o su extremo C un grupo de
protección seleccionado del grupo constituido por grupo acetilo, grupo fluorenilmetoxicarbonilo, grupo formilo, 10 grupo palmitoílo, grupo miristilo, grupo estearilo o polietilenglicol (PEG) .
4. El péptido de acuerdo con la reivindicación 1, en el que el residuo de Asp situado en el extremo C del péptido está unido adicionalmente a un residuo de Ala o Gly como grupo de protección.
5. El péptido de acuerdo con la reivindicación 4, péptido que comprende la secuencia de aminoácidos representada por la siguiente fórmula 2:
Cys-Met-Tyr-Ile-Glu-Gly (n) -Arg-Gly-Asp-Gly (2) en la que n es un número entero de 2 a 8.
6. Un uso del péptido de una cualquiera de las reivindicaciones 1-5 la para fabricar un medicamento para prevenir o tratar un trastorno o afección en el que el factor de crecimiento epidérmico es eficaz seleccionado de cicatrización de heridas, tratamiento de enfermedades periodontales y mejora de afecciones cutáneas.
7. El uso de acuerdo con la reivindicación 6, en el que el péptido induce la mejora de afecciones cutáneas.
8. El uso de acuerdo con la reivindicación 7, en el que la mejora de las afecciones cutáneas es la mejora de las arrugas o la elasticidad de la piel, la prevención del envejecimiento de la piel, la prevención de la pérdida de cabello, la estimulación del crecimiento de cabello, el tratamiento de la atopia, la mejora de la humedad de la piel o el tratamiento del acné.
Patentes similares o relacionadas:
Proteína de fusión termoestable del factor de crecimiento epidérmico humano con veneno de araña que tiene un mayor efecto de la proliferación celular en la piel y una composición cosmética para mitigar las arrugas de la piel y mantener la elasticidad, que contiene la misma como ingrediente activo, del 16 de Octubre de 2019, de Nexgen Biotechnologies, Inc: Una proteína de fusión termoestable del factor de crecimiento epidérmico humano con veneno de araña con un mayor efecto de proliferación de las células de la piel […]
Proteína de fusión de la toxina botulínica y el factor de crecimiento epidérmico humano con aumento de la proliferación de las células cutáneas y efecto antioxidante, y composición cosmética que contiene la misma como componente eficaz, del 11 de Septiembre de 2019, de Nexgen Biotechnologies, Inc: Una proteína de fusión de la toxina botulínica y el factor de crecimiento epidérmico humano con aumento de la proliferación de las células cutáneas […]
Diseño de armazón de heteromultímero multivalente y constructos, del 9 de Mayo de 2018, de Zymeworks Inc: Un heteromultímero que comprende: al menos una primera proteína monomérica que comprende (i) un primer polipéptido transportador que comprende un […]
Supresión del cáncer, del 29 de Marzo de 2017, de Ipsen Bioinnovation Limited: Un polipéptido, para uso en la supresión o tratamiento del cáncer mediante la inhibición de la secreción autocrina de una célula cancerosa en un paciente, […]
Quimeras de fibronectina: factor de crecimiento, del 21 de Diciembre de 2016, de Factor Therapeutics Limited: Un complejo proteico aislado en forma de una proteína quimérica sintética, que comprende una secuencia de aminoácidos de: (i) un factor de crecimiento, o al menos un dominio […]
Micropartículas con EGF, procedimiento de preparación y uso, del 5 de Junio de 2014, de PRAXIS PHARMACEUTICAL, S.A: Micropartículas con EGF, procedimiento de preparación y uso. La presente invención se refiere a micropartículas que comprenden polímeros biocompatibles […]
Expresión de proteínas de leche humana en plantas transgénicas, del 9 de Abril de 2014, de VENTRIA BIOSCIENCE: Una semilla o planta de arroz transgénica madura transformada de manera estable con un gen quimérico que tiene (i) una secuencia de ADN líder que codifica una […]
NUEVAS PROTEÍNAS DE FUSIÓN DE TROMBOMODULINA DIRIGIDAS HACIA EL FACTOR TISULAR COMO AGENTES ANTICOAGULANTES, del 14 de Marzo de 2011, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: Una proteína de fusión anticoagulante, que comprende una proteína directora hacia diana o un análogo, un fragmento, un derivado o una variante de la misma, que se […]