Peptidomiméticos de horquilla beta fijados a patrón con actividad inhibitoria de proteasa.
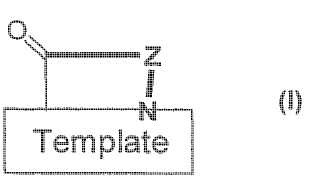
Compuesto de fórmula **Fórmula**
en la que
es un residuo de dipéptido compuesto por dos bloques de construcción de aminoácidos diferentes,
siendo el dipéptido DPro-LPro, y
Z es una cadena de undecapéptido compuesta de once residuos de aminoácidos, en el que el residuo P1 es el residuo de Nle, Ile, Aoc, hLeu, Chg, OctG, hPhe, 4AmPhe, Cha, Phe, Tyr, 2Cl-Phe, Trp, 1-Nal, o Leu;
el residuo P2 es el residuo de Cys, Glu, Nle, Thr, o Gln;
el residuo P3 es el residuo de Thr, Ala o Abu;
el residuo P4 es el residuo de Lys, Nle, Ala, Abu, o Thr;
el residuo P5 es el residuo de Ser, AlloThr, o Dpr;
el residuo P6 es el residuo de Ile, C5al, Leu, Nle, Aoc, OctG, Cha, hLeu, hPhe, Chg, t-BuA, Glu o Asp;
el residuo P7 es el residuo de Pro;
el residuo P8 es el residuo de Pro, Ala o Pro(4NHCOFe);
el residuo P9 es el residuo de Tyr, Phe, Ile, Nle, Cha, Gln, Arg, Lys, His, o Thr; el residuo P10 es el residuo de Cys, Arg, Nle, Gln, Lys, Met, Thr, o Ser, y el residuo P11 es el residuo de Tyr, Gln, Arg, Ser, Nle, 2-Nal, 2Cl-Phe, Cha, Phg, Phe, Asp, Asn, o Thr,
dos residuos de Cys, que están presentes como los residuos P2 y P10, están enlazados mediante un puente bisulfuro formado por la sustitución de los dos grupos -SH en los dos residuos de Cys por un grupo -S-S-, en forma libre o en forma de una sal aceptable farmacéuticamente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/001622.
Solicitante: POLYPHOR LTD.
Nacionalidad solicitante: Suiza.
Dirección: HEGENHEIMERMATTWEG 125 4123 ALLSCHWIL SUIZA.
Inventor/es: OBRECHT, DANIEL, LUDIN, CHRISTIAN, JUNG, FRANCOISE, GOMBERT, FRANK, MOEHLE,KERSTIN, HENZE,HEIKO, DE MARCO,STEVEN J, SELLIER,ODILE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/04 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen hasta 20 aminoácidos en una secuencia totalmente determinada; Sus derivados (gastrinas A61K 38/16, somatostatinas A61K 38/31, melanotropinas A61K 38/34).
- C07K7/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
- C07K7/08 C07K 7/00 […] › con 12 a 20 aminoácidos.
- C07K7/64 C07K 7/00 […] › Péptidos cíclicos que contienen solamente enlaces peptídicos normales.
PDF original: ES-2453540_T3.pdf
Fragmento de la descripción:
Peptidomiméticos de horquilla beta fijados a patrón con actividad inhibitoria de proteasa La presente invención da a conocer peptidomiméticos de horquilla beta fijados a patrón que incorporan una cadena fijada patrón de 11 residuos de aminoácidos que, en función de su posición en la cadena, son tal como se definen a continuación. Estos peptidomiméticos de horquilla beta fijados a patrón son útiles como inhibidores de enzimas proteasa. Son especialmente valiosos como inhibidores de diversas proteasas de serina, tales como la catepsina G, elastasa, o triptasa humanas. Además, la presente invención da a conocer un procedimiento eficiente, por el que estos compuestos pueden, si se desea, construirse en formato de biblioteca.
Los peptidomiméticos de horquilla beta de la presente invención muestran una eficacia y biodisponibilidad oral mejoradas, mejora de la vida media y, lo más importante, una elevada proporción de selectividad entre las diferentes proteasas de serina, que depende de la elección adecuada de ciertos tipos de residuos de aminoácidos y su posición en dicha cadena. Además, estos peptidomiméticos de horquilla beta presentan una hemólisis baja en las células rojas de la sangre y una baja citotoxicidad.
Compuestos con estructuras que muestran alguna similitud con las estructuras de los peptidomiméticos de horquilla beta de la presente invención se dan a conocer a partir del documento WO-A-2002070547, que da a conocer compuestos con actividad antimicrobiana y anticancerígena; del documento WO-A-2003054000, que da a conocer compuestos útiles como inhibidores de enzimas de proteasa; del documento WO-A-2004018503 y del documento WO-A-2004033489, que dan a conocer compuestos con actividad antimicrobiana y del documento WO-A2004096838 y del documento WO-A-2004096839, que dan a conocer compuestos útiles como antagonistas del receptor de quimiocinas CXCR4.
Están surgiendo inhibidores de proteasas con utilizaciones terapéuticas prometedoras en el tratamiento de enfermedades, tales como cánceres (R. P. Beckett y otros, Drug Disc. Today 1996, 1, 16-26; L. L. Johnson y otros, Curr. Opin. Chem. Biol. 1998, 2; 466-71; D. Leung y otros, J. Med. Chem. 2000, 43, 305-341; T. Rockway, Expert Opin. Ther. Patents 2003, 13, 773-786) , infecciones parasitarias, fúngicas, y virales [por ejemplo, esquistosomiasis (M. M. Becker y otros, J. Biol. Chem. 1995, 270, 24496-501) ; C. albicans (C. Abad-Zapetero y otros, Protein Sci. 1996, 5, 640-52) , VIH (A. Wlodawer y otros, Annu. Rev. Biochem. 1993, 62, 543-85; P. L. Darke y otros, Adv. Pharmacol. 1994, 5, 399-454) , hepatitis (J. L. Kim y otros, Cell 1996, 87, 343-55; R. A. Love y otros, Cell 1996, 87, 331-342) , herpes (W. Gibson y otros, Drug Des. Discov. 1997, 15, 39-47) ], y defectos inflamatorios, inmunológicos, respiratorios (P. R. Bernstein y otros, Prog. Med. Chem. 1994, 31, 59-120; T. E. Hugli, Trends Biotechnol. 1996, 14, 409-12) , cardiovasculares (M. T. Stubbs y otros, Thromb. Res. 1993, 69, 1-58; H. Fukami y otros, Current Pharmaceutical Design 1998, 4, 439-453) , y neurodegenerativos, entre los que se incluyen la enfermedad de Alzheimer (R. Vassar y otros, Science 1999, 286, 735-41) , la angiogénesis (M. Kaatinen y otros, Atherosklerosis 1996, 123, 1-2, 123-131) , y la esclerosis múltiple (M. Z. Ibrahim y otros, J. Neuroimmunol. 1996, 70, 131-138) .
Dado que la mayoría de las proteasas se unen a sus sustratos en conformaciones extendidas o de cadena beta, los buenos inhibidores deben ser capaces de mimetizar una conformación de este tipo. De este modo, los miméticos de horquilla beta son ideales para bloquear secuencias de péptidos en una conformación extendida.
Entre las proteasas, las proteasas de serina constituyen dianas terapéuticas importantes. Las proteasas de serina se clasifican por su especificidad por el sustrato, sobre todo por el tipo de residuos que se encuentran en P1, ya sea de tipo tripsina (residuos Lys/Arg de carga positiva preferentemente en P1) , de tipo elastasa (residuos Ala/Val pequeños hidrófobos en P1) , o de tipo quimotripsina (residuos Fe/Tyr/Leu grandes hidrofóbos en P1) . Entre las proteasas de serina, para las cuales se dispone de datos de cristalografía de rayos X de los inhibidores de proteasa en la base de datos PDB (PDB: www.rcsb.org/pdb) , se incluyen tripsina, alfa-quimotripsina, gamma-quimotripsina, elastasa de neutrófilos humanos, trombina, subtilisina, citomegalovirus humano, proteinasa A, achromobacter, catepsina G humana, proteasa específica de ácido glutámico, carbopeptidasa D, factor VIIa de coagulación de la sangre, factor porcino 1XA, mesentericopeptidasa, proteasa del VHC, y termitasa. Entre otras proteasas de serina, que son de interés terapéutico, se incluyen triptasa, convertasa complemento, y proteasa de la hepatitis C-NS3. Los inhibidores de trombina (por ejemplo, J. L. Metha y otros, J. Cardiovasc. Pharmacol. 1998, 31, 345-51; C. Lila y otros, Synth. Comm. 1998, 28, 4419-29) y el factor Xa (por ejemplo, J. P. Vacca, Annu. Rep. Med. Chem. 1998, 33, 81-90) están en evaluación clínica como antitrombóticos, los inhibidores de la elastasa (J. R. Williams y otros, Am. Rev. Respir. Dis. 1991, 144, 875-83) se encuentran en ensayos clínicos contra el enfisema y otras enfermedades pulmonares, mientras que los inhibidores de triptasa se encuentran actualmente en fase II de ensayos clínicos contra el asma (C. Seife, Science 1997, 277, 1602-3) , inhibidores de la uroquinasa contra el cáncer de mama, e inhibidores de quimasa contra las enfermedades relacionadas con el corazón. Por último, la catepsina G y elastasa están íntimamente implicadas en la modulación de las actividades de las citoquinas y sus receptores. Particularmente, en sitios de inflamación se liberan concentraciones elevadas de catepsina G, elastasa y proteinasa 3 desde las células de infiltración polimorfonucleares en una correlación temporal cercana con los niveles elevados de citoquinas inflamatorias, lo que indica claramente que estas proteasas están implicadas en el control de la bioactividad y la disponibilidad de citoquinas y (U. Bank y otros, J. Leukoc. Biol. 2001, 69, 177-90) . De este modo, los inhibidores de la elastasa y la catepsina G constituyen objetivos valiosos para nuevos candidatos a fármacos, particularmente para la enfermedad pulmonar obstructiva crónica (H. Ohbayashi, Expert Opin. Investig. Drugs 2002, 11, 965-980) .
De los muchos inhibidores de la proteasa de serina proteináceos que existen, uno es un péptido cíclico de 14 aminoácidos procedente de semillas de girasol, denominado inhibidor de la tripsina de girasol (SFTI-1; S. Luckett y otros, J. Mol. Biol. 1999, 290, 525-533; Y. Q. Long y otros, Biorg. & Med. Chem. Lett. 2001, 11, 2515-2519) , que muestra similitud tanto secuencial como conformacional con el bucle reactivo a tripsina de la familia de los inhibidores de la proteasa de serina de Bowman-Birk. El inhibidor adopta una conformación de horquilla beta, cuando se une al sitio activo de la beta tripsina bovina. SFTI-1 inhibe la beta tripsina (Ki < 0, 1 nM) , catepsina G (Ki ~ 0, 15 nM) , elastasa (Ki ~ 105 microM) , quimotripsina (Ki ~ 7, 4 microM) y la trombina (Ki ~ 136 mM) .
Los presentes inventores muestran a continuación un enfoque para el diseño de inhibidores, que comprende trasplantar el bucle de horquilla beta del péptido de origen natural a un patrón inductor de horquilla. Sobre la base de la estructura 3D bien definida de los miméticos de horquilla beta, se pueden diseñar bibliotecas de compuestos, que en última instancia pueden conducir a nuevos inhibidores que muestran diferentes perfiles de especificidad frente a varias clases de proteasas.
Se han descrito en la literatura péptidos miméticos de horquilla fijados a patrón (D. Obrecht y otros, Adv. Med. Chem. 1999, 4, 1-68; J. A. Robinson, Syn. Lett. 2000, 4, 429-441) , y se han descrito en la solicitud de patente internacional WO 2003/054000 A1 y en A. Descours y otros, ChemBioChem 2002, 3, 318-323, peptidomiméticos fijados a patrón que inhiben la proteasa de serina y métodos para su síntesis, pero las moléculas anteriormente descritas no muestran una elevada selectividad ni, particularmente, elevada potencia. Sin embargo, se ha establecido ahora la capacidad de generar peptidomiméticos de horquilla beta utilizando métodos de síntesis combinatoria y paralela (L. Jiang y otros, Helv. Chim. Acta 2000, 83, 3097-3112) .
Estos métodos permiten la síntesis y cribado de grandes bibliotecas de miméticos de horquilla, que a su vez facilitan considerablemente los estudios de estructura frente a actividad y, por lo tanto, el descubrimiento de nuevas moléculas con actividad inhibitoria de la proteasa de serina de potencia y selectividad elevadas, biodisponibilidad oral, baja actividad hemolítica para células de... [Seguir leyendo]
Reivindicaciones:
1. Compuesto de fórmula
en la que es un residuo de dipéptido compuesto por dos bloques de construcción de aminoácidos diferentes, siendo el dipéptido DPro-LPro, y Z es una cadena de undecapéptido compuesta de once residuos de aminoácidos, en el que el residuo P1 es el residuo de Nle, Ile, Aoc, hLeu, Chg, OctG, hPhe, 4AmPhe, Cha, Phe, Tyr, 2Cl-Phe, Trp, 1-Nal, o Leu;
el residuo P2 es el residuo de Cys, Glu, Nle, Thr, o Gln; el residuo P3 es el residuo de Thr, Ala o Abu; el residuo P4 es el residuo de Lys, Nle, Ala, Abu, o Thr; el residuo P5 es el residuo de Ser, AlloThr, o Dpr; el residuo P6 es el residuo de Ile, C5al, Leu, Nle, Aoc, OctG, Cha, hLeu, hPhe, Chg, t-BuA, Glu o Asp;
el residuo P7 es el residuo de Pro; el residuo P8 es el residuo de Pro, Ala o Pro (4NHCOFe) ; el residuo P9 es el residuo de Tyr, Phe, Ile, Nle, Cha, Gln, Arg, Lys, His, o Thr; el residuo P10 es el residuo de Cys, Arg, Nle, Gln, Lys, Met, Thr, o Ser, y el residuo P11 es el residuo de Tyr, Gln, Arg, Ser, Nle, 2-Nal, 2Cl-Phe, Cha, Phg, Phe, Asp, Asn, o Thr,
dos residuos de Cys, que están presentes como los residuos P2 y P10, están enlazados mediante un puente bisulfuro formado por la sustitución de los dos grupos -SH en los dos residuos de Cys por un grupo –S-S-, en forma libre o en forma de una sal aceptable farmacéuticamente.
2. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Phe, hPhe, 4AmPhe, Nle, Chg, Ile, Tyr, Trp, 2Cl-Phe, 1-Nal, o Cha; el residuo P2 es el residuo de Cys, Glu, o Nle; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys, o Nle;
el residuo P5 es el residuo de Ser, AlloThr, o Dpr; el residuo P6 es el residuo de Asp, o Glu; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Ile, Nle, Cha, Gln, o Tyr; el residuo P10 es el residuo de Cys, Arg, o Nle, y
el residuo P11 es el residuo de Thr, Asp, Ser, Tyr, Phe, Asn, o Arg.
3. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Ile, Nle, Aoc, hLeu, Chg, OctG, o hPhe;
el residuo P2 es el residuo de Cys, Glu, Thr, o Gln; el residuo P3 es el residuo de Thr, Ala o Abu; el residuo P4 es el residuo de Ala, Thr, o Abu; el residuo P5 es el residuo de Ser; el residuo P6 es el residuos de OctG, Ile, Cha, Leu, C5al, Nle, Aoc, Chg, t-BuA o hLeu;
el residuo P8 es el residuo de Pro o Pro (4NHCOFe) ; el residuo P9 es el residuo de Gln, Tyr, Ile, o Fe;
el residuo P10 es el residuo de Cys, Lys, Gln, Thr, Met, o Arg, y el residuo P11 es el residuo de Tyr, Ser, Arg, Gln, Nle, 2-Nal, 2Cl-Phe, Phe, Cha, o Phg.
4. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Cha, Tyr, o Trp; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Leu; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Lys; el residuo P10 es el residuo de Cys, y
el residuo P11 es el residuo de Arg.
5. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Phe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp;
el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Tyr.
6. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Ile; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr;
el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Nle; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
7. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Ile; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Cha; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
8. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Ile; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Nle; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro;
el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
9. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Phe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Nle; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Tyr.
10. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Chg; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro;
el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Tyr.
11. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Nle; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala;
el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Ile; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Gln.
12. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de Nle;
el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Ile; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Tyr.
13. Compuesto, según la reivindicación 1 de la fórmula I, en el que, en dicha cadena de undecapéptido,
el residuo P1 es el residuo de hPhe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de OctG; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln;
el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Gln.
14. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG;
el residuo P2 es el residuo de Gln; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Ile;
el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Thr, y el residuo P11 es el residuo de Tyr.
15. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de hPhe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr;
el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Cha; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln;
el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Fe.
16. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Glu; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser;
el residuo P6 es el residuo de Ile; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Lys, y el residuo P11 es el residuo de Tyr.
17. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Cys;
el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Cha; el residuo P8 es el residuo de Pro;
el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Phe.
18. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de hPhe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala;
el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Cha; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y
el residuo P11 es el residuo de Gln.
19. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Cys;
el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Cha; el residuo P8 es el residuo de Pro (4NHCOFe) ; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Gln.
20. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de hPhe; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de OctG; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y
el residuo P11 es el residuo de Tyr.
21. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de Chg; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp;
el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Thr.
22. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de Chg; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr;
el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Asp; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Ile; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Asp.
23. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Cha; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Gin.
24. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr;
el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Ile; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Tyr.
25. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de OctG; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Ala; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de OctG; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Gln; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Gln.
26. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de Cha; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Leu; el residuo P8 es el residuo de Pro;
el residuo P9 es el residuo de Lys; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
27. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de Tyr; el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys;
el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Leu; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Lys; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
28. Compuesto, según la reivindicación 1 de la fórmula I, en el que en dicha cadena de undecapétido,
el residuo P1 es el residuo de Trp;
el residuo P2 es el residuo de Cys; el residuo P3 es el residuo de Thr; el residuo P4 es el residuo de Lys; el residuo P5 es el residuo de Ser; el residuo P6 es el residuo de Leu; el residuo P8 es el residuo de Pro; el residuo P9 es el residuo de Lys; el residuo P10 es el residuo de Cys, y el residuo P11 es el residuo de Arg.
29. Compuesto, según la reivindicación 1 de la fórmula I, en forma de un enantiómero.
30. Compuesto, según cualquiera de las reivindicaciones 1 a 29 de la fórmula I, para su utilización como una sustancia terapéuticamente activa.
31. Compuesto, según la reivindicación 30 de la fórmula I, con actividad selectiva inhibidora de proteasa, en
particular contra la catepsina G, la elastasa o la triptasa; y/o con actividad contra el cáncer; y/o con actividad antiinflamatoria; y/o con actividad antiinfecciosa; y/o con actividad frente a una enfermedad cardiovascular; y/o con actividad contra una enfermedad inmunológica; y/o con actividad antineurodegenerativa; y/o con actividad contra una enfermedad pulmonar.
32. Composición farmacéutica que comprende un compuesto, según una cualquiera de las reivindicaciones 1 a 29 de la fórmula I, como ingrediente activo y un vehículo farmacéuticamente aceptable.
33. Composición, según la reivindicación 32, caracterizada porque está presente en una forma adecuada para su administración oral, bucal, rectal, vaginal, tópica, transdérmica, transmucosa, pulmonar, por inyección, inhalación o 15 implantación.
34. Composición, según la reivindicación 32 o la reivindicación 33, caracterizada porque está presente en forma de una tableta, una gragea, una cápsula, una pastilla, una píldora, un polvo, un líquido, una solución, un jarabe, un elixir, una dispersión, una suspensión, una emulsión, un gel, una crema, una pomada, un emplasto, un aerosol, un nebulizador, un inhalador, un insuflador, un supositorio, un sistema de liberación sostenida, una formulación de acción prolongada, una preparación de depósito o un liposoma.
35. Utilización de un compuesto, según cualquiera de las reivindicaciones 1 a 29 de la fórmula I, para la fabricación de un medicamento para la inhibición de una enzima proteasa. 25
36. Utilización, según la reivindicación 35, caracterizada porque dicho medicamento está destinado a ser utilizado para la prevención de una infección en un individuo sano o para retrasar una infección en un paciente infectado, o en la que el cáncer está mediado por la actividad de la proteasa; o es resultante de la actividad de la misma, o en la que una enfermedad inmunológica está mediada por la actividad de la proteasa; o es el resultado de la actividad de la misma o en la que la inflamación está mediada por la actividad de la proteasa; o es el resultado de la actividad de la misma, o en la que una reacción inmunológica está mediada por la actividad de la proteasa o es el resultado de la actividad de la misma.
37. Utilización de un compuesto, según una cualquiera de las reivindicaciones 2 y 5 a 10 de la fórmula I, para la 35 fabricación de un medicamento para la inhibición de la catepsina G.
38. Utilización de un compuesto según una cualquiera de las reivindicaciones 3 y 11 a 22 de la fórmula I, para la fabricación de un medicamento para inhibir la elastasa.
39. Utilización de un compuesto, según una cualquiera de las reivindicaciones 4 y 23 a 25 de la fórmula I, para la fabricación de un medicamento para la inhibición de la triptasa.
40. Procedimiento para la fabricación de un compuesto según una cualquiera de las reivindicaciones 1 a 28 de la fórmula I, que comprende 45
a) acoplar a un soporte sólido apropiadamente funcionalizado un derivado apropiadamente protegido en N del aminoácido, que en el producto final deseado está en la posición 5, 6 ó 7, y cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando de la misma manera protegido apropiadamente;
b) eliminar el grupo N-protector del producto obtenido de este modo; c) acoplar el producto obtenido de este modo con un derivado apropiadamente protegido en N del aminoácido, que en el producto final deseado está una posición más cercana al residuo de aminoácido N-terminal, y cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando de la misma manera protegido apropiadamente;
d) eliminar el grupo N-protector del producto obtenido de este modo; e) repetir las etapas (c) y (d) , hasta que el residuo de aminoácido N-terminal ha sido introducido; f) acoplar el producto obtenido de este modo con un compuesto de fórmula en el que es como se define en la reivindicación 1 y X es un grupo protector de N, o, alternativamente,
(fa) acoplar el producto obtenido en la etapa (e) con un derivado protegido apropiadamente en N del
aminoácido L-prolina; (fb) eliminar el grupo N-protector del producto obtenido de este modo, y (fc) acoplar el producto obtenido de este modo con un derivado protegido apropiadamente en N del amino ácido D-prolina;
g) eliminar el grupo protector de N del producto obtenido en la etapa (f) o en la etapa (fc) ;
h) acoplar el producto obtenido de este modo con un derivado de aminoácido protegido apropiadamente en N, que en el producto final deseado se encuentra en la posición 11, y cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando igualmente protegido adecuadamente; i) eliminar el grupo N-protector del producto obtenido de este modo;
j) acoplar el producto obtenido de este modo con un derivado de aminoácido protegido apropiadamente en N, que en el producto final deseado está una posición más lejana de la posición 11, y cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando de la misma manera protegido apropiadamente;
k) eliminar el grupo N-protector del producto obtenido de este modo; 25 l) repetir las etapas (j) y (k) , hasta que se hayan introducido todos los residuos de aminoácidos; m) si se desea, desproteger selectivamente uno o varios grupos funcionales protegidos presentes en la molécula y sustituir apropiadamente el o los grupos reactivos liberados de este modo; n) si se desea, formar un enlace intercatenario entre las cadenas laterales de los residuos de aminoácidos apropiados en las posiciones 2 y 10;
o) separar el producto obtenido de este modo del soporte sólido; p) ciclar el producto escindido del soporte sólido; q) eliminar cualquier grupo protector presente en un grupo funcional de cualquier residuo de aminoácido en el producto cíclico obtenido de este modo y, si se desea, cualquier grupo protector, que puede estar presente además en la molécula obtenida de este modo; y
r) si se desea, convertir un compuesto de la fórmula I en forma libre obtenido de este modo en una sal farmacéuticamente aceptable, o convertir una sal farmacéuticamente aceptable, o inaceptable, sal obtenida de este modo en el correspondiente compuesto de la fórmula I en forma libre o en una sal farmacéuticamente aceptable diferente.
41. Procedimiento para la fabricación de un compuesto, según cualquiera de las reivindicaciones 1 a 28 de la fórmula I, procedimiento que comprende
a') acoplar un soporte sólido apropiadamente funcionalizado con un compuesto de la fórmula en la que es tal como se define en la reivindicación 1 y X es un grupo protector de N, o, alternativamente,
(a'a) de acoplamiento dicho soporte sólido apropiadamente funcionalizado con un derivado protegido apropiadamente en N del aminoácido L-prolina; (a'b) eliminar el grupo N-protector del producto obtenido de este modo; y
(a'c) acoplar el producto obtenido de este modo con un derivado protegido apropiadamente en N del aminoácido D-prolina;
b') eliminar el grupo protector de N del producto obtenido en la etapa (a') o la etapa (a'c) ; c') acoplar el producto obtenido de este modo con un derivado protegido apropiadamente en N del aminoácido,
que en el producto final deseado se encuentra en la posición 11, y cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando de la misma manera protegido adecuadamente;
d') eliminar el grupo N-protector del producto obtenido de este modo; e') acoplar el producto obtenido de este modo con un derivado de aminoácido apropiadamente protegido en N,
que en el producto final deseado está una posición más lejana de la posición 11, cualquier grupo funcional, que pueda estar presente en dicho derivado de aminoácido protegido en N, estando de la misma manera protegido apropiadamente;
f') eliminar el grupo protector en N del producto obtenido de este modo; g') repetir las etapas (e') y (f) , hasta que todos los residuos de aminoácidos se han introducido; 25 h') si se desea, desproteger selectivamente uno o varios grupos funcionales protegidos presentes en la molécula y sustituir apropiadamente el o los grupos reactivos liberados de este modo; i') si se desea, formar un enlace intercatenario entre las cadenas laterales de los residuos de aminoácidos apropiados en las posiciones 2 y 10; j') separar el producto obtenido de este modo del soporte sólido; 30 k') ciclar el producto escindido del soporte sólido;
l') retirar cualquier grupo protector presente en un grupo funcional de cualquier residuo de aminoácido en el producto cíclico obtenido de este modo y, si se desea, cualquier grupo protector, que pueda además estar presente en la molécula obtenida de este modo, y
m') si se desea, convertir un compuesto de la fórmula I en forma libre obtenido de este modo en una sal
farmacéuticamente aceptable, o convertir una sal farmacéuticamente aceptable, o inaceptable, sal obtenida de este modo en el correspondiente compuesto de la fórmula I en forma libre o en una sal farmacéuticamente aceptable diferente.
42. Procedimiento, según la reivindicación 40 o la reivindicación 41, para la fabricación de un compuesto tal como se define en la reivindicación 29 de la fórmula I, procedimiento que comprende la utilización de cualquier material de partida quiral en forma de un enantiómero.
Patentes similares o relacionadas:
Uso del péptido qbp1 para la prevención o el tratamiento del trastorno del estrés postraumático, el síndrome de estrés agudo y/o el síndrome de adaptación general, del 8 de Abril de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Una composición que comprende un péptido que consiste en una secuencia de aminoácidos con al menos un 70% de identidad con la SEQ ID NO: 1, o que […]
Péptidos capaces de reactivar mutantes de p53, del 18 de Marzo de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un péptido recombinante o sintético que comprende una secuencia de aminoácidos expuesta en la SEQ ID NO: 314, en donde dicho péptido reactiva […]
Péptidos de diseño corto que poseen acciones selectivas contra bacterias y células cancerosas, del 26 de Febrero de 2020, de THE UNIVERSITY OF MANCHESTER: Un péptido con la fórmula I o II que se muestra a continuación **(Ver fórmula)** en donde: A1v se selecciona de G, GKI o GIK […]
Compuestos para su uso en el tratamiento y/o prevención de una infección de mycoplasma sp., del 31 de Enero de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Compuestos para su uso en el tratamiento y/o prevención de una infección de mycoplasma sp. La presente invención hace referencia a compuestos con […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Análogos de compstatina de acción prolongada y composiciones y métodos relacionados, del 8 de Enero de 2020, de Apellis Pharmaceuticals, Inc: Un análogo de compstatina de acción prolongada que comprende un resto reductor de la eliminación unido con dos restos análogos de compstatina, en donde cada resto […]
Péptidos, dispositivos y procedimientos para la detección de anticuerpos de Anaplasma, del 20 de Noviembre de 2019, de Abaxis, Inc: Una composición que comprende una población de péptidos aislados, comprendiendo dicha población tres o más péptidos diferentes, en la que cada péptido en la población […]
Terapias de antibióticos peptídicos derivados del búfalo de agua, del 20 de Noviembre de 2019, de Centaur, Inc: Una composición antibiótica que comprende un péptido antibiótico, en donde el péptido comprende una secuencia aminoacídica sintética que tiene la […]