Optimización del aclaramiento para moléculas unidas a proteínas usando terapia de filtración en cascada.
Un sistema de filtración sanguínea extracorpóreo (100) para eliminar moléculas no deseadas de un flujo de sangre procedente de un paciente,
que comprende:
un primer hemofiltro (13) para elevar la hemoconcentración de la sangre en un flujo sanguíneo filtrado;
un primer fluido de sustitución (17) para suplementar el flujo sanguíneo filtrado;
un segundo hemofiltro (19) para filtrar moléculas no deseadas del flujo sanguíneo suplementado;
y
un segundo fluido de sustitución (23) para suplementar el flujo de salida procedente del segundo hemofiltro para retorno al paciente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/080023.
Solicitante: NIKKISO CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: Yebisu Garden Place Tower, 20-3, Ebisu 4-chome, Shibuya-ku Tokyo 150-6022 JAPON.
Inventor/es: LANNOY,JEAN-MICHEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61M1/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 1/00 Dispositivos de succión o de bombeo de uso médico; Dispositivos para extraer, tratar o transportar los líquidos del cuerpo; Sistemas de drenaje (catéteres A61M 25/00; conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; dispositivos para tomar muestras sanguíneas A61B 5/15; instrumentos para retirar la saliva para dentistas A61C 17/06; filtros para implantar en los vasos sanguíneos A61F 2/01). › Filtración de la sangre a través de una membrana para eliminar una sustancia, es decir hemofiltración, diafiltración.
PDF original: ES-2542999_T3.pdf
Fragmento de la descripción:
Optimización del aclaramiento para moléculas unidas a proteínas usando terapia de filtración en cascada Campo
La invención se refiere, en general, a una purificación sanguínea extracorpórea a través de hemofiltración. Más específicamente, la invención se refiere a la eliminación, o aclaramiento, de moléculas unidas a proteínas de la sangre a través de múltiples hemofiltros en cascada.
Antecedentes
La filtración sanguínea extracorpórea ha sido usada ampliamente durante muchos años, de la forma más habitual en terapias continuas de reemplazo renal (TCRR) para tratar pacientes que padecen pérdida o alteración de las funciones renales naturales. Más recientemente, la filtración sanguínea extracorpórea ha sido adaptada para aplicación más general en plasmaféresis, la purificación de sangre a través de la eliminación de componentes nocivos que circulan en el plasma sanguíneo. Ha surgido un interés considerable en el uso de plasmaféresis como un medio para tratar pacientes de UCI que padecen enfermedades relacionadas con el mediador inflamatorio tales como choque séptico, síndrome de respuesta inflamatoria sistémica (SRIS), y fallo multiorgánico (FMO). Estas afecciones pueden surgir a partir de la liberación excesiva de mediadores inflamatorios en el torrente sanguíneo por sobreestimulación del sistema inmunitario. Por lo tanto, la plasmaféresis así como otras TCRR se han propuesto como mecanismos para eliminar mediadores inflamatorios del torrente sanguíneo para contrarrestar una respuesta inflamatoria excesiva.
Otras aplicaciones para plasmaféresis incluyen el tratamiento de trastornos autoinmunitarios, y el tratamiento de pancreatitis aguda grave.
En un sistema de hemofiltración típico tal como el usado en plasmaféresis, se extrae sangre de un paciente a través de un punto de acceso, habitualmente mediante inserción de un catéter venoso en una vena de una extremidad o central, y se bombea a través de un circuito extracorpóreo que incluye un riñón artificial o hemofiltro. El hemofiltro incluye una membrana semipermeable, habitualmente sintética, con tamaños de poro seleccionados para dejar pasar a moléculas no deseadas. La bomba proporciona una presión hidrostática positiva suficiente para hacer circular sangre a lo largo de una superficie de la membrana, y empujar agua y productos de desecho desde la sangre a través de la membrana del filtro y al interior de un fluido de filtración. Este proceso también conocido como ultrafiltración, hace que los sólidos y solutos suspendidos de alto peso molecular permanezcan en la sangre, mientras que el agua y los solutos de bajo peso molecular pasan a través de la membrana. Un fluido de sustitución estéril, habitualmente a base de bicarbonato, y que tiene concentraciones de electrolitos similares al plasma sanguíneo, se añade a la sangre filtrada para sustituir fluidos vitales y electrolitos perdidos a través de ultrafiltración transmembrana. La sangre y el fluido de sustitución combinados son devueltos a continuación al paciente a través de otro punto de acceso venoso.
Generalmente, la hemofiltración es una terapia continua lenta en la que las sesiones habitualmente duran entre 12 y 24 horas. Los procesos de hemofiltración se clasifican como hemofiltración de bajo volumen (HBV o HFBV) o hemofiltración de alto volumen (HAV o HFAV). El límite entre HBV y HAV está en aproximadamente 6 litros de ultrafiltrado al día. La HAV puede administrarse a una velocidad de hasta 12 litros al día.
Las pruebas experimentales sugieren que ciertos resultados beneficiosos, por ejemplo, tasas de supervivencia más elevadas, pueden obtenerse a partir de HAV, en lugar de terapias de HBV. Véase, por ejemplo, D. Journois et al., "Hemofiltration During Cardiopulmonary Bypass in Pediatric Cardiac Surgery", Anesthesiology Vol. 81, págs. 1181- 1189 (1994); A. Grootendorst et al., "I Light-Volume Hemofiltration Improves Heterodynamics of Endotoxin-lnduced Shock in the Pig", Intensive Care Med., Vol. 18, págs. 235-24 (1992). Se ha formulado la hipótesis de que resultados superiores de HAV pueden ser atribuibles a su capacidad de eliminar más eficazmente sustancias nocivas en el intervalo de peso molecular medio, tales como citoquinas, mediadores autacoides o apoptóticos.
Sin embargo, existen varias desventajas del uso de HAV. Por ejemplo, para soportar un flujo sanguíneo de alto volumen, puede ser necesario instalar múltiples catéteres o un catéter muy grande en el paciente para reducir la resistencia. Además, la HAV requiere hemofiltros más grandes, más caros con membranas de alto flujo que pueden procesar el intercambio de fluido en el intervalo de 1 litros al día. De forma más crítica, la HAV debe monitorizarse cuidadosamente para impedir complicaciones. Por ejemplo, el intercambio de fluido de alto volumen durante un periodo de tiempo relativamente corto puede causar hipotermia. Para proteger contra la hipotermia, el fluido de sustitución debe mantenerse caliente, y su temperatura monitorizarse durante el ciclo de tratamiento.
El documento WO 2/36247 desvela un método y aparato de diafiltración de dos fases. El aparato comprende primer y segundo dializadores y una fuente de fluido de sustitución que se añade a la sangre entre los primer y segundo dializadores cuando el aparato está en funcionamiento.
El documento US 27/66928 desvela un aparato para llevar a cabo terapia continua de reemplazo renal. El aparato comprende un hemofiltro y una fuente de fluido de sustitución que, en una realización, se añade a la sangre antes y después del hemofiltro cuando el aparato está en funcionamiento.
Sumario
De acuerdo con la presente invención se proporciona un sistema de filtración sanguínea extracorpóreo de acuerdo con la reivindicación 1
La invención proporciona un sistema para eliminar moléculas no deseadas de un flujo de sangre. Dos o más hemofiltros están dispuestos en una configuración en cascada en un circuito extracorpóreo. En una realización, un flujo de sangre que contiene moléculas no deseadas unidas a proteínas es dirigido a través de primer y segundo hemofiltros en cascada. La filtración de la sangre en el primer hemofiltro eleva la concentración de las moléculas unidas a proteínas no deseadas eliminando por filtración agua y otros solutos de desecho de la sangre. Un fluido de sustitución se combina a continuación con el flujo de salida procedente del primer hemofiltro para crear un diferencial de concentración en el fluido combinado entre moléculas unidas no deseadas y moléculas libres deseadas. El diferencial de concentración promueve una rotura de los enlaces a proteínas, permitiendo que las moléculas no deseadas libres sean eliminadas del fluido en el segundo hemofiltro. Un segundo fluido de sustitución se añade al fluido sanguíneo filtrado dos veces para devolución al paciente. En una realización, las moléculas no deseadas pueden ser mediadores inflamatorios, mediadores apoptóticos o electrolitos.
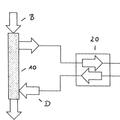
En una realización, un sistema puede estar equipado con una o más bombas, sensores, e instrumental y controles relacionados para llevar a cabo la purificación sanguínea usando HBV o HAV. La retroalimentación de los sensores a un controlador central puede usarse para mantener características de flujo, presión y temperatura apropiadas en el circuito extracorpóreo, tal como caudal de sangre a través de un hemofiltro, o presión transmembrana a través de una membrana semipermeable de hemofiltro. Estas características pueden ajustarse automáticamente mediante algoritmos controladores para optimizar la velocidad de aclaramiento o eliminación de las moléculas no deseadas.
Breve descripción de los dibujos
Las características, objetos y ventajas de la invención se volverán más evidentes a partir de la descripción detallada descrita a continuación cuando se toma junto con los dibujos, en los que:
La figura 1 es un diagrama esquemático de un sistema de filtración sanguínea para eliminar moléculas no deseadas de la sangre de acuerdo con una realización.
La figura 2 es un diagrama esquemático de un sistema de filtración sanguínea extracorpóreo para eliminar moléculas no deseadas de la sangre de acuerdo con una realización.
La figura 3 es un diagrama esquemático de un sistema para controlar la velocidad de eliminación de moléculas no deseadas de acuerdo con una realización.
La figura 4 es un diagrama de flujo de un método para eliminar moléculas no deseadas de la sangre de acuerdo con una realización.
La figura 5 es un diagrama de flujo de otro método para eliminar moléculas no deseadas de la sangre de acuerdo con una realización.
Descripción detallada
La invención... [Seguir leyendo]
Reivindicaciones:
1. Un sistema de filtración sanguínea extracorpóreo (1) para eliminar moléculas no deseadas de un flujo de sangre procedente de un paciente, que comprende:
un primer hemofiltro (13) para elevar la hemoconcentración de la sangre en un flujo sanguíneo filtrado;
un primer fluido de sustitución (17) para suplementar el flujo sanguíneo filtrado;
un segundo hemofiltro (19) para filtrar moléculas no deseadas del flujo sanguíneo suplementado;
y
un segundo fluido de sustitución (23) para suplementar el flujo de salida procedente del segundo hemofiltro para retorno al paciente.
2. El sistema de la reivindicación 1, en el que el primer fluido de sustitución (17) para suplementar el flujo sanguíneo filtrado se selecciona para liberar las moléculas no deseadas de enlaces a proteínas.
3. El sistema de la reivindicación 2, en el que el segundo hemofiltro (19) incluye una membrana (21) que tiene tamaños de poro seleccionados para dejar pasar las moléculas no deseadas libres.
4. El sistema de la reivindicación 1, que comprende además un medio para ajustar el flujo sanguíneo a través del primer hemofiltro (13).
5. El sistema de la reivindicación 1, que comprende además un medio para ajustar la presión transmembrana en el primer hemofiltro (13).
6. El sistema de la reivindicación 1, que comprende además un medio para ajustar el flujo sanguíneo suplementado a través del segundo hemofiltro (19).
7. El sistema de la reivindicación 1, que comprende además un medio para ajustar la presión transmembrana en el segundo hemofiltro (19).
8. El sistema de la reivindicación 1, en el que las moléculas no deseadas incluyen uno o más mediadores.
9. El sistema de la reivindicación 1, que comprende además un controlador para optimizar una velocidad de eliminación de las moléculas no deseadas del flujo sanguíneo.
1. El sistema de la reivindicación 9, en el que el controlador ajusta uno o más del flujo sanguíneo en el primer hemofiltro (13), el flujo sanguíneo en el segundo hemofiltro (19), la presión transmembrana en el primer hemofiltro, la presión transmembrana en el segundo hemofiltro, el flujo del primer fluido de sustitución (17), el flujo del segundo fluido de sustitución (23), la caída de presión a través del primer hemofiltro y la caída de presión a través del segundo hemofiltro.
Patentes similares o relacionadas:
 Dispositivo, así como dispositivo funcional externo y dispositivo de tratamiento para tratar fluidos médicos, del 27 de Mayo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Dispositivo funcional externo con un dispositivo , donde el dispositivo presenta:
- al menos una cámara de recepción de fluido para recibir al menos […]
Dispositivo, así como dispositivo funcional externo y dispositivo de tratamiento para tratar fluidos médicos, del 27 de Mayo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Dispositivo funcional externo con un dispositivo , donde el dispositivo presenta:
- al menos una cámara de recepción de fluido para recibir al menos […]
Dispositivo para filtración de flujo cruzado, del 8 de Abril de 2020, de MANN + HUMMEL GMBH: Dispositivo de prueba en Punto de Atención de filtración de sangre completa que comprende: un volumen de alimentación que tiene una primera abertura lateral de alimentación […]
 Procedimiento para probar la rigidez de un producto desechable, del 25 de Marzo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Procedimiento para probar la rigidez de un producto desechable , destinado al equilibrio volumétrico, para un aparato de tratamiento sanguíneo, con las etapas: […]
Procedimiento para probar la rigidez de un producto desechable, del 25 de Marzo de 2020, de FRESENIUS MEDICAL CARE DEUTSCHLAND GMBH: Procedimiento para probar la rigidez de un producto desechable , destinado al equilibrio volumétrico, para un aparato de tratamiento sanguíneo, con las etapas: […]
Un envase para un concentrado de fluido de diálisis ácido que contiene citrato y glucosa, del 18 de Marzo de 2020, de GAMBRO LUNDIA AB: Un envase que incluye un concentrado que contiene citrato ácido que comprende una concentración total de citrato de 28-45 mM; ácido […]
Filtro de sangre, del 11 de Marzo de 2020, de IMPERIAL COLLEGE OF SCIENCE, TECHNOLOGY AND MEDICINE: Un dispositivo para la eliminación de componentes derivados de la hemólisis de la sangre, el dispositivo comprende: un soporte y una pluralidad […]
Separador de componentes, del 12 de Febrero de 2020, de Dongkoo Bio & Pharma Co., Ltd: Un separador de componentes, que comprende: un cuerpo principal hueco que incluye un conducto de comunicación formado en una porción terminal del mismo, […]
Sistemas y procedimientos de dispositivos médicos domiciliarios para la prescripción y seguimiento de terapia, reparaciones e inventario, del 8 de Enero de 2020, de BAXTER INTERNATIONAL INC.: Un sistema de dispositivo médico domiciliario que comprende: una pluralidad de máquinas de terapia domiciliaria que realizan una terapia domiciliaria […]
Sistema de terapia de fallo renal que presenta un sistema de terapia eléctricamente flotante, del 8 de Enero de 2020, de GAMBRO LUNDIA AB: Un sistema de terapia de fallo renal que comprende: un dializador ; un circuito sanguíneo en comunicación de fluido con el dializador ; un […]