OLIGONUCLEÓTIDOS MODIFICADOS COMO REGULADORES DE LA EXPRESIÓN GÉNICA.
Oligonucleótidos modificados como reguladores de la expresión génica.
La presente invención se refiere a un compuesto de pARNi y un grupo R, donde R se selecciona entre alquilo, cicloalquilo, heterocicloalquilo, arilo y heteroarilo y sus procesos de síntesis. Además también se describen composiciones farmacéuticas que comprenden los compuestos de la invención, así como sus usos en medicina.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201030614.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: OCAMPO,Sandra Milena, ERITJA CASADELLÁ,Ramón, SOMOZA CALATRAVA,Álvaro, MANNING,Brendan, TERRAZAS MARTÍNEZ,Montserrat, AVIÑÓ ANDRÉS,Ana, PERALES LOSA,José Carlos.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/87 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando procedimientos no previstos en otro lugar, p. ej. cotransformación.
PDF original: ES-2372237_A1.pdf
Fragmento de la descripción:
Oligonucleótidos modificados como reguladores de la expresión génica.
La presente invención se refiere a un compuesto de pARNi y un grupo R, donde R se selecciona entre alquilo, cicloalquilo, heterocicloalquilo, arilo y heteroarilo y sus procesos de síntesis. Además también se describen composiciones farmacéuticas que comprenden los compuestos de la invención, así como sus usos en medicina. Por lo tanto pertenece al campo de la técnica de la biotecnología.
Estado de la técnica anterior
El ARN de interferencia (ARNi) es un importante mecanismo de regulación génica que puede ser utilizado para el silenciamiento específico de genes. El proceso es iniciado por ARNs de doble cadena que se denominan pARNi, pequeños ARN de interferencia (small interfering RNAs, siRNAs). Los pARNi, complementarios a un ARN mensajero determinado, se unen a un complejo proteico conocido como RISC. El complejo formado por la unión de la cadena antisentido o guía con RISC cataliza la degradación eficiente de un ARN mensajero específico, provocando un descenso de la proteína Diana. Durante los últimos años, se han realizado numerosos estudios con el fin de utilizar este fenómeno de regulación génica natural como base para una nueva terapia encaminada hacia la reducción específica de una proteína determinada previamente. Así, dicha terapia podría ser utilizada para el tratamiento de enfermedades en las que se conoce que son causadas por la sobreexpresión de genes tales como el cáncer o enfermedades inflamatorias [D. Brumcot y col. RNAi therapeutics: a potential new class of pharmaceutical drugs. Nature Chemical Biology 2 (2006), páginas 711-719; A. de Fougerolles y col. RNA interference in vivo: toward synthetic small inhibitory RNA-based therapeutics Methods in Enzymology 392 (2005), páginas 278-296; C. Chakraborty Potentiality of small interfering RNAs (siRNA) as recent therapeutic targets for gene-silencing. Current Drug Targets 8 (2007) páginas. 469-482], Para que este mecanismo de regulación se pueda convertir en un tratamiento efectivo es necesario que los pARNi produzcan un efecto inhibitorio prolongado, se puedan distribuir eficazmente en el organismo y se puedan dirigir con eficiencia hacia el órgano o tejido o grupo celular dañado. En esta invención se describen nuevos derivados del ARN con modificaciones en el extremo 3' en ambas cadenas, guía y acompañante. Estos nuevos derivados producen pARNi que son más estables a la degradación por nucleasas sin afectar el poder inhibitorio que transcurre a través del mecanismo mediado por RISC. Con el fin de utilizar los pARNi para el tratamiento efectivo de las enfermedades es necesario tener efectos inhibidores más duraderos, obtener una buena distribución de los pARNi en el cuerpo y la liberación controlada de los pARNi en el órgano, tejido o tipo de célula diana.
La introducción de modificaciones químicas en pARNi es una estrategia de gran utilidad para el desarrollo de nuevos compuestos con actividades inhibitorias y farmacológicas interesantes. Normalmente las modificaciones se han introducido en la cadena acompañante, ya que las modificaciones de la cadena guía pueden eliminar totalmente la actividad inhibitoria al comprometer la unión con el complejo proteico responsable de la acción inhibitoria conocido como RISC (RNA Inferference Silencing Complex) [J. Elmen y col. (2005). Use of siRNA modified at 5'-end of sense strand resulting in impaired mRNA cleavage of activated RISC complex for use in treatment of cáncer. PCT Int. Appl. WO 2005/073378 A1].
Descripción de la invención
En la presente invención se describen nuevos compuestos de pARNi que son más estables y/o eficaces en la inhibición de la expresión génica, como por ejemplo el de la luciferasa en células SH-SY5Y y HeLa así como en la inhibición del gen de necrosis tumoral alfa de ratón implicado en varias enfermedades inflamatorias tales como enfermedad de Crown, artritis reumatoide y cáncer. También se describe la síntesis de oligoribonucleótidos que contienen moléculas alquílicas o aromáticas en el extremo terminal 3'.
La presencia de los grupos alifáticos y aromáticos en el extremo 3' tanto de la cadena guía o acompañante mantiene o mejora la estabilidad termodinámica de los dúplex resultantes de la mezcla de las cadenas guía o acompañante para formar un dúplex inhibidor o pARNi. Los duplexes pARNi unidos covalentemente a grupos alifáticos y aromáticos en la posición terminal en 3' pueden ser transfectados a células humanas y los conjugados entran eficientemente en el mecanismo de ARN de interferencia de forma semejante a los dúplex de pARNi sin modificar induciendo la inhibición específica del gen cuya secuencia es complementaria a la secuencia de los pARNi. Además los pARNi modificados tienen una estabilidad a las nucleasas presentes en el suero mucho mas elevada que los pARNi sin modificar por lo que los pARNi descritos en esta invención pueden mantener el silenciamiento génico durante más tiempo que los pARNi sin modificar.
Por lo tanto, un primer aspecto de la presente invención es un compuesto de pARNi y un grupo R unidos covalentemente entre sí representados por la siguiente fórmula (I):

donde:
Y es un dúplex de pARNi, o una cadena sencilla de pARNi, unido mediante un enlace tipo fosfato a X;
R se selecciona entre alquilo, cicloalquilo, heterocicloalquilo, arilo y heteroarilo (p. ej. azoarilo), estando R opcionalmente sustituido con al menos un grupo seleccionado entre halógeno (F, Cl, Br, I), haloalquilo, alquilo, C2-C5 alquenilo, heterocicloalquilo, -NO2, -CN, -CO2Ra, -CORb, -SRc, -CONRdRe, -NRfRg, -ORh, -SO2NRiRj, donde Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Ri y Rj, se seleccionan independientemente entre H y C1-C6 alquilo (como por ejemplo, metilo, etilo, propilo, isopropilo, butilo e isobutilo);
X es una molécula puente unida al pARNi (Y) mediante el enlace tipo fosfato a la posición 3' de la cadena guía o acompañante.
Los compuestos de pARNi que contienen grupos alifáticos y aromáticos en la posición terminal en 3' pueden ser sintetizados con buenos rendimientos. Por tanto, un segundo aspecto es un proceso para la síntesis en fase sólida de los compuestos según se definen el primer aspecto o en cualquiera de sus realizaciones particulares, caracterizado porque comprende las siguientes etapas (A. Aviñó y col. Solid-phase synthesis of oligomers carrying several chromophore units linked by phosphodiester backbones. Bioorganic & Medicinal Chemistry Letters, 18 (2008) 2306-2310]:
Un tercer aspecto es una composición farmacéutica que comprende los compuestos de pARNi de la presente invención y al menos un excipiente o vehículo farmacéuticamente aceptable.
Otro aspecto es el uso de los compuestos de la invención o de las composiciones farmacéuticas de la presente invención para la preparación de un medicamento.
Descripción de las figuras
Figura 1 muestra la estabilidad de los pARNi modificados en el extremo 3' de la cadena guía en suero fetal bovino. Los pARNi modificados se incubaron con suero fetal bovino a 37ºC. A tiempos determinados (0-9 horas) se sacaron alícuotas y se analizaron por electroforesis en geles del 20% de poliacrilamida. Todos los pRNAi modificados contiene la molécula puente de tipo treoninol. WT: sin modificación... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de pARNi y un grupo R unidos covalentemente entre sí representados por la siguiente fórmula (I):
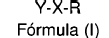
donde:
Y es un dúplex de pARNi unido mediante un enlace tipo fosfato a X;
R se selecciona entre alquilo, cicloalquilo, heterocicloalquilo, arilo y heteroarilo, estando R opcionalmente sustituido con al menos un grupo seleccionado entre halógeno (F, Cl, Br, I), haloalquilo, alquilo, C2-C5 alquenilo, heterocicloalquilo, -NO2, -CN, -CO2Ra, -CORb, -SRc, -CONRdRe, -NRfRg, -ORh y -SO2NRiRj, donde Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Ri y Rj, se seleccionan independientemente entre H, metilo, etilo, propilo, isopropilo, butilo e isobutilo;
X es una molécula puente unida al dúplex de pARNi (Y) mediante el enlace tipo fosfato a la posición 3' de la cadena guía o acompañante.
2. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R es metilo, etilo, propilo, isopropilo, butilo o isobutilo.
3. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R es metilo o etilo, preferiblemente es metilo.
4. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el grupo X-R está unido a la posición terminal 3' de la cadena guía.
5. El compuesto de pARNi según la reivindicación 1, caracterizado porque R es ciclobutilo, ciclopentilo o ciclohexilo.
6. El compuesto de pARNi según la reivindicación 1, caracterizado porque R es fenilo, naftilo, antracilo o pireno.
7. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R es fenilo o naftilo, preferiblemente fenilo.
8. El compuesto de pARNi según la reivindicación 1, caracterizado porque cuando R es heteroarilo se selecciona del grupo formado por acridinilo, quindolinilo, quinolinilo, tienilo, pirrolilo, oxazolilo, tiazolilo, imidazolilo, pirazolilo, isoxazolilo, isotiazolilo, oxadiazolilo, triazolilo, tiadiazolilo, tia-4H-pirazolilo, benzofuranilo, benzotienilo, benzoxazolilo, benzimidazolilo, benzotriazolilo, indazolilo, indolilo, isoindolilo, piridilo, piridazinilo, pirimidilo, pirazinilo, triazinilo, isoquinolinilo, azocinilo, indolizinilo, purinilo, cinnolinilo, ftalazinilo, quinazolinilo, quinoxalinilo, naftapiridinilo, pteridinilo, carbazolilo, fenazinilo, fenotiazinilo, fenoxazinilo, xantenilo y oxapinilo.
9. El compuesto de pARNi según la reivindicación anterior, caracterizado porque cuando R es heteroarilo se selecciona del grupo formado por acridinilo, quindolinilo, quinolinilo, isoquinolinilo, pteridilo y ftalazinilo.
10. El compuesto de pARNi según cualquiera de las reivindicaciones 5 a 9, caracterizado porque el grupo X-R está unido a la posición terminal 3' de la cadena guía.
11. El compuesto de pARNi según cualquiera de las reivindicaciones 5 a 9, caracterizado porque el grupo X-R está unido a la posición terminal 3' de la cadena acompañante.
12. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque R está sustituido con al menos un grupo seleccionado entre F, Cl, Br, I y C1-C3 haloalquilo.
13. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R está sustituido con al menos un grupo seleccionado entre F, Cl, Br, I, -CH2F, -CHF2, -CF3, -CCl3 y -CBr3.
14. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R está sustituido con al menos un grupo seleccionado entre F, -CH2F, -CHF2 y -CF3, preferiblemente F y -CF3.
15. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R es un grupo C1-C6 alquilo sustituido con al menos un grupo F, preferiblemente un grupo C1-C3 alquilo sustituido con al menos un grupo F, más preferiblemente R es un grupo -CF3.
16. El compuesto de pARNi según la reivindicación anterior, caracterizado porque R es un grupo arilo sustituido al menos con un grupo F o -CF3, preferiblemente un grupo fenilo sustituido con un grupo F o -CF3, y más preferiblemente R es 4-fluorofenilo o 4-trifluorometilfenilo.
17. El compuesto de pARNi según la reivindicación 1, caracterizado porque R se selecciona de entre uno de los siguientes grupos:

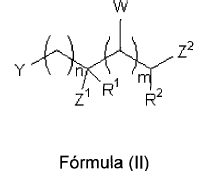
18. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el compuesto de formula (I) comprende un compuesto de fórmula (II):
donde:
W es grupo opcional, y es uno, o varios, sustituyentes que puede haber en cada unidad de metileno y se selecciona, o seleccionan independientemente, entre H, C1-C3 alquilo o Z3;
Z1, Z2 y Z3 se seleccionan independientemente entre -OH, -O-R, -NHC(=O)R y -NH2;
R1 y R2 se seleccionan independientemente entre H y C1-C6-alquilo;
n es un número entero que se selecciona entre 1, 2, 3, 4 y 5;
m es un número entero que se selecciona entre 0, 1, 2, 3 y 4;
Y es según se ha definido en las reivindicaciones anteriores;
R se selecciona independientemente entre los R definidos en las reivindicaciones anteriores.
19. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque presenta la fórmula (III):
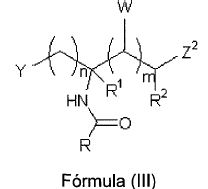
donde:
Y, R, Z2, R1, R2, W, n y m son según se han definido en las reivindicaciones anteriores.
20. El compuesto de pARNi según cualquiera de las dos reivindicaciones anteriores, caracterizado porque n es un número entero que se selecciona entre 1, 2 y 3, preferiblemente n es 1.
21. El compuesto de pARNi según cualquiera de las dos reivindicaciones anteriores, caracterizado porque m es un número entero que se selecciona entre 0, 1 y 2, preferiblemente m es 0.
22. El compuesto de pARNi según cualquiera de las tres reivindicaciones anteriores, caracterizado porque R1 y R2 se seleccionan independientemente entre H y C1-C3-alquilo, preferiblemente entre H y metilo.
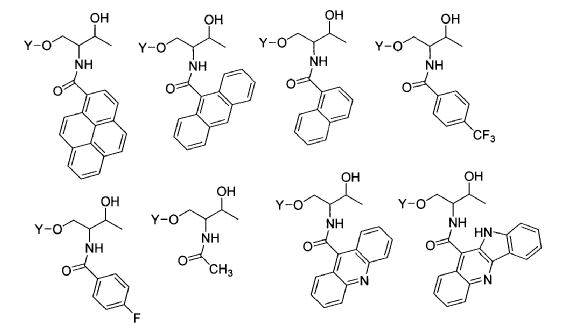
23. El compuesto de pARNi según cualquiera de las tres reivindicaciones anteriores, caracterizado porque el compuesto puente proviene de una molécula de treoninol, glicerol, 2-amino-1,3-propandiol, 2-amino-1,4-butandiol, 3-amino-1,4-butandiol, 3,-amino-1,2-propandiol, hidroxiprolinol o serinol, preferiblemente proviene de treoninol.
24. El compuesto de pARNi según cualquiera de las cinco reivindicaciones anteriores, caracterizado porque comprende alguna de las siguientes estructuras:
25. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el oligonucleótido de pARNi (Y) tiene entre 15 y 40 nucleótidos.
26. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el dúplex de pARNi (Y) tiene entre 15 y 40 nucleótidos por cadena.
27. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el dúplex de pARNi (Y) tiene entre 19 y 25 nucleótidos por cadena.
28. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el dúplex de pARNi comprende al menos una sustitución seleccionada entre 2'-O-metilo-ribonucleótido, 2'-desoxirribonucleótido, 2'-metoxietil-ribonucleótido, 2'-fluoro-desoxirribonucleótido, 2'-fluoro-arabinonucleótido, ARN con enlaces fosforotioato, residuos abásicos, ribitoles, 5-metilcitosina, 5-metiluracilo, 4-alquinilcitosina, 5-alquiniluracilo, 5-halogenocitosina, 5-halogenouracilo, 7-deazaadenina, 7-deazaguanina o hipoxantina.
29. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque dicho dúplex de siARN (Y) inhibe/silencia, total o parcialmente, la expresión de al menos uno de los siguientes genes factor de necrosis tumoral alfa (TNFα), factor de crecimiento endotelial y vascular (VEGF), receptor de VEGF (VEGF R1/2), factor supresor de colonias de granulocitos (GM-CSF-1) y de macrófagos (M-CSF-1), angiopoietina (ANGPT), apolipoproteína (ApoB), neovascularización vascular (CNV), carboxiquinasa fosfoenol piruvato (PEPCK), receptor del factor de crecimiento epidérmico humano (HER2), proteína inflamatoria de macrófagos (MIP2), receptor de N-metil-D aspartato (NMDA), citoquina derivadas de los keratocitos (KC), receptor opio de delta (DOR), receptor del dominio de discoidina (DDR41), gen de la fosfoproteína PIV (PIV-P), oxigenasa hemo (HMOX1), caveloina, transportador de dopamina, proteína fluorescente verde y proteína del sarcoma de Swing (EWS-FL/1).
30. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque el dúplex de pARNi (Y) inhibe/silencia, total o parcialmente, al menos uno de los siguientes genes factor de necrosis tumoral alfa (TNFα), factor de crecimiento endotelial y vascular (VEGF), receptor de VEGF (VEGF R1/2), factor supresor de colonias de granulocitos (GM-CSF-1) y de macrófagos (M-CSF-1).
31. El compuesto de pARNi según cualquiera de las reivindicaciones anteriores, caracterizado porque la secuencia de pARNi se selecciona entre SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 2 y SEQ ID NO: 1.
32. Un compuesto de fórmula (I):

donde:
Y es una cadena sencilla de pARNi unida mediante un enlace tipo fosfato a X;
R se selecciona entre alquilo, cicloalquilo, heterocicloalquilo, arilo y heteroarilo, estando R opcionalmente sustituido con al menos un grupo seleccionado entre halógeno (F, Cl, Br, I), haloalquilo, alquilo, C2-C5 alquenilo, heterocicloalquilo, -NO2, -CN, -CO2Ra, -CORb, -SRc, -CONRdRe, -NRfRg, -ORh, -SO2NRiRj; donde Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Ri y Rj, se seleccionan independientemente entre H, metilo, etilo, propilo, isopropilo, butilo e isobutilo;
X es una molécula puente unida a la cadena sencilla de pARNi (Y) mediante el enlace tipo fosfato a la posición 3'.
33. Un proceso para la síntesis en fase sólida de los compuestos según se definen en cualquiera de las reivindicaciones 1 a 31, caracterizado porque comprende las siguientes etapas:
34. El proceso según la reivindicación anterior, caracterizado porque el soporte sólido se selecciona entre vidrio, gel de sílice, vidrio poroso, óxido de silicio, poliestireno, polietilenglicol, poliestireno-polietilenglicol, poliamida, poliacrilamida, cloruro de polivinilo, teflón, papel y celulosa.
35. El proceso según cualquiera de las dos reivindicaciones anteriores, caracterizado porque el grupo R es unido a un soporte sólido a través de una molécula puente y al menos una de las cadenas del pARNi es sintetizada utilizando el procedimiento de síntesis en fase sólida utilizando el soporte sólido funcionalizado con el grupo R.
36. El proceso según cualquiera de las tres reivindicaciones anteriores, caracterizado porque el grupo R es unido a un soporte sólido y al menos una de las cadenas del pARNi es sintetizada por adición sucesiva de derivados de los nucleósidos que constituyen la secuencia de la cadena incluyendo los fosforamiditos, los H-fosfonatos, los fosfatos diéster y los fosfatos monoéster.
37. El proceso según cualquiera de las cuatro reivindicaciones anteriores, caracterizado porque el grupo R es unido a un soporte sólido y al menos una de las cadenas del pARNi es sintetizada por adición sucesiva de los fosforamiditos de los nucleósidos que constituyen la secuencia de la cadena.
38. Una composición farmacéutica que comprende cualquiera de los compuestos de pARNi como se describen en las reivindicaciones 1 a 32 y al menos un excipiente o vehículo farmacéuticamente aceptable.
39. La composición farmacéutica según la reivindicación anterior, caracterizada porque comprende un agente de transfección.
40. La composición farmacéutica según la reivindicación anterior, caracterizada porque el agente de transfección se selecciona entre uno o mezclas de los siguientes compuestos lipofectina, liptofectamina, oligofectamina, effectene, cellfectina, DOTAP, DOPE, fugene, polietilenglicol, colesterol, polietilenimida (PEI), Jet-polietilenimida, péptidos de penetración celular, péptidos troyanos, péptido TAT, penetratina, oligoarginina, poli-lisina, glicoproteína del virus de la rabia, nanopartículas de oro, dendrímeros, nanotubos de carbono, lípidos catiónicos y/o liposomas.
41. El uso de los compuestos de pARNi según cualquiera de las reivindicaciones 1 a 32 o de las composiciones según cualquiera de las tres reivindicaciones anteriores para la preparación de un medicamento.
42. El uso según la reivindicación anterior para la preparación de un medicamento para el silenciamiento génico.
43. El uso según cualquiera de las dos reivindicaciones anteriores para la preparación de un medicamento para el tratamiento del cáncer, inflamación, colitis, colitis ulcerativa, enfermedad de Crohn y/o artritis reumatoides.
Patentes similares o relacionadas:
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Ratón nuligénico para Pint que muestra un fenotipo asociado a envejecimiento prematuro, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón cuyo genoma comprende una inactivación de un locus del ARN no codificante largo (ARNlnc) Pint endógeno, en donde la inactivación (i) da como resultado que el […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]