NUEVO PROCEDIMIENTO DE SINTESIS Y PURIFICACION DE S-ZOPICLONE CRISTALINO ANHIDRO.
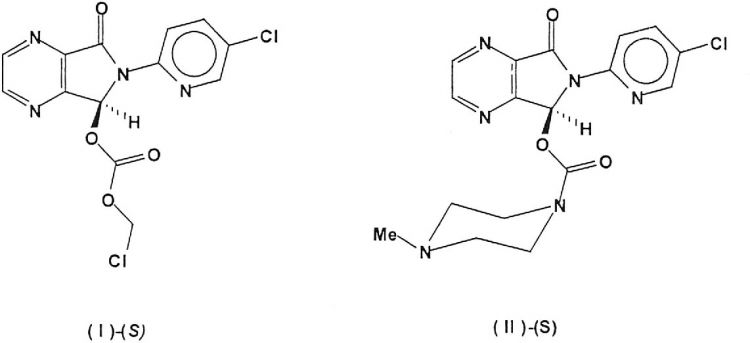
En la presente invención se describe un nuevo procedimiento de síntesis quimioenzimática de 5-(clorometiloxicarboniloxi)-6-(5-cloropirid-2-il)-7-oxo-5,
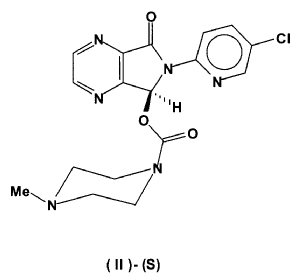
6-dihidropirrolo[3,4b]pirazina (I)-(S)(CAS Number 508169-20-8) y su conversión en (S)-zopiclone (II)-(S)(CAS Number 138729-47-2) que es purificado mediante cromatografía de columna y cristalizado en forma de su polimorfo anhidro cristalino
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702675.
Solicitante: APOTECNIA,S.A.
Nacionalidad solicitante: España.
Provincia: MURCIA.
Inventor/es: BAYOD JASANADA,MIGUEL SANTOS, RIBAS BUENO,CRISTINA.
Fecha de Solicitud: 11 de Octubre de 2007.
Fecha de Publicación: .
Fecha de Concesión: 18 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K31/495 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K31/50 A61K 31/00 […] › Piridazinas; Piridazinas hidrogenadas.
- C07D487/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/495 A61K 31/00 […] › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K31/50 A61K 31/00 […] › Piridazinas; Piridazinas hidrogenadas.
- A61P25/20 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Hipnóticos; Sedantes.
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Nuevo procedimiento de síntesis y purificación de (S)-zopiclone cristalino anhidro.
Campo de la invención
En la presente invención se describe un nuevo procedimiento de síntesis de 5-(clorometiloxicarboniloxi)-6-(5-cloropirid-2-il)-7-oxo-5,6-dihidropirrolo[3,4b]pirazina (I)-(S) (CAS Registry Number 508169-20-8) y su conversión en (S)-zopiclone (II)-(S) (CAS Registry Number 138729-47-2) que es purificado mediante cromatografía de columna y aislado en forma de su polimorfo anhidro cristalino

Breve descripción de las imágenes del documento

Antecedentes de la invención
El zopiclone es una ciclopirrolona con propiedades hipnóticas. La molécula de zopiclone posee un centro quiral. Es un hecho conocido (Chirality, 1993, 5, 419) que el enantiómero dextrógiro (II)-(S) es aproximadamente dos veces más activo que el racémico, mientras que el isómero levógiro es prácticamente inactivo. Además, según la patente EP 609210-B1, el isómero levógiro es el causante de la mayor parte de los efectos adversos asociados a la administración del medicamento.
En la figura 1 se resume el contenido de la patente US 3862149. En ella se describe por primera vez la síntesis de zopiclone racémico (II), por adición de N-metilpiperazina al carbonato de fórmula (IV), obtenido a su vez por reacción del alcohol de fórmula (III) con cloroformiato de fenilo. También se describe la síntesis de zopiclone racémico por reacción entre el alcohol (III) y de 1-clorocarbonil-4-metilpiperazina (V).
En la patente EP 609210-B1 y documentos relacionados, los enantiómeros del zopiclone se pueden separar mediante cristalización fraccionada de las sales diastereoisómeras formadas con un ácido ópticamente activo. Como ácidos ópticamente activos pueden usarse, por ejemplo, los ácidos (+) o ()-málico (Chirality, 1993, 5, 419), o el ácido (+)-O,O'-dibenzoiltartárico. En este documento el (S)-Zopiclone se cristaliza de acetonitrilo, aunque el polimorfo obtenido no se caracteriza desde el punto de vista cristalográfico ni de ensayos termogravimétricos.
Las patentes relacionadas con esta son:

En WO 2007/083188 se describe una tecnología similar, pero utilizando como ácido ópticamente activo uno seleccionado entre algunos como D-láctico, D-tartárico, D-málico, Di-p-tolil-D-tartárico. El producto se aisla mediante evaporación a sequedad de una disolución en cloruro de metileno y posterior lavado con acetona. En ese mismo documento el (S)-zopiclone es preparado por alcalinización de una suspensión acuosa de sal precursora, y posterior cristalización en acetona/anhídrido acético.
En US 2007/0054914 el ácido ópticamente activo usado en la resolución es el ácido Di-p-tolil-D-tartárico. El producto se aisla mediante evaporación a sequedad de una disolución en cloruro de metileno y posterior recristalización en acetonitrilo o suspensión en isopropanol.
En US 2007/0203145 y WO 2007/088073 los ácidos quirales usados son tartárico ó ditoliltartárico.
En ninguna de estas solicitudes de patente, el polimorfo obtenido se caracteriza desde el punto de vista de ensayos termogravimétricos y sólo en WO 2007/083188 se reproduce un difractograma de rayos X de polvo (figura 2 del citado documento) sin listado de picos ni parámetros de celda cristalina.
También se pueden separar los enantiómeros mediante cromatografía sobre fase estacionaria quiral. Ejemplos de esta tecnología los encontramos en Journal of Chromatography, 1991, 572, 195-202, Journal of Chromatography A, 1996, 729, 19-28, Journal of Chromatography, Biomedical Applications, 1993, 617, 271-278; Journal of Pharmaceutical and Biomedical Analysis, 1996, 14, 1367-1370. En WO 2006/136866 se describe un procesos de resolución de zopiclone usando como fase estacionaria Chiralcel ®OD, Chiralpak® OD o Chiralpak® AD.
Otra forma de abordar la preparación de (S)-zopiclone es la resolución enzimática de carbonatos de fórmula (I) preparados a partir del producto ya conocido (III). En la figura 2 se resumen los procedimientos sintéticos de esta metodología.
Como catalizador enzimático se emplean las lipasas de Candida antarctica. Estas enzimas pueden estar libres o inmovilizadas, tanto en preparados comerciales como en otros obtenidos al efecto. Como es sabido, la actividad y estabilidad de las enzimas se puede modificar mediante la inmovilización y otros tratamientos conocidos, lo que se puede aprovechar para mejorar el proceso. Preferentemente se debe emplear una forma de inmovilización que sea compatible con las elevadas concentraciones de codisolvente orgánico necesarias para aumentar la solubilidad del sustrato en el medio. La enzima, que puede estar inmovilizada o no, se encuentra preferentemente en suspensión, lo que facilita su separación por filtración cuando se acaba la reacción.
En Tetrahedron: Asymm., 1997, 8, 995 y en la patente ES 2101653 la enzima cataliza la reacción del vinil carbonato (VI) con una molécula de agua, en diversos disolventes orgánicos anhidros. Una vez que se tiene el carbonato enantiopuro (VI)-(S), éste se transforma en (+)- zopiclona mediante reacción con N-metilpiperazina. El rendimiento de este último paso de la síntesis es algo bajo, lo que unido al alto coste del cloroformiato de vinilo, hace inviable el proceso desde el punto de vista industrial.
En US 6969767, ES2203319, Tetrahedron Asymmetry, 2002, 13, 2577-2582 y Tetrahedron Asymmetry 2003, 14, 429-438 se extienden los casos de la tecnología anterior, y se describen por primera vez los nuevos compuestos de fórmula (I), tanto en forma racémica como en forma enantioméricamente enriquecida, siendo R alquilo, alquenilo, aralquilo, o arilo, opcionalmente ramificados y opcionalmente sustituidos con uno o varios heteroátomos.
La resolución enzimática se lleva a cabo preferentemente en un disolvente orgánico anhidro al que se le añade la cantidad adecuada de agua preferentemente.
Un aspecto inesperado del proceso es que el compuesto (III)-(R) que se forma durante la resolución enzimática se racemiza espontáneamente en las condiciones de trabajo, con lo que, una vez purificado, se puede emplear directamente para producir más carbonato racémico de fórmula (I). De este modo se aprovecha fácilmente toda la materia prima y se reduce la cantidad de material residual, factor muy importante con vistas a la aplicación industrial del procedimiento.
Una vez obtenido el correspondiente carbonato de fórmula (I)-(S) ópticamente enriquecido, se transforma en (S)-Zopiclone de fórmula (II)-(S) por reacción con N-metilpiperazina en un disolvente orgánico inerte, por ejemplo acetonitrilo, tetrahidrofurano, dioxano o acetona, entre otros. El procedimiento es similar al representado en la figura 1.
En Eur. Cryst. Meeting. 1983, 8, 32, Mol. Pharmacol. 1987, 31, 334 y J. Chem. Soc. Perkin Trans 2, 1990, 283 se describen los polimorfos cristalinos conocidos del Zopiclone; un polimorfo dihidrato que racémico, un polimorfo anhidro racémico que cristaliza en el sistema rómbico y un polimorfo anhidro racémico que cristaliza en el sistema monoclínico. En Chem. Commun. 2001, 2204-2205 se muestran también los cristales del polimorfo anhidro rómbico pero enantioméricamente puros, tanto (R) como (S).
Resumen de la invención
La presente invención describe un procedimiento nuevo para la preparación de (S)-5-(clorometiloxicarboniloxi)-6-(5-cloropirid-2-il)-7-oxo-5,6-dihidropirrolo[3,4b]pirazina, compuesto de fórmula (I)-(S), (CAS Registry Number 508169-20-8), intermedio clave en la preparación de (S)-zopiclone. El procedimiento de preparación...
Reivindicaciones:
1. Un procedimiento para obtener (S)-5-(clorometiloxicarboniloxi)-6-(5-cloropirid-2-il)-7-oxo-5,6-dihidropirrolo[3,4b]pirazina enantioméricamente puro (I)-(S) según el siguiente esquema, caracterizado por

2. Un procedimiento según la reivindicación 1 caracterizado porque la mezcla de enantiómeros es la mezcla racémica.
3. Un procedimiento según la reivindicación 1 caracterizado porque la mezcla de enantiómeros está enriquecida en el enantiómero (S).
4. Un procedimiento según la reivindicación 1 caracterizado porque el disolvente orgánico usado es tolueno.
5. Un procedimiento según la reivindicación 1 caracterizado porque la reacción se lleva a cabo entre 25 y 65ºC.
6. Un procedimiento según la reivindicación 1 caracterizado porque la concentración de la reacción está comprendida entre 10 y 20 ml de disolvente por cada gramo de intermedio de partida.
7. Un procedimiento según la reivindicación 1 caracterizado porque la concentración de la reacción preferida es de 14 ml de disolvente por cada gramo de intermedio de partida (I).
8. Un procedimiento según la reivindicación 1 caracterizado porque el alcohol nucleófilo es n-propanol.
9. Un procedimiento según la reivindicación 8 caracterizado porque la proporción de n-propanol usada está comprendida entrel y 2 equivalentes respecto del producto de partida (I).
10. Un procedimiento según la reivindicación 1 caracterizado porque la amina alifática es trietilamina.
11. Un procedimiento según la reivindicación 10 caracterizado porque la proporción de trietilamina usada está comprendida entre 0.5 y 3 equivalentes respecto del producto de partida (I).
12. Un procedimiento según la reivindicación 1 caracterizado porque la reacción es catalizada por una enzima de tipo lipasa.
13. Un procedimiento según la reivindicación 12 caracterizado porque la lipasa es la fracción B de Candida antarctica.
14. Un procedimiento según la reivindicación 12 caracterizado porque la lipasa está inmovilizada sobre una resina macroporosa.
15. Un procedimiento según la reivindicación 14 caracterizado porque la lipasa Novozyme® 435.
16. Un procedimiento según las reivindicaciones 12 a 15 caracterizado porque la proporción de lipasa usada está comprendida entre 0.25 y 1 equivalentes respecto del producto de partida (I).
17. Un procedimiento según las reivindicaciones 12 a 15 caracterizado porque la lipasa se puede reutilizar en una nueva reacción.
18. Un procedimiento según las reivindicaciones 12 a 15 caracterizado porque el producto de alcoholisis (III) y la lipasa se recuperan por filtración.
19. Un procedimiento según la reivindicación 18 caracterizado porque el producto de alcoholisis (III) y la lipasa se separan por filtración selectiva.
20. Un procedimiento según la reivindicación 1 caracterizado porque el disolvente de cristalización del carbonato quiral obtenido (I)-(S) es isopropanol.
21. Un procedimiento para la preparación de (S)-Zopiclone ópticamente puro (II)-(S) caracterizado por hacer reaccionar en un disolvente orgánico, un exceso de N-metilpiperazina con el carbonato ópticamente puro de fórmula (I)-(S), obtenido a su vez según el procedimiento de resolución quimioenzimática descrito en las reivindicaciones 1 a 20.
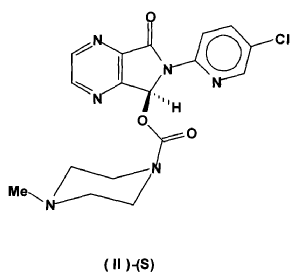
22. Un procedimiento para la preparación de (S)-Zopiclone ópticamente puro según la reivindicación 21 caracterizado porque el disolvente es cloruro de metileno.
23. Un procedimiento para la preparación de (S)-Zopiclone ópticamente puro según la reivindicación 21 caracterizado por eliminar del medio reacción el exceso de N- metilpiperazina antes del aislamiento de (S)-Zopiclone.
24. Un procedimiento de purificación de (S)-Zopiclone mediante cromatografía de columna aquiral.
25. Un procedimiento según la reivindicación 24 dónde la fase estacionaria es sílicagel SiO2 63-200 µm.
26. Un procedimiento según la reivindicación 24 dónde la fase móvil comprende cloruro de metileno, acetato de etilo, acetona y trietilamina o una mezcla de ellos.
27. Un procedimiento según la reivindicación 24 dónde el (S)-zopiclone obtenido presenta un contenido individual de impurezas inferior al 0.1.
28. Un procedimiento según la reivindicación 24 dónde el (S)-zopiclone obtenido presenta un exceso enantiomérico superior al 99.0%.
29. Un procedimiento de cristalización de (S)-Zopiclone cristalino anhidro caracterizado por
30. Un procedimiento según la reivindicación 29 caracterizado porque se obtiene el polimorfo de (S)-Zopiclone que cristaliza en el sistema rómbico con los siguientes valores de celda cristalina

Patentes similares o relacionadas:
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Antagonista del receptor NK1, del 27 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula (I): **(Ver fórmula)** donde W es un átomo de hidrógeno o un átomo de flúor; el anillo A es un […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Composiciones y compuestos terapéuticos, del 6 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un compuesto de Fórmula (I) o una sal del mismo farmacéuticamente aceptable, en donde: **(Ver fórmula)** A es arilo o heteroarilo, en donde el arilo o heteroarilo […]
Combinaciones de inhibidores de histona desacetilasa y fármacos inmunomoduladores, del 29 de Abril de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para su uso en el tratamiento del linfoma que comprende una cantidad terapéuticamente eficaz de un inhibidor específico de histona desacetilasa […]
Composiciones farmacéuticas para terapia de combinación, del 29 de Abril de 2020, de Acesion Pharma ApS: Una combinación de (i) un inhibidor del canal de potasio (SK) activado por calcio de pequeña conductancia, o una sal o solvato farmacéuticamente aceptable de este; […]
Formulaciones farmacéuticas de liberación controlada de nitazoxanida, del 15 de Abril de 2020, de ROMARK LABORATORIES, L.C.: Composición farmacéutica en forma de una forma de dosificación oral sólida que comprende: (a) una primera parte que comprende una primera […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]