Nanopartículas basadas en celulosa para suministro de fármacos.
Un compuesto que comprende una carboximetilcelulosa acetilada (CMC-Ac) unida covalentemente a:
al menos un poli(etilenglicol) (PEG), y al menos un fármaco hidrófobo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2012/000082.
Solicitante: Ontario Institute for Cancer Research.
Nacionalidad solicitante: Canadá.
Dirección: MaRS Centre, South Tower, Suite 500, 101 College Street Toronto, Ontario M5G 1L7 CANADA.
Inventor/es: LI,SHYH-DAR, ERNSTING,MARK JOHN, TANG,WEI-LUN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/337 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos de cuatro eslabones, p. ej. taxol.
- A61K31/4745 A61K 31/00 […] › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61K47/48
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C08B11/12 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › C08B 11/00 Preparación de éteres de celulosa. › sustituidos con radicales carboxílicos.
- C08B13/00 C08B […] › Preparación de éteres-ésteres de celulosa.
- C08B3/06 C08B […] › C08B 3/00 Preparación de ésteres de celulosa de ácidos orgánicos. › acetato de celulosa.
- C08G65/332 C08 […] › C08G COMPUESTOS MACROMOLECULARES OBTENIDOS POR REACCIONES DISTINTAS A AQUELLAS EN LAS QUE INTERVIENEN SOLAMENTE ENLACES INSATURADOS CARBONO - CARBONO (procesos de fermentación o procesos que utilizan enzimas para sintetizar un compuesto dado o una composición dada o para la separación de isómeros ópticos a partir de una mezcla racémica C12P). › C08G 65/00 Compuestos macromoleculares obtenidos por reacciones que forman un enlace éter en la cadena principal de la macromolécula (resinas epoxi C08G 59/00; politioéter-poliéteres C08G 75/12; poliéteres que contienen menos de once unidades monómeras C07C). › que contienen grupos carboxilo, haluros o sus ésteres.
PDF original: ES-2547326_T3.pdf

Fragmento de la descripción:
Nanopartfculas basadas en celulosa para suministro de fármacos Campo de la invención
La presente invención se refiere al campo de las nanopartículas y, más específicamente, a nanopartículas basadas en celulosa para el suministro de fármacos.
Antecedentes de la invención
En el campo del suministro de fármacos controlado, el uso de polímeros para mejorar la solubilidad, farmacoclnétlca (PK), farmacodlnámlca (PD), biodisponibilidad, eficacia, y disminución de la toxicidad sistémica se define ampliamente como terapéutica polimérica1'2 El modelo generalizado de la terapéutica polimérica se atribuye a Ringsdorf3, un modelo que propuso en 1975, en el que se modifica la arquitectura de un polímero mediante solubilizantes, fármacos, y ligandos de fijación de diana a una enfermedad para disolver de forma más eficaz fármacos hidrófobos y suministrarlos de una manera dirigida.
Un fundamento de la terapéutica polimérica se sustenta alrededor de la observación de que las macromoléculas solubles con pesos moleculares (Pm) superiores a 30-40 kDa circulan durante más tiempo en la corriente sanguínea, debido a una reducción de la filtración glomerular y el aclaramiento renal4"6 En 1986, Matsumura y Maeda introdujeron su observación de que la vasculatura de un tumor es altamente permeable, y que se podrían acumular selectivamente polímeros o partículas de Pm mayores en estos tejidos como resultado7 Se descubrió que los vasos sanguíneos incipientes de los tejidos malignos contienen huecos a través de los cuales se pueden extravasar las partículas8'9 y, además, que el drenaje linfático en los tumores está habitualmente ausente: las partículas pueden entrar fácilmente pero no salir del compartimento tumoral10"11. Por lo general, las partículas de tamaño inferior a 150- 400 nm migran eficazmente mediante el efecto de permeabilidad mejorada y retención (EPR), aunque las partículas tienen preferentemente un tamaño menor de 200 nm12 El descubrimiento del efecto EPR proporcionó un impulso considerable para desarrollar la terapéutica polimérica, y en particular dio luaar a la nanomedicina, donde estructuras multimoleculares que comprenden liposomas13"15, micelas poliméricas16"1 , polimerosomas19'21 y dendrímeros22"24 podrían suministrar fármacos de forma eficaz a través de este efecto pasivo de fijación de diana25
Un fundamento importante para el desarrollo de las nanopartículas fue la protección de los fármacos del metabolismo mediante la minimización de la interacción del fármaco con los procesos metabólicos (mejora del perfil PD)26. Sin embargo, en términos de PK, las propias partículas se pueden opsonizar y eliminar en el RES (médula ósea, hígado, y bazo), reduciendo la eficacia de estos sistemas de suministro13,27 Una solución para el problema de la eliminación en el RES fue la pegilación: las cadenas de PEG conjugadas a un polímero o nanopartícula evitan la interacción de las opsoninas con la química subyacente mediante impedimento estérico y reducción de las interacciones hidrofóbicas y electrostáticas, minimizando el reconocimiento y la eliminación de la partícula en el RES28'30. La pegilación se convirtió en un elemento habitual en la terapéutica polimérica y la nanomedicina13,31.
Además de añadir propiedades de ocultación, las partículas se pueden funcionalizar con ligandos de fijación de diana para estimular la internalización celular de las nanopartículas en tejidos específicos que sobreexpresan receptores específicos, tales como folato32, RGD33 y HER23,\ Aunque los investigadores han invertido mucho en estos estudios, se ha conseguido un éxito limitado con la fijación de diana específica en los productos de suministro de fármacos, ya que la acumulación de nanopartículas en los tumores está gobernada principalmente por el efecto EPR35. Se ha documentado que los ligandos de fijación de diana pueden aumentar la eliminación sanguínea de las partículas36'37, y que las partículas internalizadas mediante el reconocimiento de receptor quedan atrapadas en los orgánulos endosoma/lisosoma y el fármaco a menudo se degrada38. Ha tenido más éxito desde el punto de vista práctico la incorporación de agentes de contraste de formación de imágenes en las nanopartículas para permitir la visualización en tiempo real de la distribución de las partículas (y los fármacos) en la fisiología, permitiendo una medida de la distribución sensible no destructiva, y dando lugar al campo de la medicina personalizada y la teranóstica39'40. Por ejemplo, las nanopartículas de óxido de hierro superparamagnético (SPION) se acumularán selectivamente en los tumores mediante el efecto EPR, y proporcionarán contraste MRI41. Se pueden cargar liposomas y micelas poliméricas con compuestos de gadolinio que, al igual que las SPION, proporcionan contraste MRI42. Los polímeros también se pueden marcar con trazadores tales como 111indio para análisis microSPECT43, o con colorantes tales como Cy5.5 para formación de imágenes por fluorescencia44.
Dentro de la clase de las micelas de polímero, se han cargado fármacos hidrófobos tales como paclitaxel (PTX) no covalentemente en el núcleo de polímeros formadores de micelas. A destacar dentro de este campo son las micelas de PEG-PLA (Genexol, en la actualidad en ensayos clínicos en Fase II)45, y NK105, una formulación de PEG-ácido aspártico45 Las formulaciones de micelas Genexol y NK105 PTX mejoran con respecto a la administración de PTX solo, mediante la reducción de la toxicidad de la formulación a través de la eliminación del vehículo de suministro de PTX basado en Cremophor que produce problemas de hipersensibilidad en pacientes humanos. En comparación con Genexol y NK105, Opaxio (también conocido como Xyotax y Polyglumex) es un polímero de ácido poliglutámico conjugado a PTX. Opaxio está en ensayos clínicos en Fase III y, hasta la fecha, representa un candidato prometedor para aprobación. Cuando se examinan los datos de PK para PTX (fármaco libre), NK105 (micela), Genexol (micela),
y Opaxio (conjugado), las semividas fueron 13,3, 10,6, 11,4, y 120 horas respectivamente, para dosis de 210, 150, 300, y 233 mg/m2 1. Los perfiles de PK de las formulaciones de NK105 y Genexol no covalentes fueron casi idénticos que los de PTX libre, mientras que el conjugado de polímero Opaxio fue el único modo mediante el que se pudo mejorar básicamente la PK. Los fármacos hidrófobos tales como PTX y docetaxel (DTX) se repartirán desde las micelas a las proteínas plasmáticas que incluyen albúmina y alfa-1-glicoproteína ácida, reduciendo rápidamente el contenido de fármaco de la nanopartícula46. Por lo tanto, es probable que las mejoras dramáticas en la PK y la eficacia se observen solo en los conjugados de polímero.
En la actualidad, los conjugados de polímero más avanzados (aquellos en ensayos clínicos o aprobados) se formulan alrededor de albúmina (Abraxane), HPMA (hidroxipropil metacrilamida), PEG, ácido poliglutámico, con unos pocos ejemplos más seleccionados1,47. Esta no es una lista larga de composiciones de polímero a pesar de más de 30 años de investigación, y la selección limitada refleja el coste y las complicaciones implicadas en sintetizar e identificar biomateriales biocompatibles. Se puede producir el fracaso de un polímero candidato mediante una amplia diversidad de formas, incluyendo respuesta a cueipo extraño48, toxicidad49, o inestabilidad en el entorno biológico de enzimas hidrolíticas y procesos inflamatorios59. Los enfoques de nanopartículas pueden minimizar estas complicaciones, ya que se pueden diseñar conjugados de polímero que se autoensamblen en estructuras que presentan una química de PEG (u otras entidades de ocultación adecuadas) al entorno biológico, y minimizan el reconocimiento biológico o la interacción con el núcleo del polímero y la carga de fármaco27
Ciertas clases de polisacáridos están aprobados como excipientes para administración de fármacos oral, transcutánea, y parenteral51, pero en lo que se refiere al campo de polímeros sintéticos, se ha realizado un trabajo comparativamente menor con estos polisacáridos biocompatibles en el campo actual de suministro de fármacos con nanopartículas, y la mayor parte del trabajo se centra en materiales basados en quitosano52"55 Cera y colaboradores conjugaron doxorrubicina (DOX) y daunomicina a carboximetilcelulosa (CMC) y ácido hialurónico (HA), e informaron que estos compuestos eran tóxicos por las células in vitro, pero con menor potencia en comparación con el fármaco libre. Además, el grado de sustitución de grupos ácidos de la CMC con la doxorrubicina fue bajo (9 %), y este grupo no continuó con los informes sobre la eficacia in vivo56 Uglea etal. conjugaron benzocaína a CMC y... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto que comprende una carboximetilcelulosa acetilada (CMC-Ac) unida covalentemente a: al menos un poli(etilenglicol) (PEG), y al menos un fármaco hidrófobo.
2. El compuesto de la reivindicación 1, en el que las uniones covalentes son uniones áster.
3. El compuesto de la reivindicación 1 o 2, en el que el al menos un fármaco hidrófobo es un agente anticancerigeno.
4. El compuesto de la reivindicación 3, en el que el agente anticancerigeno es docetaxel, camptotecina o paclitaxel.
5. El compuesto de la reivindicación 3 o 4, en el que el al menos un PEG es poli(etilenglicol) metil éter (mPEG) que tiene un Mn promedio entre aproximadamente 550 y aproximadamente 10.000, preferentemente aproximadamente 2000, opcionalmente en el que la CMC consiste entre aproximadamente 95 y 3600 unidades de monómero, preferentemente aproximadamente 3500 unidades de monómero, opcionalmente además en el que la proporción molar de (grupos acetilo de CMC-Ac):(grupos ácido carboxilico de CMC-Ac/PEG/fármaco hidrófobo) está entre aproximadamente 2,5:0,5 - 1,8:1,2, preferentemente aproximadamente 2,18:0,82, opcionalmente además en el que el mPEG está presente en una cantidad de aproximadamente 3,5-22,7 % en peso, y el docetaxel está presente en una cantidad de aproximadamente 22,5-43,3 % en peso, preferentemente en el que el mPEG está presente en una cantidad de aproximadamente 4,7-5,3 % en peso, y el docetaxel está presente en una cantidad de aproximadamente 30,1-39,5 % en peso, más preferentemente en el que el mPEG está presente en una cantidad de 4,7 % en peso, y el docetaxel está presente en una cantidad de 36,9 % en peso.
6. El compuesto de la reivindicación 5, en el que la proporción molar de mPEG:docetaxel:(grupos ácido carboxilico de CMC-Ac) es de aproximadamente 0,9:13,4:85,7 a aproximadamente 5,4:26,4:68,2, según se estima mediante análisis por RMN 1H, preferentemente, en el que la proporción molar de mPEG:docetaxel:(grupos ácido carboxilico de CMC-Ac) es aproximadamente de 1:15,1:83,6 a 1,1:23,7:75,3, y más preferentemente 1:20,1:78,5.
7. El compuesto de una cualquiera de las reivindicaciones 1-6, en el que la CMC-Ac está unida covalentemente además al menos a un agente de formación de imágenes, preferentemente Cy5.5.
8. Composición de nanopartículas de autoensamblado que comprende el compuesto de una cualquiera de las reivindicaciones 1-7.
9. La composición de nanopartículas de autoensamblado de la reivindicación 8, en la que la composición tiene una concentración micelar crítica (eme) de aproximadamente 0,1 mg/ml.
10. La composición de nanopartículas de autoensamblado de la reivindicación 8 o 9, en la que las nanopartículas tienen un diámetro medio de aproximadamente 49-278 nm y/o con un intervalo de 16 - 396 nm.
11. La composición de nanopartículas de autoensamblado de una cualquiera de las reivindicaciones 8-10, que comprende además al menos un agente hidrófobo encapsulado en la misma, seleccionado preferentemente entre un agente de formación de imágenes o un agente terapéutico, preferentemente en la que el al menos un agente de formación de imágenes es una nanopartícula de óxido de hierro superparamagnético (SPION), preferentemente entre 7-30 % en peso de SPION, y más preferentemente aproximadamente 30 % en peso de SPION.
12. Composición farmacéutica que comprende la composición de nanopartículas de autoensamblado de una cualquiera de las reivindicaciones 8-11 y un vehículo y/o diluyente farmacéuticamente aceptable.
13. Proceso para preparar una composición de nanopartículas de autoensamblado que comprende:
a) unir covalentemente al menos un PEG y al menos un fármaco hidrófobo a una CMC-Ac;
b) aislar el producto de la etapa (a);
c) disolver el producto aislado de la etapa (b) en un disolvente orgánico adecuado, preferentemente DMF o DMSO y más preferentemente THF o acetonitrilo, para formar una solución;
d) añadir la solución de la etapa (c) gota a gota a una solución acuosa en condiciones adecuadas para formar la composición de nanopartículas de autoensamblado.
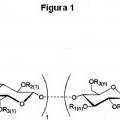
14. Un compuesto de la reivindicación 1, representado por la fórmula:
R<
**(Ver fórmula)** **(Ver fórmula)**p3(n)l y Rf¡n se seleccionan cada uno independientemente entre:
O
**(Ver fórmula)**en la que -
**(Ver fórmula)**un grupo hidroxilo; o
O
/>sA
O(PEG);
y
n es un número entero > 94;
preferentemente en el que el fármaco hidrófobo es uno de docetaxel, camptoteclna y paclitaxel; y 10 preferentemente en la que el PEG es m(PEG).
15. El compuesto de la reivindicación 14, en el que la proporción de (a):(b+c+d) es aproximadamente 2,18 : 0,82.
16. El compuesto de la reivindicación 15, en el que n es entre aproximadamente 95 y 3600 unidades de monómero, preferentemente aproximadamente 3500.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Régimen de terapia y métodos para sensibilizar células de cáncer tratadas con una terapia epigenética frente a inhibidores de PARP en múltiples cánceres, del 22 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una combinación que comprende un agente desmetilante del ADN y un inhibidor de poli ADP ribosa polimerasa (PARP) para su uso en el tratamiento del cáncer, en […]