NANOCOMPOSICIONES SACARÍDICAS PARA LA LIBERACIÓN DE VACUNAS.
Nanocomposiciones sacarídicas para la liberación de vacunas. La presente invención se refiere a un sistema para la administración de antígenos,
que comprende un sistema de nanocápsulas de un tamaño medio inferior a 1 micrómetro, que comprenden a su vez: a) poli-D-glucosamina; b) al menos un aceite adyuvante seleccionado de entre el grupo constituido por isoprenoides, terpenoides y terpenos; c) al menos un tensioactivo, preferiblemente de tipo aniónico o de tipo no iónico; d) al menos un antígeno, preferiblemente de tipo viral; y opcionalmente e) una molécula bioactiva con propiedades inmunoestimulantes o inmunomoduladoras; caracterizadas porque presentan una estructura característica tipo reservorio donde los componentes lipídicos forman un núcleo oleoso que se encuentra recubierto por al menos un polisacárido catiónico. Adicionalmente, la invención se refiere a composiciones farmacéuticas que comprenden dicho sistema de nanocápsulas así como a procedimientos para su preparación y usos del mismo.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201131074.
Solicitante: UNIVERSIDADE DE SANTIAGO DE COMPOSTELA.
Nacionalidad solicitante: España.
Inventor/es: ALONSO FERNANDEZ,MARIA JOSE, SANCHEZ BARREIRO,ALEJANDRO, VICENTE OZORES,Sara.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K47/48
- A61K9/51 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Nanocápsulas.
- B82Y5/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano- biotecnología o nano-medicina, p. ej. ingeniería de proteínas o administración de fármaco.
- C08B37/08 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › C08B 37/00 Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21). › Quitina; Sulfato de condroitín; Acido hialurónico; Sus derivados.
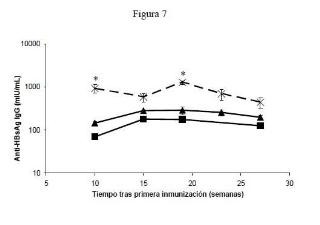
Fragmento de la descripción:
Nanocomposiciones sacarídicas para la liberación de vacunas.
Campo técnico
La presente invención se refiere al desarrollo de formulaciones basadas en el diseño de vehículos nanométricos, capaces de inducir o potenciar una repuesta inmunológica frente a un antígeno asociado. Más en concreto, se refiere a nanosistemas de aplicación en el campo de las enfermedades infecciosas. Adicionalmente, la invención se refiere a las composiciones farmacéuticas que los comprenden, así como a procedimientos para su preparación.
Antecedentes
Las vacunas se componen tradicionalmente de microorganismos atenuados o muertos que son capaces de generar protección inmunológica frente a la enfermedad que causan una vez inoculados al organismo. El éxito de este tipo de vacunas reside en que el organismo reconoce dicho patógeno y comienza una respuesta inmunitaria frente al mismo, así como la generación de memoria inmunológica, lo que permite desencadenar una respuesta inmediata cuando el microorganismo patógeno entra en el organismo. Sin embargo, la utilización de este tipo de vacunas puede ir acompañada de cierta problemática relacionada principalmente con (i) la posible reactivación del agente infeccioso como consecuencia de mutaciones en el genoma, (ii) la presencia de agentes tóxicos que pueden acompañar al patógeno como son los lipopolisacáridos (LPS), o (iii) la pérdida de potencia debido a deficiencias en el transporte y almacenamiento en las condiciones de refrigeración requeridas (Plotkin SA. Vaccines: past, present and future. Nat Med 2005;11(4 (suppl)):S5-11).
Para solventar algunos de estos problemas, en los últimos años se han obtenido antígenos subunidad formados por las partes mejor conservadas de los patógenos, o plásmidos ADN codificadores de estos antígenos, para que el organismo pueda reconocerlos como invasores una vez administrados, y que presentan un mejor perfil de seguridad al evitar la inoculación del microorganismo entero. Sin embargo, este aumento en la seguridad de la vacuna suele conllevar una disminución en la inmunogenicidad de la misma, lo que da lugar a una menor potencia de la respuesta inmune generada. Por esta razón, tanto los antígenos subunidad como las vacunas ADN requieren (i) una dosificación múltiple con dosis de recuerdo para asegurar la protección inmunológica, así como (ii) el apoyo de algún tipo de agente adyuvante, de forma que ayude a la inducción y potenciación de la respuesta inmunitaria frente al antígeno/material genético administrado, y por tanto, frente al propio patógeno.
Actualmente, sólo las sales insolubles de aluminio (álum) están aprobadas por las agencias regulatorias de todo el mundo, y las únicas por la FDA (US Food and Drug Administration), para su uso en humanos con este fin. Sin embargo, se han identificado múltiples inconvenientes relacionados con este adyuvante, tales como:
- aparición de síntomas locales tras la inyección como hinchazón, eritemas o nódulos cutáneos (Lindbald EB. Aluminium adjuvants - in retrospect and prospect. Vaccine 2004;22:3658-3668),
- pérdida de potencia por congelación accidental (Zapata MI, Peck GE, Hem SL, White JL, Feldkamp JR. Mechanism of freeze-thaw instability of aluminum hydroxycarbonate and magnesium hydroxide gels. J Pharm Sci 1984;73:3-9),
- inducción de una respuesta inmune únicamente de tipo humoral, lo que lo hace menos adecuado para aquellos microorganismos que requieran una respuesta celular para ser eliminados del organismo (Brewer JM. (How) do alumiun adjuvants work? Immunol Lett 2006;102:10-15),
- aparición de reacciones alérgicas (Brewer JM. (How) do alumiun adjuvants work? Immunol Lett 2006;102:10-15),
- necesidad de administrarlo por vía parenteral y en varias dosis para generar protección.
Por lo tanto, se hace necesario el desarrollo de nuevos sistemas que sean menos tóxicos, más tolerables por el paciente, que permitan la potenciación y modulación de las respuestas inmunes frente a una amplia variedad de microorganismos patógenos, así como una reducción en el número de dosis necesaria para alcanzar protección frente a enfermedades infecciosas.
Nuevos sistemas basados en lípidos y tensioactivos (emulsiones) han sido introducidos recientemente en el mercado europeo formando parte de vacunas frente a la gripe pandémica: MF59TM, AS03TM y la AF03TM, desarrollados respectivamente por las empresas farmacéuticas Novartis, GlaxoSmithKline (GSK) y Sanofi Pasteur (EMEA - pandemic influenza vaccines: http://tinyurl.com/5vw5yyn):
• MF59TM (Novartis): Aflunov® (H5N1), Focetricia® (H1N1), Foclivia® (H5N1)
• AS03TM (GSK): Prepandrix® (H5N1)
• AF03 TM (Sanofi Pasteur): Humenza® (H1N1).
Dichas composiciones basadas en emulsiones se han aprobado como vehículos adyuvantes de virus inactivados provenientes de diversas cepas de influenza relacionadas con el brote pandémico. Su aplicación como vehículos adyuvantes de antígenos subunidad no ha sido aprobada por las agencias regulatorias, aunque se encuentra recogida en numerosos documentos (por ejemplo: US2009191226 (A2), US2009304742 (A1), WO 2010125461 (A1), US 2005136073 (A1), WO 2007006939 (A3), WO 0168129 (A2)). Las emulsiones adyuvantes descritas en dichos documentos presentan una composición común consistente en una fase oleosa compuesta por escualeno y una mezcla de distintos tensioactivos no iónicos que le confieren estabilidad al sistema. Dichas emulsiones pueden incluir además agentes antioxidantes como el α-tocoferol (por ejemplo: WO 2006100110 (A1), WO 2009127676, WO 2009127677, US 2010183667 (A1)) u otras moléculas inmunomoduladoras como el CpG (por ejemplo: EP 1572124 (A4)), muramil dipéptidos (por ejemplo: US2003147898 (A1), EP0315153 (A2)), monofosforil lípido A (por ejemplo: WO 9956776 (A2), EP1951298 (A1)) ó también éste último combinado con QS21 (por ejemplo: US 2007196394 (A1), WO 9517210 (A1)).
También se han descrito composiciones constituidas de un núcleo oleoso rodeado de una cubierta polimérica, llamados sistemas nanocapsulares, entre los que cabe mencionar una composición de nanocápsulas polisacarídicas (EP1834635 A1). Este sistema emplea en el núcleo oleoso aceites compuestos por ácidos grasos y sus derivados (ésteres ó amidas) y además requiere la presencia de un compuesto polioxialquilenado para estabilizar el sistema.
Breve descripción de la invención
La presente invención proporciona un sistema al cual es posible asociar antígenos subunidad de forma eficaz que presenta ventajas especialmente relevantes en el campo de las vacunas: está compuesto de materiales considerados biocompatibles y asimilables por el organismo, y permite alcanzar niveles de protección en animales comparables a los que resultan protectores en humanos frente a enfermedades infecciosas, empleando un número de dosis de antígeno más reducido que en el caso de las vacunas que se comercializan actualmente.
Así, en un primer aspecto, la invención se dirige a un sistema para la administración de antígenos que comprende nanocápsulas con un tamaño medio inferior a 1 micrómetro, que comprenden:
caracterizadas por presentar una estructura tipo reservorio, donde el núcleo está compuesto por componentes lipídicos y está recubierto por poli-D-glucosamina.
En otro aspecto, la invención se refiere a un sistema como se ha definido anteriormente que se encuentra en forma liofilizada.
En otro aspecto, la invención se refiere a una vacuna que comprende un sistema como se ha definido anteriormente.
En otro aspecto, la invención se refiere a una composición farmacéutica que comprende un sistema como se ha definido anteriormente.
En otro aspecto, la invención hace referencia a una composición farmacéutica que comprende un sistema como se ha definido anteriormente para su uso en la prevención de enfermedades infecciosas.
En un aspecto adicional, la invención se dirige a un procedimiento para la preparación de un sistema como se ha definido anteriormente que comprende:
Reivindicaciones:
1. Un sistema para la administración de antígenos que comprende nanocápsulas con un tamaño medio inferior a 1 micrómetro, que comprenden:
caracterizadas por presentar una estructura tipo reservorio, donde el núcleo está compuesto por componentes lipídicos y está recubierto por poli-D-glucosamina.
2. Sistema según la reivindicación 1, donde el aceite adyuvante se selecciona de entre el grupo consistente en vitamina A, vitamina E, escualeno y escualano.
3. Sistema según la reivindicación 2, donde el aceite adyuvante es escualeno.
4. Sistema según la reivindicación 1, donde el agente tensioactivo se selecciona entre tensioactivos de tipo aniónico y de tipo no iónico.
5. Sistema según la reivindicación 4, donde el agente tensioactivo es de tipo aniónico.
6. Sistema según la reivindicación 5, donde el agente tensiosactivo aniónico es un fosfolípido.
7. Sistema según la reivindicación 1 donde el antígeno es de origen viral.
8. Sistema según reivindicación 7, donde el antígeno de origen viral se selecciona de entre el grupo consistente en antígenos subunidad característicos de virus de la hepatitis A, B, C ó E, virus del papiloma humano, virus de inmunodeficiencia humana tipo 1, virus de la influenza, citomegalovirus, virus del herpes simple, SARS coronavirus, rotavirus, virus sincicial respiratorio, virus de parainfluenza, virus de las paperas, virus del sarampión, virus de la encefalitis japonesa, virus de la rubeola, virus de Epstein-Barr, virus del dengue, virus de la varicela Zoster.
9. Sistema según reivindicación 8, donde el antígeno es un antígeno subunidad característico del virus de la hepatitis B.
10. Sistema según las reivindicaciones anteriores, que adicionalmente comprende una molécula bioactiva con propiedades inmunoestimulantes o inmunomoduladoras.
11. Sistema según reivindicación 10, donde la molécula bioactiva con propiedades inmunoestimulantes o inmunomoduladoras es de carácter hidrofóbico.
12. Sistema según cualquiera de las reivindicaciones anteriores, donde las nanocápsulas se encuentran en forma liofilizada.
13. Vacuna que comprende un sistema como se ha definido en cualquiera de las reivindicaciones 1 a 12.
14. Composición farmacéutica que comprende un sistema como se ha definido en cualquiera de las reivindicaciones 1 a 12.
15. Composición farmacéutica, según la reivindicación 14, para su uso en la prevención de enfermedades infecciosas.
16. Un procedimiento para la preparación de un sistema como se define en cualquiera de las reivindicaciones 1 a 12, que comprende:
17. Un procedimiento para la preparación de un sistema como se define en cualquiera de las reivindicaciones 1 a 12 que comprende:
18. Procedimiento según cualquiera de las reivindicaciones 16 y 17, que comprende además la adición de una molécula bioactiva con propiedades inmunoestimulantes ó inmunomoduladoras y/o un compuesto capaz de facilitar el seguimiento de las nanocápsulas tras su aplicación a un ser vivo, ambos de carácter hidrofóbico, en la solución orgánica b).
19. Procedimiento según cualquiera de las reivindicaciones 16 y 17, que comprende además la adición de una molécula bioactiva con propiedades inmunoestimulantes ó inmunomoduladoras de carácter hidrofílico sobre la superficie de las nanocápsulas una vez formadas.
20. Uso de un sistema como se define en cualquiera de las reivindicaciones 1 a 12 en la preparación de una vacuna.
21. Uso, según la reivindicación 20, para la preparación de una vacuna para la prevención de enfermedades infecciosas.
22. Uso, según la reivindicación 21, para la prevención de enfermedades infecciosas causadas por agentes víricos.
23. Uso, según reivindicación 22, para la prevención de enfermedades infecciosas víricas seleccionadas de entre el grupo consistente en hepatitis A, B, C y E, cáncer cervical causado por el virus del papiloma humano, síndrome de inmunodeficiencia adquirida (SIDA), gripe estacional, gripe pandémica, mononucleosis infecciosas por citomegalovirus ó por virus de Epstein-Barr, infección por herpes simple, gastroenteritis por rotavirus, síndrome respiratorio agudo severo (SARS), parainfluenza, neumonía por virus sincicial respiratorio, encefalitis japonesa, dengue, rubeola, paperas, sarampión y varicela Zoster.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]