Moléculas de unión.
Un método de producción de un domino de unión VH específico a un antígeno soluble,
que permanece en solución y es activo en un medio fisiológico que comprende:
(a) inyectar un antígeno en un ratón transgénico que expresa un locus heterólogo de cadena pesada vH en el que:
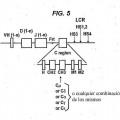
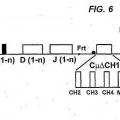
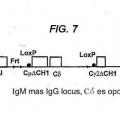
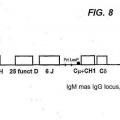
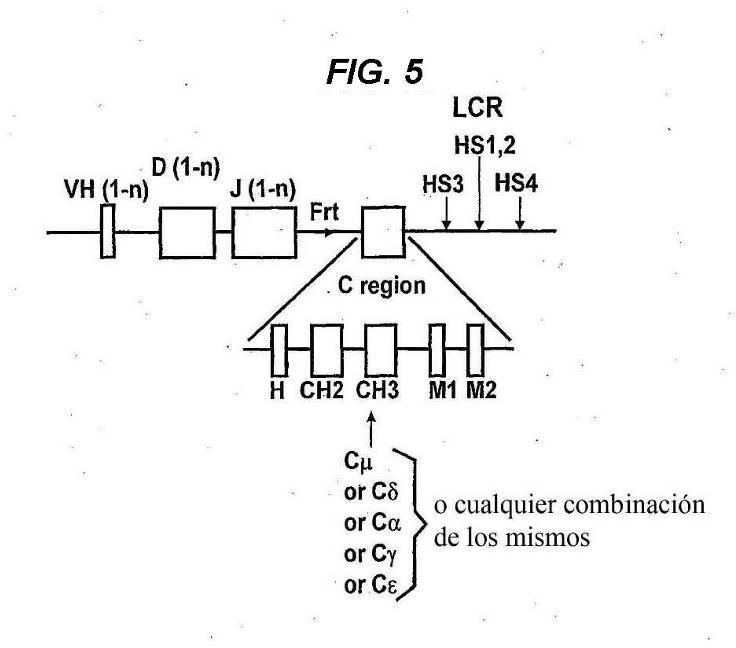
(i) el locus de cadena pesada VH comprende una región variable que comprende al menos un segmento génico VH de origen natural, al menos un segmento génico D, al menos un segmento génico J y al menos una región constante de cadena pesada, y en la que los segmentos génicos V, D y J derivan de un ser humano;
(ii) cada región constante no se codifica a un dominio CH1 funcional;
(iii) un segmento génico V, un segmento génico D y un segmento génico J son capaces de 15 recombinarse para formar una secuencia de codificación VDJ;
(iv) el locus recombinado de cadena pesada VH, cuando se expresa, es capaz de formar un anticuerpo únicamente de cadena pesada soluble que comprende un dominio de unión VH específico a un antígeno soluble y una región efectora constante desprovista de un dominio CH1 funcional;
y:
(b1) aislar una célula o tejido que expresa un anticuerpo únicamente de cadena pesada específico de un antígeno de interés;
(c1) producir un hibridoma a partir de la célula o tejido de la etapa (b1);
(d1) identificar y aislar un dominio VH específico de un antígeno de ARNm clonado de la etapa (c1); o:
(b2) aislar una célula o tejido que expresa un anticuerpo únicamente de cadena pesada específico de un anticuerpo de interés;
(c2) clonar la secuencia que codifica el (los) dominio (s) VH a partir del ARNm derivado de la célula o del tejido aislado;
(d2) mostrar la proteína codificadora utilizando un biblioteca de fago o similar;
(e2) identificar el (los) dominio (s) específico (s) VH de un antígeno; y
(f2) expresar el (los) dominio (s) VH solo o en forma de una proteína de fusión en sistemas de expresión bacterianos, de levadura o alternativos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/002892.
Solicitante: ERASMUS UNIVERSITY MEDICAL CENTER ROTTERDAM.
Nacionalidad solicitante: Países Bajos.
Dirección: Department of Cell Biology and Genetics, P.O.Box 1738 3000 DR Rotterdam PAISES BAJOS.
Inventor/es: CRAIG,ROGER KINGDON, GROSVELD,FRANKLIN G, JANSSENS,RICHARD W, DRABEK,DUBRAVKAERASMUS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N5/10 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
PDF original: ES-2523661_T3.pdf
Fragmento de la descripción:
Campo de la invención
[1] La presente invención se refiere a un método de producción de dominios de unión Vh en ratones transgénicos.
Antecedentes a la invención
[2] Los anticuerpos monoclonales o variantes de los mismos representarán una alta proporción de nuevas medicinas lanzadas en el siglo XXL La terapia con anticuerpos monoclonales ya se ha aceptado como una vía preferida para el tratamiento de artritis reumatoide y enfermedad de Crohn y hay un impresionante progreso en el tratamiento de cáncer. Los productos basados en anticuerpos también están en desarrollo para el tratamiento de enfermedades cardiovasculares e infecciosas. La mayoría de los productos de anticuerpos monoclonales comercializados reconocen y se unen a un único epitope bien definido sobre el ligando diana (por ejemplo, TNFa). La fabricación de anticuerpos monoclonales humanos para terapia sigue dependiendo del cultivo celular de mamífero. El ensamblaje de un complejo que consiste en dos cadenas pesadas y dos cadenas ligeras (el complejo H2L2) y posteriores procedimientos de glucosilación postraduccional excluye el uso de sistemas bacterianos. Los costes de producción y los costes de capital para la fabricación de anticuerpos por cultivo celular de mamífero son altos y amenazan con limitar el potencial de las terapias basadas en anticuerpos en ausencia de alternativas aceptables. Una variedad de organismos transgénicos pueden expresar anticuerpos completamente funcionales. Éstos incluyen plantas, insectos, pollos, cabras y ganado vacuno, pero ninguno se ha usado hasta ahora para fabricar productos terapéuticos comercializados.
[3] Los fragmentos de anticuerpos funcionales pueden fabricarse en E. coli, pero el producto tiene generalmente baja estabilidad en suero, a menos que se PEGile durante el procedimiento de fabricación.
[4] Los complejos de anticuerpo biespecífico son moléculas basadas en Ig manipuladas que pueden unir dos epítopes diferentes sobre tanto el mismo antígeno como sobre antígenos diferentes. Las proteínas de unión biespecíficas que incorporan anticuerpos solos o en combinación con otros ligantes son prometedoras para las modalidades de tratamiento en las que funciones inmunes humanas capturadas provocan un efecto terapéutico, por ejemplo, la eliminación de patógenos (Van Spriel y col., (1999) J. Infect. Diseases, 179, 661-669; Tacken y col., (24) J. Immunol., 172, 4934-494; documento US 5.487.89), el tratamiento de cáncer (Glennie y van derWinkel, (23) Drug Discovery Today, 8, 53-51); e inmunoterapia (Van Spriel y col., (2) Immunol. Today, 21, 391-397; Segal y col., (21) J. Immunol. Methods, 248, 1-6; Lyden y col., (21) Nat. Med., 7, 1194-121).
[5] Los asuntos de fabricación se agravan cuando un producto de anticuerpo biespecífico se basa en dos o más complejos de H2L2. Por ejemplo, la co-expresión de dos o más conjuntos de genes de la cadena pesada y ligera puede producir la formación de hasta 1 combinaciones diferentes, solo una de las cuales es el heterodímero deseado (Suresh y col., (1986) Methods Enzymol., 121,21-228).
[6] Para tratar este asunto se han desarrollado varias estrategias para la producción en células de mamífero de formatos de IgG biespecíficas de longitud completa (BsigG) que retienen la función efectora de la cadena pesada. Las BsigG requieren cadenas pesadas de "botón y ojal" manipuladas para prevenir la formación de heterodímeros y utilizar cadenas L idénticas para prevenir el apareamiento erróneo de cadenas L (Cárter, (21) J. Immunol. Methods, 248, 7-15). También se han descrito estrategias de reticulación química alternativas para la producción de complejos de fragmentos de anticuerpos que reconocen cada uno diferentes antígenos (Ferguson y col., (1995) Arthritis and Rheumatism, 38, 19-2) o la reticulación de otras proteínas de unión, por ejemplo, colectinas, a fragmentos de anticuerpos (Tacken y col., (24) J. Immunol., 172, 4934-494).
[7] El desarrollo de diacuerpos o minianticuerpos (BsAb) que generalmente carecen de funciones efectoras de la cadena pesada también supera la redundancia de heterodímeros. Éstos comprenden anticuerpos monocatenarios mínimos que incorporan sitios de unión Vh y Vl (scFv) que posteriormente se pliegan y dimerizan para formar un anticuerpo biespecífico divalente monovalente para cada uno de sus antígenos diana (Holliger y col., (1993) PNAS, 9, 6444-6448; Mullery col., (1998) FEBS Lett., 422, 259-264). En un caso, los dominios constantes CH1 y L se han usado como dominios de heterodimerización para la formación de mini-anticuerpos bi-específicos (Mullery col., (1998) FEBS Lett., 259-264). Se ha desarrollado una variedad de procedimientos recombinantes basados en sistemas de expresión en E. coli para la producción de BsAb (Hudson, (1999) Curr. Opin. Immunol., 11, 548-557), aunque parecería que el coste y escala de producción del material de anticuerpo multivalente de calidad clínica sigue siendo el impedimento primario para el desarrollo clínico (Segal y col., (21) J. Immunol. Methods, 248, 1-6).
[8] Recientemente, el concepto de BsAb se ha extendido para englobar di-diacuerpos, anticuerpos ¡específicos tetravalentes en los que los dominios Vh y Vl en cada cadena H y L se han sustituido por pares manipulados de dominios de unión scFv. Tales construcciones, aunque son complejas de manipular, pueden ensamblarse en células de mamífero en cultivo en ausencia de redundancia de hetero-dímeros (Lu y col., (23) J. Immunol. Methods, 279, 219-232).
[9] La estructura de inmunoglobulinas es muy conocida en la técnica. La mayoría de las ¡nmunoglobulinas naturales comprenden dos cadenas pesadas y dos cadenas ligeras. Las cadenas pesadas se unen entre sí mediante enlaces disulfuro entre dominios bisagra localizados aproximadamente a mitad de camino a lo largo de cada cadena pesada. Una cadena ligera está asociada a cada cadena pesada en el lado del extremo N del dominio bisagra. Cada cadena ligera está normalmente unida a su cadena pesada respectiva por un enlace disulfuro próximo al dominio bisagra.
[1] Cuando una molécula de Ig está correctamente plegada, cada cadena se pliega en varios dominios globulares distintos unidos por una secuencia de polipéptidos más lineal. Por ejemplo, la cadena ligera se pliega en un dominio variable (VL) y uno constante (CL). Las cadenas pesadas tienen un único dominio variable VH, adyacente al dominio variable de la cadena ligera, un primer dominio constante, un dominio bisagra y dos o tres dominios constantes adicionales. La interacción de los dominios variables de la cadena pesada (Vh) y ligera (VL) produce la formación de una región de unión a antígeno (Fv). Generalmente, se requieren tanto VH como Vl para la unión a antígeno, aunque se ha mostrado que dímeros de cadenas pesadas y fragmentos del extremo amino retienen actividad en ausencia de cadena ligera (Jaton y col., (1968) Biochemistry, 7, 4185-4195).
[11] Con la aparición de nuevas técnicas de biología molecular, la presencia de anticuerpo solo de cadena pesada (que carece de cadena ligera) se identificó en trastornos proliferativos de linfocitos B en el hombre (enfermedad de la cadena pesada) y en sistemas de modelo murino. El análisis de la enfermedad de la cadena pesada al nivel molecular mostró que las mutaciones y deleciones al nivel del genoma podrían producir expresión inapropiada del dominio CH1 de la cadena pesada, dando lugar a la expresión de anticuerpo solo de cadena pesada que carece de la capacidad para unir cadena ligera (véanse Hendershot y col., (1987) J. Cell Biol., 14, 761-767; Brandt y col., (1984) Mol. Cell. Biol., 4, 127-1277).
[12] Estudios separados sobre dominios VH humanos aislados derivados de bibliotecas de fagos demostraron unión específica a antígeno de dominios VH, pero estos dominios Vh demostraron ser de baja solubilidad. Además, se sugirió que la selección de dominios VH humanos con características de unión específica expresados sobre matrices de fago podrían formar los bloques constitutivos para anticuerpos manipulados (Ward y col., (1989) Nature, 341, 544-546).
[13] Estudios usando otras especies de vertebrados han mostrado que los camélidos, como resultado de mutaciones de genes naturales, producen dímeros de solo cadena pesada de lgG2 y lgG3 funcionales que no pueden unirse a cadena ligera debido a la ausencia de la región de unión a cadena ligera Ch1 (Hamers-Casterman y col., (1993) Nature, 363, 446-448) y que especies tales como tiburón producen una familia de proteína de unión similar a solo cadena pesada, probablemente relacionada con el receptor de linfocitos T de mamífero o cadena ligera de la inmunoglobulina (Stanfield y col., (24) Science, 35, 177-1773).
[14] Un rasgo caracterizador del anticuerpo solo de cadena... [Seguir leyendo]
Reivindicaciones:
1. Un método de producción de un domino de unión Vh específico a un antígeno soluble, que permanece en solución y es activo en un medio fisiológico que comprende:
(a) inyectar un antígeno en un ratón transgénico que expresa un locus heterólogo de cadena pesada Vh en el que:
(i) el locus de cadena pesada Vh comprende una región variable que comprende al menos un segmento génico VH de origen natural, al menos un segmento génico D, al menos un segmento génico J y al menos una región constante de cadena pesada, y en la que los segmentos génicos V, D y J derivan de un ser humano;
(ii) cada reglón constante no se codifica a un dominio Ch1 funcional;
(i¡¡) un segmento génico V, un segmento génico D y un segmento génico J son capaces de recombinarse para formar una secuencia de codificación VDJ;
(iv) el locus recombinado de cadena pesada Vh, cuando se expresa, es capaz de formar un anticuerpo únicamente de cadena pesada soluble que comprende un dominio de unión Vh específico a un antígeno soluble y una reglón efectora constante desprovista de un dominio Ch1 funcional;
y:
(b1) aislar una célula o tejido que expresa un anticuerpo únicamente de cadena pesada específico de un antígeno de Interés;
(c1) producir un hibridoma a partir de la célula o tejido de la etapa (b1);
(d 1) Identificar y aislar un dominio VH específico de un antígeno de ARNm clonado de la etapa (c1);
o:
(b2) aislar una célula o tejido que expresa un anticuerpo únicamente de cadena pesada específico de un anticuerpo de interés;
(c2) clonar la secuencia que codifica el (los) dominio (s) Vh a partir del ARNm derivado de la célula o del tejido aislado;
(d2) mostrar la proteína codificadora utilizando un biblioteca de fago o similar;
(e2) Identificar el (los) dominio (s) específico (s) Vh de un antígeno; y
(f2) expresar el (los) dominio (s) Vh solo o en forma de una proteína de fusión en sistemas de expresión bacterianos, de levadura o alternativos.
2. El método de la reivindicación 1, en el que el sistema de expresión en la etapa (f2) es un sistema de expresión de mamíferos.
3. El método de las reivindicaciones 1 o 2, en el que dicho ratón transgénico se ha modificado para tener una capacidad reducida para producir anticuerpos endógenos que incluyen cadenas ligeras.
4. El método de cualquiera de las reivindicaciones 1 a 3, en el que los loci endógenos de cadena pesada de inmunoglobulina en el ratón se eliminan o se silencian.
5. El método de cualquiera de las reivindicaciones anteriores, en el que el locus de cadena pesada Vh comprende más de un segmento génico V, más de un segmento génico D y más de un segmento génico J.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]