Compuestos como moduladores de una proteína CFTR mutante y su uso para el tratamiento de enfermedades asociadas con el mal funcionamiento de la proteína CFTR.
Un compuesto de fórmula general (I):**Fórmula**
sus tautómeros,
los isómeros geométricos E y Z, las formas ópticamente activas, tales como enantiómeros, diastereómeros y sus formas racemato o una mezcla de formas estereoisoméricas o sus sales farmacéuticamente aceptables de los mismos o complejos de los mismos; en la que Z1 se selecciona independientemente del grupo que consiste en:
-CnH(2n)-, que está ramificado o no ramificado en el que n es un número entero de 1 a 5; -CnH(2n-2)- en E o Z conformación geométrica que está ramificada o no ramificada en la que n es un número entero de 2 a 5; -CnH(2n- 4)- que está ramificada o no ramificada en la que n es un número entero de 2 a 5; -CR'H-, -C2H3R'-, E o Z -C2HR'- , -C3H5R'-, E or Z -C3H3R'-,-OCH2-, -CH2O-, NR"CH2-,-CH2NR"-; en los que R' se selecciona independientemente del grupo que consiste en: -H, halógeno, -NH2, -OH, -CN, CF3, -CHF2, -CH2F, -SH, - SCN, -CH3, -C2H5; en el que R" se selecciona independientemente del grupo que consiste en: -H, -CH3, -C2H5; en el que R1 y R2 se seleccionan independientemente del grupo que consiste en anillo aromático o anillo heteroaromático,
como un modulador de una proteína CFTR mutante para su uso en el tratamiento de la fibrosis quística.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/PL2011/000060.
Solicitante: Instytut Biochemii i Biofizyki PAN.
Nacionalidad solicitante: Polonia.
Dirección: Ul. Pawinskiego 5A 02-106 Warszawa POLONIA.
Inventor/es: ODOLCZYK,NORBERT, ZIELENKIEWICZ,PIOTR, WIECZOREK,GRZEGORZ, EDELMAN,ALEKSANDER, TONDELIER,DANIELLE, FRITSCH,JANINE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/435 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con un nitrógeno como único heteroátomo de un ciclo.
- A61K31/663 A61K 31/00 […] › Compuestos que tienen varios grupos deácido del fósforo o sus esteres, p. ej. ácido clodrónico, ácido pamidrónico.
- C07C233/65 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 233/00 Amidas de ácidos carboxílicos. › con los átomos de nitrógeno de los grupos carboxamido unidos a átomos de hidrógeno o a átomos de carbono de radicales hidrocarbonados insustituidos.
- C07C235/84 C07C […] › C07C 235/00 Amidas de ácidos carboxílicos, estando sustituida la estructura carbonada de la parte ácida por átomos de oxígeno. › con el átomo de carbono de al menos uno de los grupos carboxamido unido a un átomo de carbono de un ciclo aromático de seis miembros.
- C07D219/10 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 219/00 Compuestos heterocíclicos que contienen sistemas cíclicos de acridina o acridina hidrogenada. › unidos en posición 9.
- C07D401/12 C07D […] › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
- C07D473/22 C07D […] › C07D 473/00 Compuestos heterocíclicos que contienen sistemas cíclicos de purina. › un átomo de azufre y un átomo de oxígeno.
- C07D473/30 C07D 473/00 […] › unido en posición 6, p. ej. hipoxantina.
- C07F9/30 C07 […] › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 9/00 Compuestos que contienen elementos de los grupos 5 o 15 del sistema periódico. › Acidos fosfínicos (R 2 = P(:O)OH); Acidos tiofosfínicos.
PDF original: ES-2553628_T3.pdf

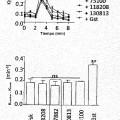
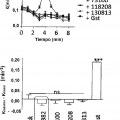

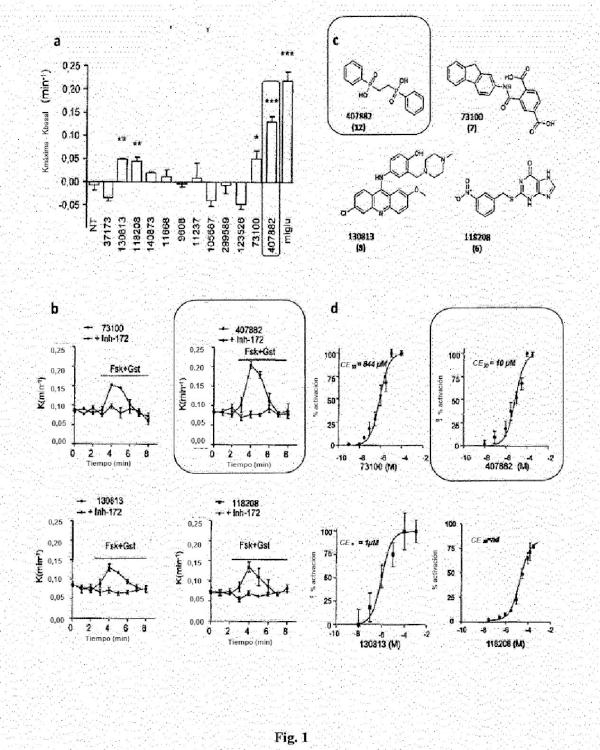
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Compuestos de 2-oxo-1,2-dihidropiridin-3-carboxamida y su uso como inhibidores de PDK1, del 20 de Mayo de 2020, de International Society for Drug Development S.r.l: Un compuesto de 2-oxo-1,2-dihidropiridin-3-carboxamida de Fórmula (I) **(Ver fórmula)** en donde m es 0 o 1 n es 0 o 1 A se selecciona […]
Derivados de isoindolin-1-ona como actividad del modulador alostérico positivo del receptor M1 muscarínico colinérgico para el tratamiento de la enfermedad de Alzheimer, del 20 de Mayo de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto representado por la fórmula (I): **(Ver fórmula)** , en donde R1 es un grupo fenilo, un grupo cicloalquilo C5-6, un grupo […]
Compuestos de atropisómeros tricíclicos, del 15 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o una de sus sales, en la que: las dos líneas de puntos representan dos enlaces sencillos o dos […]
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]
Nuevos inhibidores de bromodominios bicíclicos, del 11 de Marzo de 2020, de Zenith Epigenetics Ltd: Compuesto de Fórmula IIb' o Fórmula IId': **(Ver fórmula)** o un estereoisómero, tautómero, sal farmacéuticamente aceptable o hidrato del mismo, en el que: los […]
Formulación de Ceritinib, del 26 de Febrero de 2020, de NOVARTIS AG: Una composición farmacéutica que comprende al menos 150 mg y hasta 750 mg de Ceritinib y más de 40 y hasta 70 por ciento en peso de Ceritinib basado […]