MODULADORES DE UNIONES COMUNICANTES DE PÉPTIDOS.
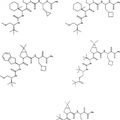
Péptido para su utilización en terapia representado por la fórmula general I:
en la que:a es 1 y b es 0; o b es 1 y a es 0; d es 0-8; y z es 1-7; y x es 1, y y q son 1, y p es 0; o p es 1, x y q son 0, e y es 1; y además en la que, si R1 es H, entonces d es 0-8; o si R1 no es H, entonces d es 0; en la que R1 es la cadena lateral de un aminoácido seleccionado del grupo que consiste en alanina, arginina, asparagina, ácido aspártico, cisteína, ácido glutámico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, y valina; en la que R2 se selecciona del grupo que consiste en NH2, NHR, NR2, NR3+H, OH, SH, RO, RS, RSO, RSO2, COR, CSR, COOH, COOR, CONH2, CONHR, CONR2, OCOR, y SCOR, en la que R = alquilo, alquenilo, arilo, aralquilo o cicloalquilo; en la que R3 es H o CH3; y en la que RX es un grupo hidrofóbico; o una sal farmacéuticamente aceptable de la misma
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2003/000805.
Solicitante: ZEALAND PHARMA A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: SMEDELAND 26B 2600 GLOSTRUP DINAMARCA.
Inventor/es: LARSEN, BJARNE DUE, PETERSEN, JORGEN, SOBERG, KNUDSEN,CARSTEN,BOYE.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Noviembre de 2003.
Fecha Concesión Europea: 29 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07K5/06A1A2
- C07K5/06A1A3
- C07K5/06A1B
- C07K5/06A2
- C07K5/06B
- C07K5/06C
- C07K5/06C1A
- C07K5/06H1
- C07K5/06T
Clasificación PCT:
- A61K38/06 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Tripéptidos.
- A61P9/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antiarrítmicos.
- C07K5/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 5/00 Péptidos con hasta cuatro aminoácidos en una secuencia totalmente determinada; Sus derivados. › Dipéptidos.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Moduladores de uniones comunicantes de péptidos.
Campo de la invención
La presente invención se refiere a dipéptidos disponibles oralmente capaces de modular la comunicación por uniones comunicantes intracelulares. La presente invención también se refiere a procedimientos de utilización de los péptidos para modular dicha comunicación, a la utilización de los péptidos para la fabricación de medicamentos para la prevención y/o el tratamiento de condiciones patológicas asociadas con dicha comunicación y a composiciones farmacéuticas que comprenden dichos dipéptidos.
Antecedentes
Existe un reconocimiento creciente de que la comunicación intercelular es esencial para la homeostasis, la proliferación y la diferenciación celular. Se cree que dicha comunicación está facilitada por uniones comunicantes. Se piensa que estas estructuras son una ruta para el acoplamiento de células y que permiten la "conversación cruzada". Ver generalmente, Sperelakis, N., (1989) Cell Interactions and Gap Junctions by N. Sperelakis, William C. Cole (Edi-tor).
Se han realizado esfuerzos para comprender la estructura y la función de las uniones comunicantes. Por ejemplo, se ha descrito que dichas uniones son un tipo de complejo formado entre células adyacentes. Se piensa que la mayoría de uniones comunicantes consisten en canales agregados que directamente enlazan los interiores (citoplasmas) de células vecinas. En mamíferos adultos, se encuentran uniones comunicantes en la mayoría de tipos de células con la excepción de elementos sanguíneos circulantes.
Más específicamente, existe el conocimiento de que las uniones comunicantes son regiones especializadas de la membrana celular con agrupaciones de cientos a miles de canales de uniones comunicantes densamente empaquetados (que comprenden dos hemicanales o conexinas). Se piensa que muchos conectan directamente los compartimentos citoplasmáticos de dos células vecinas. El canal de unión comunicante puede cambiar entre un estado abierto y un estado cerrado. En el estado abierto se piensa que los iones y las moléculas pequeñas pasan a través del poro. La conducción de impulsos eléctricos y la difusión intercelular de moléculas de señal tienen lugar a través de las uniones comunicantes.
La "conversación-cruzada" entre uniones comunicantes hace referencia a la comunicación intracelular por uniones comunicantes (GJIC), que se cree que juega un rol importante en la regulación del metabolismo celular, la proliferación, la señalización célula-a-célula, y la integridad tisular.
Por ejemplo, se cree que GJIC permite el equilibrado rápido de nutrientes, iones y fluidos entre las células. También se cree que las uniones comunicantes sirven de sinapsis eléctricas en células excitables eléctricamente. En muchos tejidos, se cree que el acoplamiento eléctrico permite la transmisión célula-a-célula más rápida de potenciales acciones que la sinapsis química. Por ejemplo, en cardiomiocitos y células musculares lisas, se cree que ayudan a la contracción sincrónica.
Se han descrito otras funciones mediadas por GIJC. Por ejemplo, se cree que GJIC mejora la sensibilidad de tejidos a estímulos externos. Generalmente, se cree que los segundos mensajeros son lo suficientemente pequeños como para que pasen de células activadas hormonalmente a células inactivas a través de canales de unión y activar a las segun-das.
Adicionalmente, se ha descrito que las uniones comunicantes pueden proporcionar vías intercelulares para señales de desarrollo químico y/o eléctrico y ayudar en la definición de los límites de los compartimentos de desarrollo. Se ha descrito que la GJIC tiene lugar en patrones específicos en células embrionarias y la alteración de la GJIC se ha relacionado con anomalías de desarrollo y los efectos teratogénicos de muchos compuestos químicos. Además, se cree que GJIC ayuda en la coordinación de las actividades celulares.
Algunos han establecido una conexión entre anormalidades en GJIC y se ha establecido un rango de estados de enfermedad tanto in vitro como in vivo. Por ejemplo, se piensa que hay una conexión entre anormalidades en las conexinas y la enfermedad cardiaca. Diversos estudios de la expresión y la distribución de Cx43 en corazones describieron un grado reducido de expresión de Cx43 y un patrón cambiado de distribución para esta proteína de unión comunicantes. Véase Kaprielian, R. R., et al. (1998) Circulation 97: 651-660; y Saffitz, J. E., et al., (1999) Cardiovasc Res. 42: 309-317.
Por consiguiente, se reconoce en el campo una relación entre una disfunción o la ausencia de uniones comunicantes y un riesgo incrementado de arritmias. Se piensa que existe una relación adicional entre la expresión/distribución alterada de conexinas y la enfermedad cardiaca crónica.
Se han hecho intentos por analizar péptidos que influyen en la GIJC. Por ejemplo, se ha descrito un grupo de péptidos (los péptidos antiarrítmicos) con capacidad de incrementar la conductancia de las uniones comunicantes en el corazón. En concreto, se describió un hexapéptido con un peso molecular de 470D que había sido aislado de aurículas bovinas. En cardiomiocitos de rata neonatal, se describió que el péptido podía convertir la fibrilación inducida por ouabaína, calcio, o potasio, en el ritmo normal. Además, se ha descrito que el péptido convierte el movimiento arrítmico de aurículas de rata aisladas inducidas mediante la combinación de potasio y acetilcolina en el ritmo normal. Este péptido es referido frecuentemente como péptido antiarrítmico (AAP). Ver, por ejemplo, Aonuma, S., et al. (1980) Chem Pharm Bull (Tokyo) 28: 3332-3339.
Existe una mayor conciencia de que el AAP es un péptido importante con capacidad para modular la CJIC en el corazón.
Por ejemplo, en el cultivo celular, se ha observado que el AAP incrementa el número de centros palpitantes, el contenido relativo de las células de expansión, y la síntesis de proteínas. Véase, Aonuma, S., et al. (1980) Chem Pharm Bull (Tokyo) 28: 3340-3346. En otros estudios, se ha confirmado el efecto antiarrítmico de APP observado in vitro. Se ha descrito que el AAP es eficaz contra la arritmia inducida por CaCl2, oubaina y acotinina en ratones. Véase Ronsberg, M.A., et al. (1986) Med. Sci. 14: 350-351.
Se ha descrito la secuencia de AAP. Véase por ejemplo, Aonuma, S., et al. (1982) J Pharmacobiodyn. 5: 40-48.
Se han hecho esfuerzos por preparar un conjunto de derivados de AAP. Véase, por ejemplo, Dikshit, M., et al. (1988) Indian J. Exp. Biol. 26: 874-876; Kohama, Y., et al. (1987) Chem. Pharm. Bull. (Tokyo) 35: 3928-3930; y Kohama, Y., et al. (1988) Chem. Pharm. Bull. (Tokyo) 36: 4597-4599).
Por ejemplo, uno de dichos derivados, AAP10, se cree que afecta la GJIC. Véase, Dhein, S., et al. (1994) Naunyn Schmiedebergs Arch Pharmacol. 350: 174-184; y Muller, A., et al. (1997) Eur. J. Pharmacol. 327: 65-72. Se ha descrito que el APP mejora la GJIC, reduce la potencial dispersión y mejora la conductancia.
Existe un creciente conocimiento de que muchos péptidos antiarrítmicos impactan positivamente la GJIC, a menudo sin afectar la duración o forma potencial de la acción. Además, se cree que muchos de dichos péptidos carecen de efectos secundarios proarrítmicos indeseables. Dichos efectos se cree que limitan la utilización de muchos fármacos antiarrítmicos actualmente disponibles. Además, el APP, así como ciertos derivados de APP, se cree que presentan algunas características no deseadas, por ejemplo, una estabilidad baja y la necesidad de dosis elevadas antes de conseguir la eficacia terapéutica.
Muchos péptidos potenciales importantes padecen de una falta de disponibilidad oral aceptable. Es decir, los péptidos son degradados en el tracto gastrointestinal, entericitos, o ambos. En dichos casos, los péptidos se administran a menudo a sujetos mediante rutas intravenosas más dolorosas y menos convenientes.
Han habido intentos para mejorar la disponibilidad oral de ciertos compuestos mediante el aumento del contacto con una proteína de transportadora de péptidos intestinales llamada PepT1. Se conoce mucho sobre el sistema transportador PepT1. Véase Bailey, P.D., et al. (2000) Angew. Chem. Int. Ed. 39:506; y las referencias citadas en la misma.
Sería deseable tener péptidos moduladores eficaces de GJIC....
Reivindicaciones:
1. Péptido para su utilización en terapia representado por la fórmula general I:
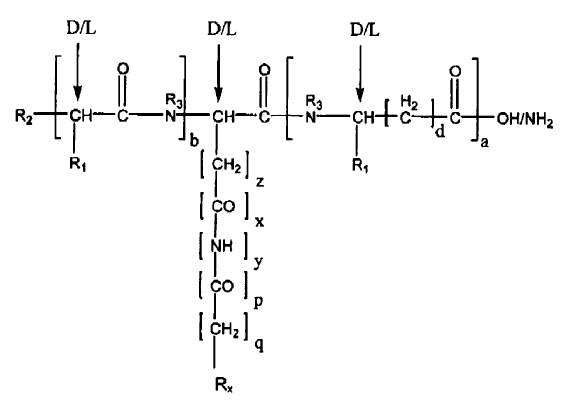
en la que:
a es 1 y b es 0; o
b es 1 y a es 0;
d es 0-8; y
z es 1-7; y
x es 1, y y q son 1, y p es 0; o
p es 1, x y q son 0, e y es 1;
y además en la que,
si R1 es H, entonces d es 0-8; o
si R1 no es H, entonces d es 0;
en la que R1 es la cadena lateral de un aminoácido seleccionado del grupo que consiste en alanina, arginina, asparagina, ácido aspártico, cisteína, ácido glutámico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, y valina;
en la que R2 se selecciona del grupo que consiste en NH2, NHR, NR2, NR3+H, OH, SH, RO, RS, RSO, RSO2, COR, CSR, COOH, COOR, CONH2, CONHR, CONR2, OCOR, y SCOR, en la que R = alquilo, alquenilo, arilo, aralquilo o cicloalquilo;
en la que R3 es H o CH3; y
en la que RX es un grupo hidrofóbico;
o una sal farmacéuticamente aceptable de la misma.
2. Péptido según la reivindicación 1, en el que Rx comprende un anillo aromático de carbonos.
3. Péptido según la reivindicación 2, en el que el anillo aromático comprende un anillo de 6 ó 12 miembros o una forma sustituida del mismo.
4. Péptido según la reivindicación 3, en el que el anillo está sustituido con por lo menos uno de: un alquilo inferior, alcoxi, hidroxilo, carboxi, amina, tiol, hidrazida, amida, haluro, hidroxilo, éter, amina, nitrilo, imina, nitro, sulfuro, sulfóxido, sulfona, tiol, aldehído, ceto, carboxi, éster, un grupo amida; un grupo seleno, un grupo tio y un derivado de los mismos.
5. Péptido según la reivindicación 3, en el que el anillo comprende entre 1 y 5 sustituciones.
6. Péptido según la reivindicación 3, en el que el anillo comprende 1 ó 2 sustituciones.
7. Péptido según la reivindicación 2, en el que el anillo aromático de carbonos se selecciona del grupo que consiste en: un grupo bencilo, fenilo y naftilo.
8. Péptido según la reivindicación 1 o la reivindicación 2, en el que el grupo hidrofóbico es un anillo aromático de carbonos de 6 miembros que comprende un sustituyente en la posición 4.
9. Péptido para su utilización en terapia según la reivindicación 1 representado por la fórmula general II:
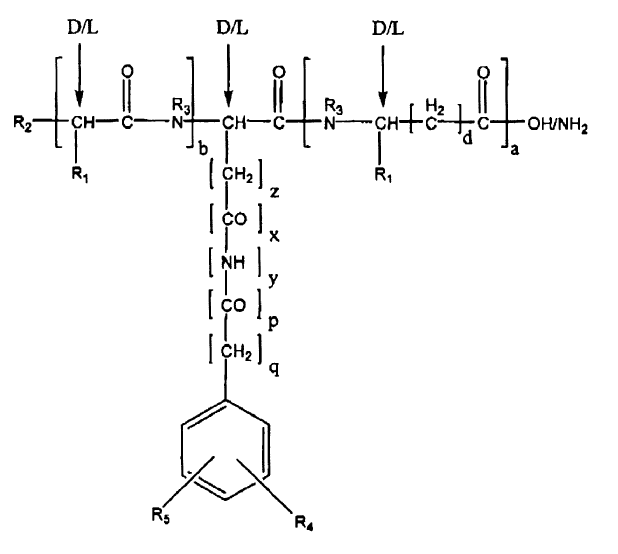
en la que:
a es 1 y b es 0; o
b es 1 y a es 0;
d es 0-8; y
z es 1-7; y
x es 1, y y q son 1, y p es 0; o
p es 1, x y q son 0, e y es 1;
y además en la que,
si R1 es H, entonces d es 0-8; o si R1 no es H, entonces d es 0;
en la que R1 es la cadena lateral de un aminoácido seleccionado del grupo que consiste en alanina, arginina, asparagina, ácido aspártico, cisteína, ácido glutámico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, y valina;
en la que R2 se selecciona del grupo que consiste en NH2, NHR, NR2, NR3+H, OH, SH, RO, RS, RSO, RSO2, COR. CSR, COOH, COOR, CONH2, CONHR, CONR2, OCOR, y SCOR, en la que R = alquilo, alquenilo, arilo, aralquilo o cicloalquilo;
en la que R3 es H o CH3;
en la que R4 y R5 se seleccionan independientemente del grupo que consiste en H, alquilo, alquenilo, arilo, aralquilo, halógeno, CN, NO2, alcoxi, ariloxi, aralquiloxi, tioalcoxi, tioariloxi, tioaralquiloxi, +S(CH3)2, SO3H, SO2R, NH2, NHR, NR2, +NR3, OH, SH, COOH, COOR, CONH2, CONHR, CONR2, CH2OH, NCO, NCOR, NHOH, NHNH2, NHNRH, CH2OCOR, CH2OCSR, COR, CSR, CSOR, CF3, y CCl3, y en la que R es alquilo, alquenilo, arilo, aralquilo o cicloalquilo;
o una sal farmacéuticamente aceptable de la misma.
10. Péptido representado por la fórmula general I:
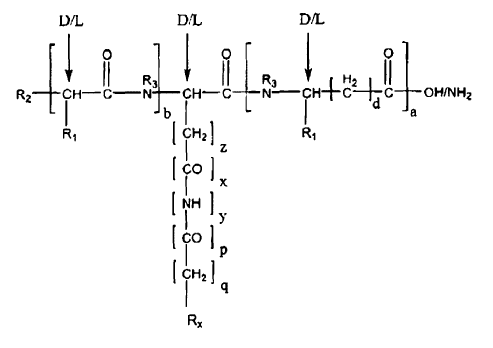
en la que:
a es 1 y b es 0; o
b es 1 y a es 0; y
d es 0-8; y
z es 1-7;
x es 1, y y q son 1, y p es 0; o
p es 1, x y q son 0, e y es 1;
y además en la que,
si R1 es H, entonces d es 0-8; o
si R1 no es H, entonces d es 0;
en la que R1 es la cadena lateral de un aminoácido seleccionado del grupo que consiste en alanina, arginina, asparagina, ácido aspártico, cisteína, ácido glutámico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, y valina;
en la que R2 se selecciona del grupo que consiste en NH2, NHR, NR2, NR3+H, OH, SH, RO, RS, RSO, RSO2, COR, CSR, COOH, COOR, CONH2, CONHR, CONR2, OCOR, y SCOR, en la que R = alquilo, alquenilo, arilo, aralquilo o cicloalquilo;
en la que R3 = H o CH3; y
en la que Rx es un anillo aromático de carbonos de 6 miembros que comprende un sustituyente en la posición 4;
o una sal farmacéuticamente aceptable de la misma.
11. Péptido según la reivindicación 10, en la que el anillo aromático de carbonos está sustituido con por lo menos uno de: un alquilo inferior, alcoxi, hidroxilo, carboxi, amina, tiol, hidrazida, amida, haluro, hidroxilo, éter, amina, nitrilo, imina, nitro, sulfuro, sulfóxido, sulfona, tiol, aldehído, ceto, carboxi, éster, un grupo amida; un grupo seleno, un grupo tio y derivados de los mismos.
12. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido comprende un N-terminal libre, un C-terminal libre, o ambos, un N y un C-terminal libre.
13. Péptido según cualquiera de las reivindicaciones anteriores, en el que la sal farmacéuticamente aceptable es una sal de adición de ácido, una sal metálica, una sal de amonio o una sal de adición de aminoácido.
14. Péptido según la reivindicación 13, en el que la sal farmacéuticamente aceptable es una sal de clorhidrato, una sal sulfato, una sal fosfato, una sal acetato, una sal maleato, una sal fumarato, una sal tartrato, una sal citrato, una sal de sodio, una sal de potasio, una sal de magnesio, una sal de calcio, una sal de amonio o tetrametilamonio, una sal de lisina, una sal de glicina o una sal de fenilalanina.
15. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido comprende además un grupo de enlace de hidrógeno y la distancia entre el centro de masas del grupo enlace de hidrógeno y el grupo hidrofóbico comprende de aproximadamente 4 Angstroms a aproximadamente 12 Angstroms.
16. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido comprende además un grupo de enlace de hidrógeno y la distancia entre el centro de masas del grupo enlace de hidrógeno y el grupo hidrofóbico comprende de aproximadamente 5 Angstroms a aproximadamente 10 Angstroms.
17. Péptido según la reivindicación 10, en el que sustituyente tiene un radio de desde 3 a 11 Angstroms.
18. Péptido según la reivindicación 17, en el que el sustituyente se selecciona del grupo que consiste en un grupo metilo, etilo, t-butilo, c-hexilo, fenilo, n-butilo, n-hexilo, n-octilo, etoxi, t-butoxi, fenoxi, butoxi, benciloxi, n-hexilooxi, y n-octilooxi.
19. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido actúa como un fármaco antiarrítmico.
20. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido es un péptido disponible oralmente.
21. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido se une a un transportador hPepT1 o un fragmento biológicamente activo del mismo.
22. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido tiene una vida media en un ensayo de estabilidad en plasma in vitro de más de 30 minutos.
23. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido tiene una vida media en un ensayo de estabilidad en plasma in vitro de más de aproximadamente 48 horas.
24. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido comprende un enlace peptídico que se modifica para estabilizar el péptido frente a la degradación enzimática.
25. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido se une a un tejido, célula o fracción celular que es un sitio de acción para un péptido antiarrítmico.
26. Péptido según la reivindicación 23, en el que el péptido antiarrítmico se selecciona del grupo que consiste en AAP, AAP10, HP5, o un análogo funcional del mismo.
27. Péptido según la reivindicación 23, en el que el péptido es un modulador de la función del tejido, célula o fracción celular.
28. Péptido según la reivindicación 25, en el que el péptido es antagonista de la función del péptido antiarrítmico.
29. Péptido según la reivindicación 25, en el que el péptido es agonista de la función del antiarrítmico.
30. Péptido según la reivindicación 23, en el que el péptido es un modulador de un receptor del péptido antiarrítmico.
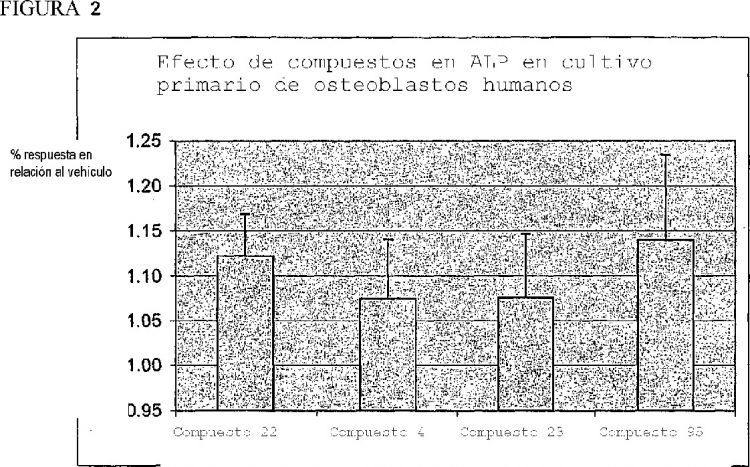
31. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido se selecciona del grupo que consiste en los péptidos mostrados en la Tabla 1.
32. Péptido según cualquiera de las reivindicaciones anteriores, en el que el péptido es:
H-Gly-Lys(4-nitrobenzoil)-OH (compuesto 1);
H-Gly-Lys(4-metoxibenzoil)-OH (compuesto 4);
H-D-Lys(4-metoxibenzoil)-Gly-OH (compuesto 21);
H-D-Lys(4-nitrobenzoil)Gly-OH (compuesto 22);
H-D-Lys(4-t-butilobenzoil)-Gly-OH (compuesto 54);
H-D-Asn(NH(4-nitrobencil)Ala-OH (compuesto 96);
H-D-Lys(benzoil)Gly-OH (compuesto 23) o
H-D-Asn(NH(4-metoxibencil)Ala-OH (compuesto 95).
33. Utilización de un péptido según cualquiera de las reivindicaciones 1 a 32 en la fabricación de un medicamento para el tratamiento de una condición patológica seleccionada entre una enfermedad cardiovascular, inflamación del epitelio de las vías respiratorias, un trastorno del tejido alveolar, incontinencia de la vejiga, oído dañado, una lesión endotelial, retinopatía diabética, neuropatía diabética, isquemia del sistema nervioso central, isquemia de la médula espinal, un trastorno del tejido dental, enfermedad renal, fracaso en el transplante de médula ósea, heridas, disfunción eréctil, incontinencia urinaria de la vejiga, dolor neuropático, inflamación subcrónica y crónica, cáncer, fracaso en el transplante, osteoporosis o una patología que afecta a la formación, crecimiento o mantenimiento de los huesos.
34. Utilización según la reivindicación 33, en la que la enfermedad cardiovascular se selecciona entre arritmia, enfermedad cardiaca isquémica aguda, fallo cardiaco congestivo, enfermedades cardiacas congénitas, cor pulmonale, cardiomiopatía, miocarditis, o enfermedad cardiaca hipertensa.
35. Utilización según la reivindicación 33 o la reivindicación 34, en la que el medicamento es para la administración oral.
36. Utilización según cualquiera de las reivindicaciones 33 a 35, en la que el medicamento es para la administración a un paciente humano.
Patentes similares o relacionadas:
 NUEVOS COMPUESTOS COMO INHIBIDORES DE LA SERINA PROTEASA NS3 DEL VIRUS DE LA HEPATITIS C, del 30 de Diciembre de 2010, de SCHERING CORPORATION: Un compuesto, o enantiómeros, estereoisómeros, rotámeros, tautómeros o racematos de dicho compuesto, o una sal farmacéuticamente aceptable, […]
NUEVOS COMPUESTOS COMO INHIBIDORES DE LA SERINA PROTEASA NS3 DEL VIRUS DE LA HEPATITIS C, del 30 de Diciembre de 2010, de SCHERING CORPORATION: Un compuesto, o enantiómeros, estereoisómeros, rotámeros, tautómeros o racematos de dicho compuesto, o una sal farmacéuticamente aceptable, […]
INHIBIDORES DE NS-3 SERINA PROTEASA DE VHC, del 19 de Julio de 2010, de MEDIVIR AB: Un compuesto de la fórmula I:
INHIBIDORES DE LA NS-3 SERINA PROTEASA DEL VHC, del 7 de Abril de 2010, de MEDIVIR AB: Un compuesto de la fórmula VI:
PEPTIDOS LIBERADORES DE HORMONA DEL CRECIMIENTO, del 8 de Marzo de 2010, de IPSEN PHARMA: Un compuesto de acuerdo con la fórmula (I): (I)R1-A1-A2-A3-A4-A5-R2 o una sal del mismo farmacéuticamente aceptable, en la que: A1 es Aib, Ape o Inp; A2 […]
 PEPTIDO BIOLOGICAMENTE NO DEGRADABLE, INHIBIDOR DE LA ENZIMA QUE CONVIERTE ANGIOTENSINA, FARMACO Y ALIMENTO FUNCIONAL, del 29 de Diciembre de 2009, de CALPIS CO., LTD.: Un péptido que tiene Pro en un terminal carboxilo, seleccionado del grupo constituido por Gln-Pro, Met-Pro, y Ser-Pro-Pro o una sal del mismo, para uso en medicina
PEPTIDO BIOLOGICAMENTE NO DEGRADABLE, INHIBIDOR DE LA ENZIMA QUE CONVIERTE ANGIOTENSINA, FARMACO Y ALIMENTO FUNCIONAL, del 29 de Diciembre de 2009, de CALPIS CO., LTD.: Un péptido que tiene Pro en un terminal carboxilo, seleccionado del grupo constituido por Gln-Pro, Met-Pro, y Ser-Pro-Pro o una sal del mismo, para uso en medicina
COMPUESTOS DE PIPERIZINA CON ACCION HERBICIDA, del 9 de Junio de 2010, de BASF SE: Uso de compuestos de piperazina de la fórmula I
 NONADEPSIPEPTIDOS ACILADOS DE TIPO LISOBACTINA, del 7 de Diciembre de 2009, de AICURIS GMBH & CO. KG: Compuesto de la fórmula ** ver fórmula** en la que R1 significa hidrógeno, cicloalquilo C3-C6, cicloalquenilo C5-C6, cicloalquil C3-C6-metilo, heterociclilmetilo […]
NONADEPSIPEPTIDOS ACILADOS DE TIPO LISOBACTINA, del 7 de Diciembre de 2009, de AICURIS GMBH & CO. KG: Compuesto de la fórmula ** ver fórmula** en la que R1 significa hidrógeno, cicloalquilo C3-C6, cicloalquenilo C5-C6, cicloalquil C3-C6-metilo, heterociclilmetilo […]
 PROCESO PARA PRODUCIR DERIVADOS DE CINAMALDEHIDO, USO DE LOS MISMOS Y SIMILARES, del 23 de Marzo de 2010, de AJINOMOTO CO., INC.: Un proceso para producir un derivado de cinamaldehído representado mediante la siguiente fórmula general (II), o una sal del mismo, que comprende hacer […]
PROCESO PARA PRODUCIR DERIVADOS DE CINAMALDEHIDO, USO DE LOS MISMOS Y SIMILARES, del 23 de Marzo de 2010, de AJINOMOTO CO., INC.: Un proceso para producir un derivado de cinamaldehído representado mediante la siguiente fórmula general (II), o una sal del mismo, que comprende hacer […]