MODIFICACION GENETICA DE CELULAS SOMATICAS Y USOS DE LAS MISMAS.
Un procedimiento de transferencia nuclear que comprende:
(a) preparar una célula somática no humana para la transferencia nuclear por un procedimiento que comprende modificar el material genético de la célula somática no humana mediante un acontecimiento de modificación génica dirigida en un locus endógeno;
y
(b) transferir el material genético desde la célula somática no humana hasta una célula receptora no humana
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB00/00778.
Solicitante: PPL THERAPEUTICS (SCOTLAND) LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: ROSLIN,,EDINBURGH, MIDLOTHIAN EH25.
Inventor/es: COLMAN,ALAN, SCHNIEKE,ANGELIKA ELISABETH, KIND,ALEXANDER JARVIS, AYARES,DAVID LEE, DAI,YIFAN.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A01K67/027M
- C12N15/10B
- C12N15/90B4
- H04L12/24A2
- H04L12/24C2
- H04L12/24F3
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C12N15/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12N15/88 C12N 15/00 […] › utilizando la micro-encapsulación, p. ej. utilizando vesículas liposómicas.
- C12N15/90 C12N 15/00 […] › Introducción estable de ADN extraño en el cromosoma.
- C12N5/06
Clasificación antigua:
- A01K67/027 A01K 67/00 […] › Nuevas razas de vertebrados.
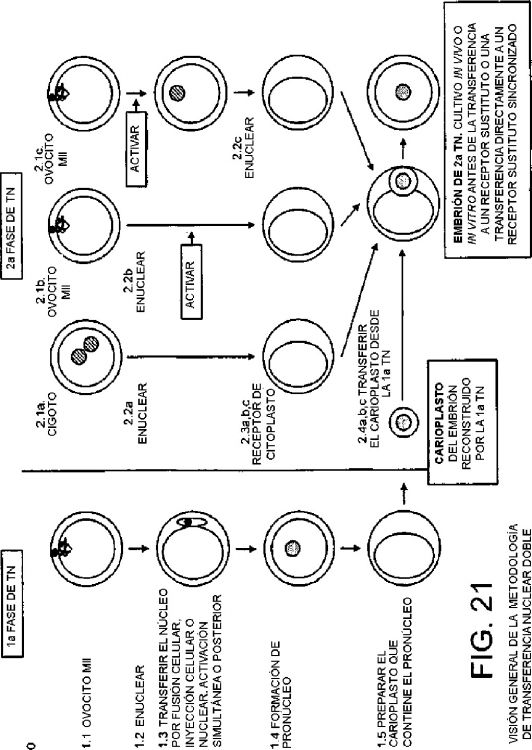
Fragmento de la descripción:
Modificación genética de células somáticas y usos de las mismas.
La presente invención describe la producción de animales modificados genéticamente en los que las modificaciones genéticas están diseñadas en células somáticas cultivadas in vitro usando la técnica de modificación génica dirigida. Las células modificadas genéticamente después se usan como donantes nucleares para producir inter ali, animales vivos.
Los procedimientos descritos también pueden usarse para validar loci en cromosomas animales que son sitios adecuados para adición de transgenes a las células. El procedimiento es particularmente útil para células en las que es necesario que no tengan efectos perjudiciales imprevistos, tales como células destinadas a transplante autólogo.
La técnica de transferencia nuclear permite la producción de descendencia por la reconstrucción de un embrión temprano. El material genético de una célula donante o carioplasto se transfiere a una célula receptora adecuada de la que se ha eliminado el material genético nuclear o genómico. En las primeras demostraciones de esta técnica, se obtuvo un desarrollo satisfactorio solamente cuando el material genético donante se tomaba de blastómeros de embriones tempranos. Posteriormente, se ha obtenido el desarrollo usando material genético donante de células diferenciadas mantenidas en cultivo y aisladas de tejidos embrionarios (Campbell y col., Nature 380, 64-66, 1996), fetales y adultos (Wilmut y col., Nature 385, 810-813, 1997); estos informes forman la base de las solicitudes de patente WO 97/07669 y WO 97/07668 que se incorporan en la presente solicitud en su totalidad, incluyendo todas las tablas y diagramas.
Los procedimientos para la transferencia nuclear también se han descrito en las solicitudes de patente publicadas WO 98/39416, WO 98/30683, WO 98/07841, WO 97/37009, WO 98/27214, WO 99/01163 y WO 99/01164.
Se ha obtenido descendencia viva en ratones usando poblaciones de células quiescentes obtenidas directamente ex vivo como donantes nucleares (Wakayama y col., Nature 394, 369-373 1998). El uso satisfactorio de células diferenciadas también se ha demostrado en ovejas (Wilmut y col., Nature 385, 810-813, 1997), ganado vacuno (Kato y col., Science 282, 2095-2098, 1998; Wells, y col., Theriogenology 1, 217, 1999; Zakhartchenko, y col., Theriogenology 1, 218, 1999; Vignon, y col., Theriogenology 1, 216, 1999) y ratones (Wakayama y col., Nature 394, 369-373).
En todas las referencias citadas anteriormente, la célula donante nuclear y la receptora se toman de la misma especie. Sin embargo, se ha informado de éxito en la consecución del desarrollo de embriones reconstruidos usando células nucleares donantes y receptoras de diferentes especies (Dominko, y col., Theriogenology 49, 385, 1998; Mitalipova, y col., Theriogenology 49, 389, 1998).
El uso de la tecnología de transferencia nuclear tiene muchos beneficios y usos demostrados y potenciales en la producción de embriones, fetos y descendencia de mamíferos. Estos incluyen, entre otros;
1. La capacidad para modificar genéticamente células cultivadas que se van a usar como donantes nucleares antes de la reconstrucción del embrión.
2. La capacidad para realizar múltiples modificaciones genéticas en un único animal mediante modificaciones genéticas múltiples de una población celular en cultivo o mediante modificación genética, transferencia nuclear y re-aislamiento secuencial de una población celular del embrión, feto o animal producido de este modo.
3. La capacidad para aumentar la vida de poblaciones celulares cultivadas que se van a usar para modificación genética mediante transferencia nuclear y re-aislamiento de una población celular del embrión, feto o animal adulto producido de este modo.
4. La capacidad para producir múltiples copias de un animal a partir de una población celular modificada genéticamente, seleccionada y clonada.
5. La capacidad para producir múltiples copias de cualquier embrión, feto o animal adulto por transferencia nuclear desde células tomadas directamente ex vivo, o poblaciones celulares obtenidas de cualquier tejido tomado de cualquiera de estas fases con o sin cultivo in vitro.
6. La capacidad para producir verdaderos clones (que no solo comparten la identidad genética nuclear, sino también la identidad genética mitocondrial) utilizando ovocitos de la línea materna del donante celular como receptores de citoplastos para la reconstrucción de embriones.
7. La capacidad para almacenar genomas intactos durante largos periodos (por ejemplo, congelando poblaciones celulares en N2 líquido) y de usar estas células almacenadas posteriormente para la producción de descendencia por transferencia nuclear.
8. La capacidad para desdiferenciar núcleos somáticos y de producir células no diferenciadas que pueden usarse para producir embriones, fetos y animales adultos quiméricos por agregación del embrión, o inyección. Esto también puede usarse para producir poblaciones de células madre embrionarias o células germinales embrionarias.
9. La capacidad para desdiferenciar cualquier tipo de célula somática por transferencia nuclear y de aislar del embrión producido de este modo, células madre embrionarias, o cualquier otro tipo celular especializado o no especializado deseado, por ejemplo, neuronas.
10. La posibilidad de conseguir cualquiera de los objetivos indicados en 1-9, usando células nucleares donantes y receptoras de diferentes especies.
Este proceso puede acoplarse con las técnicas de manipulación genética para la producción de descendencia transgénica (Schnieke y col., Science 278, 2130-2133, 1997). El uso de transferencia nuclear acoplada a la modificación genética de células en cultivo y su selección antes de la producción del animal tiene varias ventajas demostradas, incluyendo;
1. Producción de animales no mosaico que aseguran la transmisión por la línea germinal de la(s) modificación(es) genética(s) (Schnieke y col., Supra).
2. Una eficacia aumentada en la producción de dichos animales modificados genéticamente (Schnieke y col., Supra).
3. La producción de múltiples copias de la descendencia reduciendo de este modo el intervalo de generación para producir rebaños o manadas de animales comercialmente importantes o aumento la cantidad de animales para la diseminación de la modificación genética en la población como conjunto (Cibelli, y col., Nat. Biotechnol. 16, 642-6, 1998).
La tecnología de transferencia nuclear existente y publicada acoplada con la modificación genética de células en cultivo proporciona animales que contienen modificaciones genéticas sencillas y múltiples en los que los transgenes se incorporan en localizaciones no seleccionadas dentro del genoma hospedador. Sin embargo, la producción de células cultivadas que incorporan una modificación genética deseada diseñada en una localización precisa y predeterminada en el genoma hospedador (modificación genética dirigida) solamente se ha descrito previamente en la técnica para ratones usando células ES y los procedimientos publicados no implican tecnología de transferencia nuclear. No existen dichos procedimientos equivalentes para otros mamíferos. Dichas modificaciones tendrían varias ventajas cuando se aplican a una diversidad de especies animales incluyendo ganado vacuno, ovejas, cabras, caballos, camellos, conejos y roedores. Dichas ventajas incluyen, aunque sin limitación:
1. La producción de animales transgénicos con características superiores de expresión de transgenes colocando el transgén en un sitio predeterminado.
2. La eliminación, modificación, inactivación o reemplazo de un gen o genes endógenos elegidos y/o sus secuencias de control.
3. Si se descubre que dichas modificaciones no tienen efecto prejudicial imprevisto sobre el animal resultante que pudieran atribuirse a, por ejemplo, la alteración de genes endógenos, la activación de oncogenes, etc., esto constituiría la validación del locus elegido como sitio preferido para modificación genética, particularmente si el sitio también confería buena expresión de los transgenes colocados en el locus.
Un objetivo de esta memoria descriptiva de patente es rectificar esta situación y describir por primera vez procedimientos que puedan utilizarse para...
Reivindicaciones:
1. Un procedimiento de transferencia nuclear que comprende:
(a) preparar una célula somática no humana para la transferencia nuclear por un procedimiento que comprende modificar el material genético de la célula somática no humana mediante un acontecimiento de modificación génica dirigida en un locus endógeno; y
(b) transferir el material genético desde la célula somática no humana hasta una célula receptora no humana.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que el acontecimiento de modificación génica dirigida está mediado por recombinación homóloga.
3. Un procedimiento, de acuerdo con la reivindicación 1 o la reivindicación 2, en el que la modificación es inactivación, eliminación o modificación de un gen; regulación positiva de un gen, reemplazo génico o colocación de transgenes.
4. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que el acontecimiento de modificación génica dirigida produce una proporción de clon celular con modificación génica dirigida:clon celular modificado aleatoriamente igual a o mayor que 1:100.
5. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que el acontecimiento de modificación génica dirigida se realiza en un locus expresado abundantemente en la célula somática huésped.
6. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que un gen estructural se coloca adyacente a un promotor endógeno.
7. Un procedimiento de acuerdo con la reivindicación 6, en el que el promotor endógeno es el del gen del colágeno.
8. Un procedimiento de acuerdo con la reivindicación 6, en el que el promotor endógeno es el del gen de la proteína de la leche.
9. Un procedimiento de acuerdo con la reivindicación 6, en el que el promotor endógeno dirige la expresión abundante en células fibroblásticas.
10. Un procedimiento de acuerdo con la reivindicación 6, en el que el promotor endógeno dirige la expresión abundante en células endoteliales.
11. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en el que el acontecimiento de modificación génica dirigida está mediado por lipofección.
12. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 11, en el que el acontecimiento de modificación génica dirigida implica el uso de un vector dirigido al gen, en el que el vector comprende una región larga de homología con el locus diana.
13. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 12, en el que el acontecimiento de modificación génica dirigida implica el uso de un vector dirigido al gen que está en forma circular.
14. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 13, en el que el acontecimiento de modificación génica dirigida incluye la inducción artificial de expresión génica o la inducción de cambios en la cromatina en la célula.
15. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 14, en el que el acontecimiento de modificación génica dirigida está facilitado por un agente que inhibe la desacetilación de histonas o por la expresión en la célula de un factor que estimula la transcripción en el locus diana.
16. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 15, en el que la célula somática no humana es una célula somática primaria.
17. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 16, en el que la célula somática no humana es una célula epitelial o una célula fibroblástica o una célula endotelial o una célula muscular.
18. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 17, en el que la transferencia del material genético desde la célula somática no humana hasta una célula receptora no humana proporciona un embrión animal no humano.
19. Un procedimiento, de acuerdo con una cualquiera de las reivindicaciones 1 a 18, que comprende adicionalmente la producción de una población celular clonada totipotente o pluripotente no humana.
20. Un embrión no humano transgénico o un feto no humano transgénico que se puede obtener mediante un procedimiento de acuerdo con la reivindicación 18, en el que el genoma contiene ADN exógeno.
21. Una célula no humana transgénica obtenida del embrión no humano o del feto no humano de la reivindicación 20.
22. Un procedimiento de acuerdo con la reivindicación 18, en el que se usa una célula del embrión animal no humano para transferencia nuclear adicional.
23. Un procedimiento para preparar un animal no humano transgénico, que comprende causar que un animal no humano se desarrolle a término a partir del embrión no humano de acuerdo con la reivindicación 20 y, opcionalmente, reproducirlo a partir del animal.
24. Un animal transgénico que se puede obtener por el procedimiento de acuerdo con la reivindicación 23.
25. Un animal transgénico de acuerdo con la reivindicación 24 que es una oveja, una vaca, un toro, una cabra, un cerdo, un caballo, un camello, un conejo, o un roedor.
26. Un animal transgénico que se reproduce a partir de un animal de acuerdo con la reivindicación 24 o la reivindicación 25.
27. Un procedimiento para obtener una población celular pluripotente o totipotente no humana clonal que comprende cultivar una línea celular a partir de un embrión transgénico no humano o de un feto transgénico no humano de acuerdo con la reivindicación 20.
28. Una población celular pluripotente o totipotente no humana clonal que se puede obtener de acuerdo con un procedimiento de acuerdo con la reivindicación 27.
Patentes similares o relacionadas:
MODELOS DE SELECCIÓN IN VIVO PARA EL TRATAMIENTO DE LA ENFERMEDAD DE ALZHEIMER Y OTROS TRASTORNOS RELACIONADOS CON QPCT, del 17 de Enero de 2012, de PROBIODRUG AG: Animal transgénico no humano que sobreexpresa glutaminil ciclasa que comprende células que contienen un transgén de ADN que codifica para glutaminil ciclasa.
ANIMAL TRANSGÉNICO IL-18, del 13 de Enero de 2012, de Taiho Pharmaceutical Co., Ltd. Nakanishi, Kenji Mizutani, Hitoshi: Un ratón transgénico que secreta de forma continua IL-18 madura en sangre y que desarrolla de forma continua dermatitis atópica, que comprende un ADN en el que una secuencia […]
COMPOSICIONES Y PROCEDIMIENTOS PARA EL TRATAMIENTO Y DIAGNÓSTICO DE TRASTORNOS INMUNITARIOS, del 15 de Diciembre de 2011, de MILLENNIUM PHARMACEUTICALS, INC.: Un anticuerpo que se une específicamente a un péptido codificado por la secuencia de nucleótidos de la SEC ID N.º: 2 o un péptido codificado por el gen […]
MODELO TRANSGÉNICO DE LA ENFERMEDAD DE ALZHEIMER, del 2 de Noviembre de 2011, de BioArctic Neuroscience AB: Un ratón transgénico que expresa un transgén que comprende una secuencia de ADN que codifica una Proteína Precursora Amiloide (APP) heteróloga que comprende la mutación […]
COMPOSICIONES PARA LA DERIVACIÓN CULTIVO IN VITRO DE LÍNEAS DE CÉLULAS MADRE EMBRIONARIAS (ES) CON CAPACIDAD DE TRANSMISIÓN DE LA LÍNEA GERMINAL Y PARA EL CULTIVO DE CÉLULAS MADRE ADULTAS, del 4 de Julio de 2011, de THROMBOGENICS N.V.: Un método para obtener, mantener o hacer crecer células madre embrionarias pluripotentes de roedor que comprenden la etapa de cultivar las células durante al menos […]
CONSTRUCCION GENICA QUE COMPRENDE EL GEN QUE CODIFICA LA PROTEINA KAPY ANIMAL NO HUMANO MODIFICADO GENETICAMENTE CON LA MISMA, del 30 de Junio de 2011, de FUNDACIO INSTITUT DE RECERCA HOSPITAL UNIVERSITARI VALL D'HEBRON, FUNDACIO PRIVADA: La presente invención se refiere a una construcción génica que comprende el gen de la proteína renal regulada por andrógenos (KAP) de ratón bajo el control […]
MEDIO DE CULTIVO DE CÉLULAS EMBRIONARIAS TOTIPOTENTES AVIARES, del 7 de Junio de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Procedimiento de cultivo de células embrionarias totipotentes aviares (o células ES aviares), caracterizado porque: 1) Se suspenden unas células que proceden de discos […]
 CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]
CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]