Miméticos de Smac diazo bicíclicos y sus usos.
Un compuesto que tiene la Fórmula VI:**Fórmula**
en donde:
A1 y A2 son independientemente seleccionados del grupo que consiste de hidrógeno y alquilo opcionalmente sustituido;
X es seleccionado del grupo que consiste de hidrógeno y alquilo de C1-3 opcionalmente sustituido; T es C≥O;
U es NR1R2;
R1 y R2 son independientemente seleccionados del grupo que consiste de hidrógeno, alquilo opcionalmente sustituido, carbocíclico opcionalmente sustituido, heterocíclico opcionalmente sustituido,
arilo opcionalmente sustituido y heteroarilo opcionalmente sustituido;
R5 es COR7; y
R7 es -CH2CH(CH3)2;
o una sal farmacéuticamente aceptable de éste.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/060215.
Solicitante: THE REGENTS OF THE UNIVERSITY OF MICHIGAN.
Inventor/es: WANG,SHAOMENG, PENG,YUEFENG, SUN,HAIYING, CAI,QIAN, NIKOLOVSKA-COLESKA,ZANETA, LU,JIANFENG, QIU,SU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2504216_T3.pdf



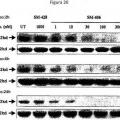
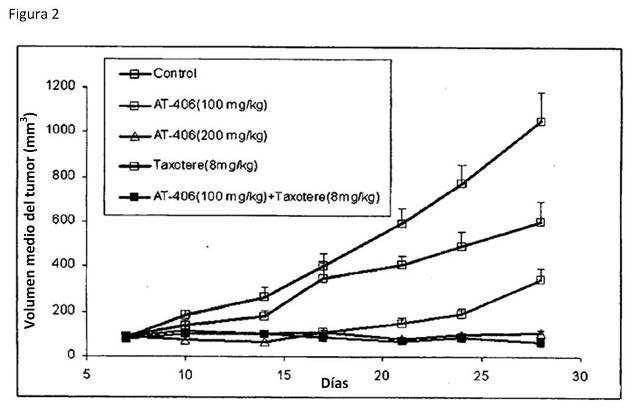
Fragmento de la descripción:
Miméticos de smac diazo bicíclicos y sus usos.
Antecedentes de la invención Campo de la invención Esta invención está en el campo de la química medicinal. Particularmente, la invención se relaciona con miméticos conformacionalmente restringidos de la secuencia N-terminal de Smac que funcionan como inhibidores de las proteínas inhibidoras de la Apoptosis. La invención además se relaciona con el uso de estos miméticos para inducir o sensibilizar las células a la inducción de la muerte celular apoptótica.
Técnica relacionada El fenotipo celular de cáncer agresivo es el resultado de una variedad de alteraciones genéticas y epigenéticas que conducen a la desregulación de las rutas de señalización intracelular (Ponder, Nature 411:336 (2001) ) . El común denominador de todas las células cancerosas, sin embargo, es su falla para ejecutar un programa apoptótico, y es un sello distintivo del cáncer la falta de apoptosis adecuada debido a defectos en la maquinaria normal de la apoptosis (Lowe y otros, Carcinogenesis 21:485 (2000) ) . Las terapias contra el cáncer más actuales, que incluyen agentes quimioterapéuticos, radiación e inmunoterapia, trabajan induciendo indirectamente la apoptosis en las células cancerosas. La incapacidad de las células cancerosas para ejecutar un programa apoptótico debido a defectos en la maquinaria apoptótica normal se asocia así frecuentemente con un aumento en la resistencia a la apoptosis inducida por quimioterapia, radiación o inmunoterapia. La resistencia primaria o adquirida de cáncer humano de diferentes orígenes a los protocolos actuales de tratamiento debido a defectos de la apoptosis es un problema importante en la terapia del cáncer actual (Lowe y otros, Carcinogenesis 21:485 (2000) ; Nicholson, Nature 407:810 (2000) ) . Como consecuencia, los esfuerzos actuales y futuros hacia el diseño y desarrollo de nuevas terapias contra el cáncer específicas al objetivo molecular para mejorar la supervivencia y calidad de la vida de pacientes con cáncer deben incluir estrategias que se dirigen específicamente a la resistencia de las células cancerosas a la apoptosis En este sentido, enfocar los reguladores negativos cruciales que juegan un papel central al inhibir directamente la apoptosis en las células cancerosas representa una estrategia terapéutica muy prometedora para el diseño del nuevo fármaco anticancerígeno.
Dos clases de reguladores negativos centrales de la apoptosis se han identificado. La primera clase de reguladores es la familia de proteínas Bcl-2, según de ejemplifica por dos moléculas anti-apoptóticas potentes, las proteínas Bcl-2 y Bcl-XL (Adams y otros., Science 281:1322 (1998) ; Reed, Adv. Pharmacol. 41:501 (1997) ; Reed y otros, J. Cell. Biochem. 60:23 (1996) ) . Las estrategias terapéuticas para enfocar Bcl-2 y Bcl-XL en el cáncer para restablecer la sensibilidad de células cancerosas y superar la resistencia de las células cancerosas a la apoptosis se ha revisado ampliamente (Adams y otro., Science 281:1322 (1998) ; Reed, Adv. Pharmacol. 41:501 (1997) ; Reed y otros, J. Cell. Biochem. 60:23 (1996) ) . Varios laboratorios se interesan en diseñar inhibidores de molécula pequeña de Bcl -2 y Bcl-XL.
La segunda clase de reguladores negativos centrales de la apoptosis es el inhibidor de las proteínas de la apoptosis (IAPs) (Deveraux y otros, Genes Dev. 13:239 (1999) ; Salvesen y otros, Nat. Rev. Mol. Cell. Biol. 3:401 (2002) ) . Esta clase incluye proteínas tales como XIAP, cIAP-1, cIAP-2, ML-IAP, HIAP, KIAP, TSIAP, NAIP, survivina, livina, ILP-2, apollon, y BRUCE. Las proteínas IAP suprimen potentemente la apoptosis inducidas por una gran variedad de estímulos apoptóticos, que incluyen agentes quimioterapéuticos, radiación, e inmunoterapia en las células cancerosas.
IAP del cruzamiento X (XIAP) es el inhibidor más potente en la supresión de la apoptosis entre todos los miembros de IAP (Holcik y otros, Apoptosis 6:253 (2001) ; LaCasse y otros, Oncogene 17:3247 (1998) ; Takahashi y otros, J. Biol. Chem. 273:7787 (1998) ; Deveraux y otros, Nature 388:300 (1997) ; Sun y otros, Nature 401:818 (1999) ; Deveraux y otros, EMBO J. 18:5242 (1999) ; Asselin y otros, Cancer Res. 61:1862 (2001) ) . XIAP juega un papel clave en la regulación negativa de la apoptosis tanto las rutas mediada por el receptor para la muerte como mediadas por mitocondrias. XIAP funciona como un potente inhibidor endógeno de la apoptosis uniendo directamente e inhibiendo potentemente tres miembros de la familia de las enzimas caspasa, caspasa-3, -7, y -9 (Takahashi y otros, J. Biol. Chem. 273:7787 (1998) ; Deveraux y otros, Nature 388:300 (1997) ;Sun y otros, Nature 401:818 (1999) ; Deveraux y otros, EMBO J. 18:5242 (1999) ; Asselin y otros, Cancer Res. 61:1862 (2001) ; Riedl y otros, Cell 104:791 (2001) ; Chai y otros, Cell 104:769 (2001) ; Huang y otros, Cell 104:781 (2001) ) . XIAP contiene tres dominios repetitivos de baculovirus (BIR) inhibidores de la apoptosis, así como un C-terminal dedo RING. El tercer dominio BIR (BIR3) se dirige selectivamente a la caspasa-9, la caspasa iniciadora en la ruta mitocondrial, mientras que la región de enlace entre BIR1 y BIR2 inhibe tanto la caspasa-3 como la caspasa-7 (Salvesen y
otros, Nat. Rev. Mol. Cell. Biol. 3:401 (2002) ) . Mientras que la unión a XIAP previene la activación de las tres caspasas, es evidente que la interacción con la caspasa-9 es el más crítica para su inhibición de la apoptosis (Ekert y otros, J. Cell Biol.
152:483 (2001) ; Srinivasula y otros, Nature 410:112 (2001) ) . Debido a que XIAP bloquea la apoptosis en la fase efectora corriente abajo, un punto donde convergen múltiples rutas de señalización, las estrategias que enfocan XIAP pueden demostrar ser especialmente eficaces para superar la resistencia de las células cancerosas a la apoptosis (Fulda y otros, Nature Med. 8:808 (2002) ; Arnt y otros, J. Biol. Chem. 277:44236 (2002) ) .
Aunque la función precisa de XIAP en cada tipo de cáncer está lejos de ser completamente entendida, se acumula evidencia para indicar que XIAP se sobreexpresa ampliamente en muchos tipos de cáncer y puede desempeñar un papel importante en la resistencia de las células cancerosas a una variedad de agentes terapéuticos actuales (Holcik y otros, Apoptosis 6:253 (2001) ; LaCasse y otros, Oncogene 17:3247 (1998) ) .
La proteína XIAP se encontró que se expresa en la mayoría de las líneas celulares de cáncer humano NCI 60 (Tamm y otros, Clin. Cancer Res. 6:1796 (2000) ) . El análisis de las muestras de tumores en 78 pacientes no tratados previamente demostró que aquellos con niveles inferiores de XIAP tuvieron supervivencia significativamente más larga (Tamm y otros, Clin. Cancer Res. 6:1796 (2000) ) . XIAP se encontró que se expresa en el glioma maligno humano (Wagenknecht y otros, Cell Death Differ. 6:370 (1999) ; Fulda y otros, Nature Med. 8:808 (2002) ) . XIAP se encontró que se expresa en células cancerosas de próstata humano y bloquea la apoptosis relacionada con ligando Apo2/factor de necrosis tumoral induciendo la apoptosis mediada por ligando de las células cancerosas de próstata en presencia de activación mitocondrial (McEleny y otros, Prostate 51:133 (2002) ; Ng y otros, Mol. Cancer Ther. 1:1051 (2002) ) . XIAP se sobreexpresa en cáncer de pulmón de células no pequeñas (NSCLC) en los pacientes y se ha implicado en la patogénesis de NSCLC (Hofmann y otros, J. Cancer Res. Clin. Oncol. 128:554 (2002) ) . La expresión de XIAP y la falta de regulación negativa de XIAP tras el tratamiento con cisplatino se han implicado en la resistencia a cisplatino de cáncer de ovario humano (Li y otros, Endocrinology 142:370 (2001) ; Cheng y otros, Drug Resist. Update 5:131 (2002) ) . Tomados conjuntamente, estos datos sugieren que XIAP puede jugar un papel importante en la resistencia de varios cánceres humanos a los agentes terapéuticos actuales.
La integridad de la pared del vaso sanguíneo es esencial para la homeostasis vascular y la función del órgano. Un equilibrio dinámico entre la supervivencia de la célula endotelial y la apoptosis contribuye a esta integridad durante el desarrollo vascular y la angiogénesis patológica. Se ha demostrado que la cIAP-1 es esencial para mantener la supervivencia de la célula endotelial y la homeostasis del vaso sanguíneo durante el desarrollo vascular (Santoro y otros, Nature Genetics 39:1397 (2007) . Como tal, la cIAP-1 puede jugar un papel importante en el control de la angiogénesis y la homeostasis del vaso sanguíneo durante la embriogénesis, regeneración y tumorigénesis.
La apoptosis no es un proceso único, más bien, se implica con un número de diferentes rutas de señalización, a veces interconectadas, que conducen a la degradación celular. Las rutas implicadas en una... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto que tiene la Fórmula VI:
en donde:
A1 y A2 son independientemente seleccionados del grupo que consiste de hidrógeno y alquilo opcionalmente sustituido; X es seleccionado del grupo que consiste de hidrógeno y alquilo de C1-3 opcionalmente sustituido; T es C=O; U es NR1R2; R1 y R2 son independientemente seleccionados del grupo que consiste de hidrógeno, alquilo opcionalmente sustituido, carbocíclico opcionalmente sustituido, heterocíclico opcionalmente sustituido, arilo opcionalmente sustituido y heteroarilo opcionalmente sustituido; R5 es COR7; y R7 es -CH2CH (CH3) 2;
o una sal farmacéuticamente aceptable de éste.
2. El compuesto de la reivindicación 1, en donde R1 es alquilo opcionalmente sustituido en donde los sustituyentes opcionales son arilo opcionalmente sustituido con uno o más grupos de C1-6 alquilo, halo, haloalquilo o heteroarilo, R2 es hidrógeno, y R7es -CH2CH (CH3) 2, o una sal farmacéuticamente aceptable de estos.
3. El compuesto de la reivindicación 1 seleccionado del grupo que consiste de:
y
o una sal farmacéuticamente aceptable de este. 4. Un compuesto seleccionado del grupo que consiste de y
o la base libre de este u otra sal farmacéuticamente aceptable de este.
5. Un compuesto de acuerdo con la reivindicación 1 de la Fórmula:
o una sal farmacéuticamente aceptable de este.
6. Una composición farmacéutica que comprende el compuesto de cualquiera de las reivindicaciones 1 a 5, o una sal farmacéuticamente aceptable de estos, y un portador farmacéuticamente aceptable.
7. El compuesto de cualquiera de las reivindicaciones 1 a 5, o una sal farmacéuticamente aceptable de este, para uso en un método para tratar, mejorar, o prevenir un trastorno sensible a la inducción de apoptosis en un animal
8. El compuesto de cualquiera de las reivindicaciones 1 a 5, o una sal farmacéuticamente aceptable de este, para uso en un método para tratar, mejorar, o prevenir el cáncer en un animal.
9. El compuesto para uso de la reivindicación 8, en donde dicho método para tratar, mejorar o prevenir comprende además administrar un agente contra el cáncer.
10. El compuesto para uso de la reivindicación 8, en donde dicho método para tratar, mejorar o prevenir comprende además administrar un agonista de TRAIL-R1 o TRAIL-R2.
11. El compuesto para uso de la reivindicación 10, en donde dicho agonista de TRAIL-R1 o TRAIL-R2 es un anticuerpo.
12. El compuesto para uso de cualquiera de las reivindicaciones 8-11, en donde dicho cáncer se selecciona del grupo que consiste de cáncer de mama, cáncer de ovario, cáncer de próstata, cáncer pancreático, leucemia, melanoma, cáncer de colon, cáncer de hígado, mieloma múltiple, carcinoma de célula renal, leucemia linfocítica aguda, leucemia linfocítica crónica, leucemia mielógena aguda, y sarcoma de tejidos blandos.
13. El compuesto de cualquier una de las reivindicaciones 1 a 5, o una sal farmacéuticamente aceptable de este, de uso en un método para prevenir o inhibir la angiogénesis en un animal.
14. Un estuche que comprende el compuesto de cualquier una de las reivindicaciones 1 a 5, o una sal farmacéuticamente aceptable de este, e instrucciones para administrar dicho compuesto a un animal.
15. El estuche de la reivindicación 14, comprende además un agente contra el cáncer.
16. Un proceso para preparar un compuesto de la Fórmula VI como enumerado en la reivindicación 1 que comprende condensar un compuesto de la Fórmula XII
en donde A1, A2, X, T, y U tienen los significados que se exponen en la reivindicación 1; con R7CO-L, en donde:
V es N;
W es CH;
Y es NHCO;
Z es (CR1R2) r cuando r es 0;
m es 1;
R7 es -CH2CH (CH3) 2; y
L es un grupo saliente, para formar un compuesto de la Fórmula VI.
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]