METODOS PARA MEDIR LA ACTIVIDAD DE ADAMTS13 EN LA SUPERFICIE DE LAS PLAQUETAS.
Método para medir la actividad de ADAMTS13 en la superficie de las plaquetas que comprende:
a) incubar una muestra que comprende ADAMTS13 con un sustrato, en el que la muestra es plaquetas lavadas, en el que el sustrato comprende un resto peptídico y un resto cromogénico, en el que el resto peptídico comprende X-Val-Tyr, X-Leu-Tyr o X-De-Tyr, en los que X es cualquier aminoácido, en el que la longitud del péptido es de 3 a 20 aminoácidos de longitud, con la condición de que el resto cromogénico no sea para- nitronilina (pNA); y b) medir la densidad óptica de la muestra; midiendo de ese modo la actividad de ADAMTS 13 en la superficie de las plaquetas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/023177.
Solicitante: AMERICAN DIAGNOSTICA INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 500 WEST AVENUE P.O. BOX 110215 STAMFORD, CT 06911-0215 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GREENFIELD, ROBERT S., RANZURMAL,SAFI.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Julio de 2004.
Fecha Concesión Europea: 19 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C12Q1/56 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen factores de coagulación de la sangre, p. ej. trombina, tromboplastina, fibrinógeno.
- G01N33/566 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › utilizando un soporte específico o proteínas receptoras como reactivos para la formación de uniones por ligando.
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La invención proporciona ensayos para la medición de la actividad de ADAMTS13 y el diagnóstico de la púrpura trombocitopénica trombótica.
ANTECEDENTES DE LA INVENCIÓN
La púrpura trombocitopénica trombótica (PTT) es una enfermedad microangiopática trombótica potencialmente mortal caracterizada por anemia hemolítica y trombocitopenia asociada con agregación plaquetaria. La causa de la PTT se ha relacionado recientemente con anomalías en una metaloproteinasa denominada ADAMTS 13 o proteasa de escisión del factor de von Willebrand. ADAMTS 13 es una enzima que está presente en niveles significativos en plasma, y puede expresarse en otros tejidos (Levy et al. 2001, Nature 413:488-494; Plaimauer et al. 2002, Blood 100:3626-3632). Suzuki et al. (2004, Biochem. Biophys. Res. Com. 313:212-216) informaron recientemente sobre ADAMTS 13 en plaquetas.
ADAMTS 13 funciona escindiendo multímeros del factor de von Willebrand (FVW) ultragrandes en proteínas de FVW más pequeñas. La disminución de la actividad proteasa de escisión de FVW conduce a la persistencia de multímeros inusualmente grandes de FVW que se unen a las plaquetas, provocando agregados plaquetarios, hemólisis microangiopática y trombocitopenia en pacientes con PTT. Las manifestaciones clínicas de PTT son difíciles de distinguir del síndrome urémico hemolítico (SUH), otro trastorno trombótico microangiopático. Estudios recientes indican que bajos niveles de actividad de ADAMTS13 se asocian con PTT, más no con SUH (Veyradier A, et al. 2002, Blood 98:1765-1772; Furlan et al. 1998, Blood 91:2839-2846). Por tanto, puede realizarse el diagnóstico diferencial de PTT midiendo la actividad de ADAMTS 13.
Existen dos formas de PTT, congénita (familiar) y adquirida (Furlan et al. 1996, Blood 87:4223-4234; Furlan et al. 1998, Blood 91:2839-2846). La PTT congénita está causada por mutaciones genéticas en el gen ADAMTS 13, que da como resultado una pérdida en la producción de ADAMTS 13 y/o la producción de una enzima ADAMTS 13 no funcional. La PTT adquirida es una enfermedad de tipo autoinmunitaria, que se ha relacionado con la ingestión de determinados agentes farmacéuticos. La PTT adquirida está causada por la generación de autoanticuerpos frente a la proteína ADAMTS 13. El comienzo de la PTT adquirida se ha relacionado con la ingestión de determinados agentes farmacéuticos.
En la técnica se conocen diversos métodos para medir la presencia y/o la actividad de ADAMTS 13. Estos métodos incluyen ensayos de unión a colágeno, ensayos con cofactor de ristocetina, análisis electroforético (por ejemplo, análisis de multímeros) y métodos inmunológicos. Los inmunoensayos electroforéticos, tales como análisis de inmunotransferencia de tipo Western, se han reemplazado en gran medida por ensayos inmunorradiométricos (IRMA) y ensayos de inmunosorción ligados a enzimas (ELISA) (Laffan et al. 2004, Haemophilia 10:199-217). Varios informes describen ensayos de ADAPTS13 en los que se usa el domino A2 de FVW como sustrato (Zhou et al. 2004, Thromb. Haemost. 91:806-811; Kokame et al. 2004, Hemost. Thromb. Vasc. Biol. Blood 103:607-612; Cruz et al. 2004, Thromb. Haemost. 90:1204-1209). La escisión del domino A2 se monitoriza mediante un método de ELISA. Los ensayos disponibles para ADAMTS 13 requieren un nivel de experiencia técnica relativamente alto, y por tanto no se realizan en la mayoría de laboratorios clínicos. Además, la obtención de resultados puede llevar varios días usando las pruebas disponibles, lo que es perjudicial para los pacientes que presentan PTT, quienes requieren un diagnóstico rápido.
El documento WO 2004/035778 se refiere a un método para medir ADAMTS13 plasmático.
El documento WO 02/10437 describe un método de detección de proteasa de escisión de FVW usando FVW monomérico.
Para resolver los problemas de los ensayos disponibles actualmente se necesita un ensayo sencillo, específico y rápido para ADAMTS 13; sin embargo, se ha desarrollado ninguno hasta la fecha. Los intentos de desarrollar un ensayo de este tipo usando ADAMTS 13 aislado de plasma no han sido satisfactorios. Furlan et al. sometieron a prueba 28 sustratos de peptidilo cromogénicos sintéticos con para-nitroanilina (pNA) como grupo saliente, y no observaron resultados sistemáticos, repetibles (2002 Seminars in Thrombosis and Hemostasis 28(2):167-172). Estos resultados demostraron la dificultad en la técnica para desarrollar un ensayo rápido, fiable para determinar la actividad de ADAMTS 13.
Se ha descubierto que ADAMTS13 en plaquetas tiene una capacidad potenciada, en relación con ADAMTS 13 en plasma, para escindir pequeños sustratos de peptidilo. La diferencia entre el ADAMTS13 plasmático y plaquetario probablemente se deba al hallazgo de que el ADAMTS13 plaquetario se escinde, mientras que el ADAMTS13 plasmático no se escinde y permanece como un solo polipéptido. La actividad de ADAPTS13 puede potenciarse en plaquetas tratando con el factor de coagulación XIa (FXIa). Esto indica que el FXI activado (FXIa) puede provocar la escisión de ADAMTS13. Se han desarrollado ensayos cromogénicos de diagnóstico para medir la actividad de ADAMTS13 en plaquetas y en plasma usando diferentes sustratos de peptidilo con grupos salientes distintos a pNA. También se ha desarrollado un método de ensayo para medir autoanticuerpos frente a ADAMTS13 y un ELISA para medir la proteína ADAMTS13 en plasma.
SUMARIO DE LA INVENCIÓN
En un aspecto, la invención proporciona un método para medir la actividad de ADAMTS13 en la superficie de las plaquetas según la reivindicación 1.
En un aspecto adicional, la invención proporciona un método para identificar un inhibidor de ADAMTS13 en la superficie de las plaquetas según la reivindicación 7.
En otro aspecto la invención proporciona un uso del método para medir la actividad de ADAMTS13 de la invención para diagnosticar PTT en un sujeto según la reivindicación 15.
Aún en otro aspecto, la invención proporciona un uso del método para medir la actividad de ADAMTS13 de la invención para diagnosticar PTT adquirida en un sujeto según la reivindicación
23.
La invención proporciona adicionalmente un uso del método para medir la actividad de ADAMTS13 de la invención para monitorizar el tratamiento de un paciente con PTT según la reivindicación 29.
BREVE DESCRIPCIÓN DE LOS DIBUJOS
A continuación se describirá la presente invención a modo de ejemplo, haciéndose referencia a las siguientes figuras, en las que:
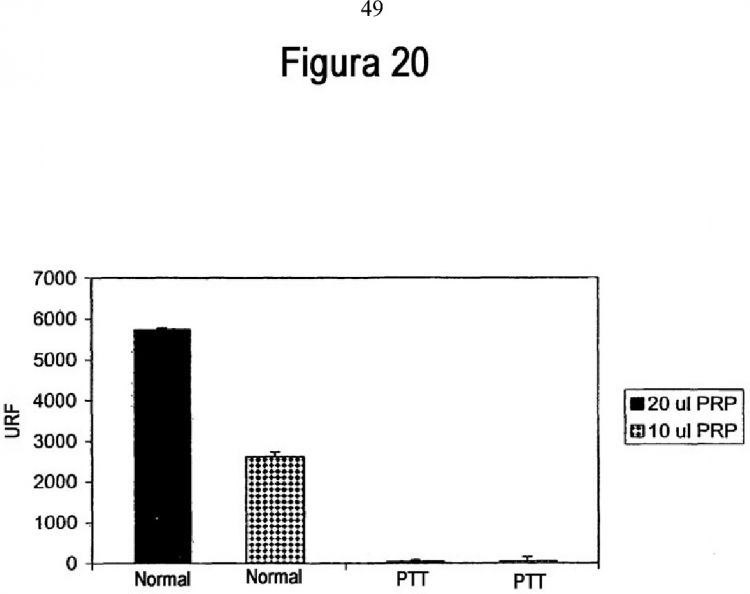
La figura 1 muestra la estructura de la forma plasmática de ADAMTS13. S: péptido señal; P: propéptido; Dis: región similar a desintegrina; Cys: región rica en Cys. También se muestran la región catalítica (metaloproteasa) y los dos dominios CUB. Se muestran las repeticiones de trombospondina de tipo I (TSP1) como círculos numerados. La figura 2 muestra LVY-pNA como un sustrato para ADAMTS13. La figura 3 muestra una comparación de sustratos LVY-AMC y Suc-LLVY-AMC para medir la actividad de ADAMTS 13. La figura 4 muestra la medición de la escisión de un sustrato de ADAMTS 13 usando transferencia de energía por resonancia de fluorescencia (FRET). Se incubó el sustrato, NH2-Arg-Lys(DABCYL)-NLVYMVTGD(EDANS)-Arg-COOH, con plaquetas normales, y se midió el aumento en la fluorescencia con el tiempo. La figura 5 muestra la actividad de ADAMTS13 en líquido de cultivo tisular de células HEK 293 transfectadas de manera simulada y transfectadas con ADAMTS13. Se midió la actividad usando sustrato fluorescente Suc-LLVY-AMC.
La figura 6 muestra una comparación de la actividad de ADAMTS 13 en plasma de sujetos normales y de sujetos con PTT adquirida usando sustrato fluorescente Suc-LLVY-AMC. La figura 7 muestra la cuantificación de la actividad de ADAMTS 13 en PRP de sujetos normales () y sujetos con PTT adquirida (♦). La figura 8 muestra la medición de la actividad de ADAMTS13 en plasma rico en plaquetas (PRP) y plasma pobre en plaquetas (PPP) de seis muestras individuales tomadas de sujetos normales. Se midió la actividad de ADAMTS 13 usando sustrato fluorescente Suc-LLVYAMC. La figura 9 muestra una comparación de la actividad de ADAMTS 13 por mg de proteína en plaquetas de sujetos normales y sujetos con PTT adquirida. La figura 10 muestra la inmunotinción de inmunotransferencias de tipo Western de proteínas plaquetarias de diversos anticuerpos anti-ADAMTS 13. La figura 10A muestra...
Reivindicaciones:
1. Método para medir la actividad de ADAMTS13 en la
superficie de las plaquetas que comprende: a) incubar una muestra que comprende ADAMTS13 con un sustrato, en el que la muestra es plaquetas lavadas, en el que el sustrato comprende un resto peptídico y un resto cromogénico, en el que el resto peptídico comprende X-Val-Tyr, X-Leu-Tyr o X-De-Tyr, en los que X es cualquier aminoácido, en el que la longitud del péptido es de 3 a 20 aminoácidos de longitud, con la condición de que el resto cromogénico no sea paranitronilina (pNA); y b) medir la densidad óptica de la muestra;
midiendo de ese modo la actividad de ADAMTS 13 en la superficie de las plaquetas.
2. Método según la reivindicación 1, en el que X es Leu.
3. Método según la reivindicación 1, en el que el resto peptídico es Leu-Val-Tyr.
4. Método según la reivindicación 1, en el que el resto peptídico es Leu-Leu-Val-Tyr.
5. Método según la reivindicación 1, en el que el resto peptídico es Suc-Leu-Leu-Val-Tyr.
6. Método según la reivindicación 1, en el que el resto cromogénico se selecciona del grupo que consiste en sbencilo, ácido 5-amino-2-nitrobenzoico y 6-amino-1naftalenosulfonamidas.
7. Método para identificar un inhibidor de ADAMTS 13 en la
superficie de las plaquetas que comprende: a) incubar una muestra que comprende ADAMTS13 en la superficie de las plaquetas con un inhibidor candidato de ADAPTS13, en el que la muestra es plaquetas lavadas; y b) medir la actividad de ADAMTS13 en la muestra de prueba según el método de la reivindicación 1;
en el que se identifica al inhibidor mediante la actividad de ADAMTS 13 reducida en la superficie de las plaquetas en la muestra en comparación con la actividad de ADAMTS13 en
la superficie de las plaquetas en una muestra control que comprende ADAMTS13 en la superficie de las plaquetas, en el que la muestra control es plaquetas lavadas, y en el que la muestra control no se incubó con el inhibidor candidato.
8. Método según la reivindicación 7, en el que X es Leu.
9. Método según la reivindicación 7, en el que el resto peptídico es Leu-Val-Tyr.
10. Método según la reivindicación 7, en el que el resto peptídico es Leu-Leu-Val-Tyr.
11. Método según la reivindicación 7, en el que el resto peptídico es Suc-Leu-Leu-Val-Tyr.
12. Método según la reivindicación 7, en el que el resto cromogénico se selecciona del grupo que consiste en sbencilo, ácido 5-amino-2-nitrobenzoico y 6-amino-1naftalenosulfonamidas.
13. Método según la reivindicación 7, en el que el inhibidor candidato procede de una biblioteca de compuestos químicos, una biblioteca de presentación en fago, una biblioteca de químicos naturales o una biblioteca de química combinatoria.
14. Método según la reivindicación 7, en el que el inhibidor es un anticuerpo.
15. Uso del método según la reivindicación 1 para diagnosticar púrpura trombocitopénica trombótica (PTT) en un sujeto, en el que se mide la actividad de ADAMTS 13 en la superficie de las plaquetas en una muestra de prueba del sujeto según el método de la reivindicación 1, en el que la muestra de prueba es plaquetas lavadas; y en el que el método comprende además
c) comparar la actividad de ADAMTS 13 en la superficie de las plaquetas en la muestra de prueba con respecto a la actividad de ADAMTS 13 en la superficie de las plaquetas en una muestra control que tiene actividad de ADAMTS13 normal en la superficie de las plaquetas, en el que la muestra control es plaquetas lavadas;
en el que se diagnóstica PTT mediante la actividad de ADAMTS 13 reducida en la superficie de las plaquetas en la muestra de prueba en comparación con la muestra control.
16. Uso según la reivindicación 15, en el que X es Leu.
17. Uso según la reivindicación 15, en el que el resto peptídico es Leu-Val-Tyr.
18. Uso según la reivindicación 15, en el que el resto peptídico es Leu-Leu-Val-Tyr.
19. Uso según la reivindicación 15, en el que el resto peptídico es Suc-Leu-Leu-Val-Tyr.
20. Uso según la reivindicación 15, en el que el resto cromogénico se selecciona del grupo que consiste en sbencilo, ácido 5-amino-2-nitrobenzoico y 6-amino-1naftalenosulfonamidas.
21. Uso según la reivindicación 15, en el que la PTT es congénita.
22. Uso según la reivindicación 15, en el que la PTT es adquirida.
23. Uso del método según la reivindicación 1 para diagnosticar PTT adquirida en un sujeto, en el que se incuba una muestra que comprende ADAMTS13 en la superficie de las plaquetas con plasma del sujeto, en el que la muestra es plaquetas lavadas; y en el que se mide la actividad de ADAPTS13 en la superficie de las plaquetas en la muestra según el método de la reivindicación 1; en el que se diagnóstica PTT adquirida mediante la actividad de ADAMTS 13 reducida en la superficie de las plaquetas en la muestra en comparación con la actividad de ADAMTS 13 en la superficie de las plaquetas en una muestra control que tiene actividad de ADAMTS13 normal en la superficie de las plaquetas.
24. Uso según la reivindicación 23, en el que X es Leu.
25. Uso según la reivindicación 23, en el que el resto peptídico es Leu-Val-Tyr.
26. Uso según la reivindicación 23, en el que el resto peptídico es Leu-Leu-Val-Tyr.
27. Uso según la reivindicación 23, en el que el resto peptídico es Suc-Leu-Leu-Val-Tyr.
28. Uso según la reivindicación 23, en el que el resto cromogénico se selecciona del grupo que consiste en s
5 bencilo, ácido 5-amino-2-nitrobenzoico y 6-amino-1naftalenosulfonamidas.
29. Uso del método según la reivindicación 1 para monitorizar el tratamiento de un paciente con PTT, en el que se mide la actividad de ADAMTS 13 en la superficie de las plaquetas según el método de la reivindicación 1 durante el tratamiento del paciente.
30. Uso según la reivindicación 29, en el que el tratamiento es plasmaféresis.
31. Uso según la reivindicación 30, en el que el paciente
15 tiene PTT adquirida y en el que la plasmaféresis elimina los inhibidores de ADAMTS13 del paciente.
32. Método según la reivindicación 1, que comprende además añadir factor de coagulación XIa a la muestra.
Patentes similares o relacionadas:
Anticuerpos ANTI-GITR para diagnóstico de cáncer, del 3 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un método para determinar el nivel de expresión del receptor de TNF inducible por glucocorticoides (GITR) en linfocitos infiltrantes de tumores (TIL) […]
ARN no codificantes y usos de los mismos, del 29 de Abril de 2020, de THE REGENTS OF THE UNIVERSITY OF MICHIGAN: Un procedimiento de selección de la presencia de cáncer en un sujeto, que comprende (a) poner en contacto una muestra biológica de un […]
Líneas celulares para el cribado de receptores de aroma y olor, del 1 de Abril de 2020, de FIRMENICH SA: Una célula que comprende un ADN donante introducido en el sitio objetivo genómico corriente arriba de un locus del gen de RTP1 endógeno, en la […]
Procedimientos para determinar diferencias en la actividad de la integrina alfa-4 mediante correlación de diferencias en niveles de sVCAM y/o sMAdCAM, del 18 de Marzo de 2020, de Biogen MA Inc: Un procedimiento in vitro para determinar una diferencia en la actividad de la integrina alfa-4 en un individuo con una enfermedad o trastorno […]
Kits y ensayos de diagnóstico para la detección del receptor 1 de folato, del 4 de Marzo de 2020, de IMMUNOGEN, INC.: Un anticuerpo o fragmento de unión a antígeno del mismo que se une específicamente a FOLR1, en donde dicho anticuerpo o fragmento de unión a antígeno del mismo […]
Métodos y dispositivos relacionados con la detección de biomarcadores de cáncer oral, del 4 de Marzo de 2020, de Global Life Sciences Solutions Operations UK Ltd: Un método ex vivo para detectar diversos biomarcadores en un material biológico presente en una cavidad oral humana cuando hay presente una actividad […]
Material nanoestructurado con propiedades interferométricas para la detección visual de ensayos de bioreconocimiento sin marcaje, del 28 de Febrero de 2020, de UNIVERSITAT POLITECNICA DE VALENCIA: Material nanoestructurado con propiedades interferométricas para la detección visual de ensayos de bioreconocimiento sin marcaje. La presente invención se refiere a un […]
Aislamiento de ARNmicro de fluido biológico, del 22 de Enero de 2020, de Sigma-Aldrich Co. LLC: Un método para aislar ARNmicro (ARNmi) de un fluido biológico, el método comprende (a) poner en contacto el fluido biológico con un agente tensioactivo […]