METODOS PARA LA IDENTIFICACION DE LOS COMPUESTOS INHIBIDORES DE LA LIBERACION DEL PEPTIDO BETA-AMILOIDE (BETAAP).
Método in vitro para identificar inhibidores de la producción del péptido ß-amiloide (ßAP),
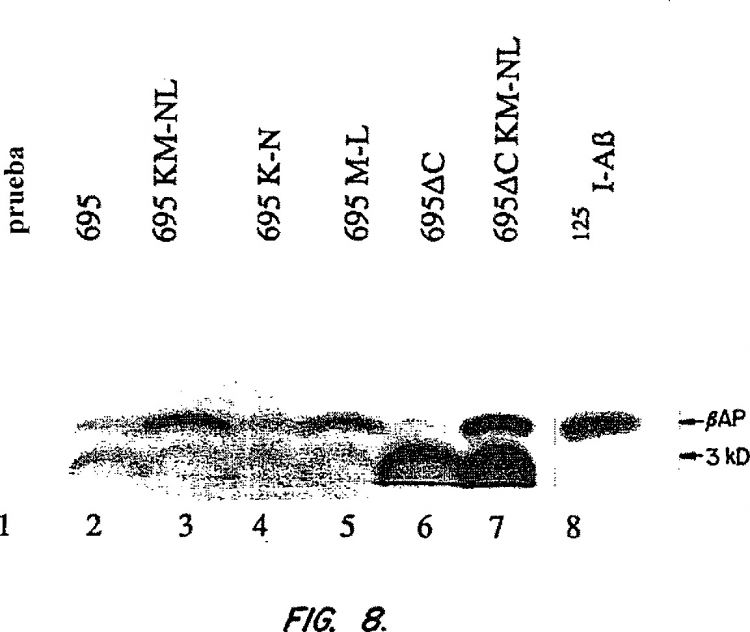
comprendiendo dicho método cultivar células de mamífero en un medio de cultivo en condiciones que provocan la producción de un péptido ßAP soluble que puede detectarse en el medio de cultivo, en el que las células de mamífero cultivadas son de una línea celular que comprende ADN que codifica una variante sueca de la proteína precursora amiloide (APP) que es una doble mutación Lys595 Asn595 y Met596 Leu596 con referencia a APP695 y que proporciona producción en exceso de ßAP en las células de mamífero cultivadas; exponer las células cultivadas a un compuesto de ensayo; y determinar si el compuesto de ensayo afecta a la cantidad de ßAP soluble presente en el medio de cultivo
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E02079139.
Solicitante: ELAN PHARMACEUTICALS, INC.
THE BRIGHAM AND WOMEN'S HOSPITAL, INC.
ELI LILLY AND COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 800 GATEWAY BOULEVARD,SOUTH SAN FRANCISCO, CA 94080.
Inventor/es: SELKOE, DENNIS, J., SEUBERT, PETER, A., VIGO-PELFREY, CARMEN, SCHENK, DALE, B., SCHLOSSMACHER, MICHAEL, G.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Septiembre de 1993.
Fecha Concesión Europea: 14 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K14/47A3
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
- G01N33/68V2
Clasificación PCT:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda.
Fragmento de la descripción:
Métodos para la identificación de los compuestos inhibidores de la liberación del péptido ß-amiloide (ßAP).
Antecedentes de la invención
La presente invención se refiere a métodos de detección para la identificación de inhibidores de la producción de ßAP, en los que se detecta ßAP in vitro o in vivo.
La enfermedad de Alzheimer (AD) es un trastorno degenerativo del cerebro caracterizado clínicamente por la pérdida progresiva de memoria, cognición, razonamiento, juicio y estabilidad emocional que conduce gradualmente a un deterioro mental profundo y finalmente a la muerte. La AD es una causa muy común de insuficiencia mental progresiva (demencia) en personas mayores y se cree que representa la cuarta causa de muerte médica más común en los Estados Unidos. La AD se ha observado en razas y grupos étnicos de todo el mundo y presenta un problema principal de salud pública actual y futuro. Se estima que la enfermedad afecta actualmente a aproximadamente de dos a tres millones de personas solamente en los Estados Unidos. La AD es incurable en la actualidad. No se conoce actualmente ningún tratamiento que evite de forma eficaz la AD o invierta sus síntomas y evolución.
Los cerebros de pacientes con AD muestran lesiones características llamadas placas seniles (o amiloides), angiopatía amiloide (depósitos amiloides en los vasos sanguíneos) y nudos neurofibrilares. Una gran cantidad de estas lesiones, particularmente las placas amiloides y los nudos neurofibrilares, se hallan generalmente en varias áreas del cerebro humano importantes para la función de la memoria y cognitiva en pacientes con AD. También se hallan una menor cantidad de estas lesiones en una distribución anatómica más restringida en los cerebros de seres humanos de más edad que tienen AD clínica. Las placas amiloides y la angiopatía amiloide también caracterizan los cerebros de pacientes con trisomía 21 (síndrome de Down) y la hemorragia cerebral hereditaria con amiloidosis de tipo holandés (HCHWA-D). En la actualidad, un diagnóstico definitivo de AD requiere habitualmente observar las lesiones mencionadas anteriormente en el tejido cerebral de pacientes que han muerto con la enfermedad o, en raras ocasiones, en pequeñas muestras de biopsia de tejido cerebral tomadas durante un procedimiento neuroquirúrgico invasivo.
El principal constituyente químico de las placas amiloides y de los depósitos amiloides vasculares (angiopatía amiloide) característico de AD y de otros trastornos mencionados anteriormente es una proteína de aproximadamente 4,2 kilodalton (kD) de aproximadamente 39 a 43 aminoácidos denominada péptido ß-amiloide (ßAP) o a veces Aß, AßP o ß/A4. ßAP se purificó por primera vez y se presentó una secuencia parcial de aminoácidos en Glenner y Wong (1984) Biochem. Biophys. Res. Commun. 120:885-890. El procedimiento de aislamiento y los datos de secuencia para los primeros 28 aminoácidos se describen en la patente US nº 4.666.829.
Los análisis de biología molecular y química proteica realizados durante los últimos seis años han demostrado que ßAP es un fragmento pequeño de una proteína precursora mucho más grande, denominada proteína precursora ß-amiloide (APP), que se produce normalmente en células de muchos tejidos de diversos animales, incluyendo los seres humanos. El conocimiento de la estructura del gen que codifica APP ha demostrado que ßAP surge como un fragmento peptídico que se escinde de APP por enzimas hasta ahora desconocidas (proteasas). Se desconoce actualmente el mecanismo bioquímico preciso por el cual se escinde el fragmento ßAP de APP y posteriormente se deposita en forma de placas amiloides en el tejido cerebral y en las paredes de los vasos sanguíneos cerebrales y meníngeos.
Varias líneas de evidencias indican que la deposición progresiva cerebral de ßAP desempeña una tarea fundamental en la patogénesis de AD y puede preceder a los síntomas cognitivos durante años o décadas (para una revisión, véase Selkoe (1991) Neuron 6:487). La única línea más importante de evidencias es el descubrimiento en 1991 de que se pueden encontrar mutaciones con pérdida de sentido del ADN en el aminoácido 717 de la isoforma de 770 aminoácidos de APP en miembros afectados pero no en miembros no afectados de varias familias con una forma genéticamente determinada (familiar) de AD (Goate et al. (1991) Nature 349:704-706; Chartier Harlan et al., (1991) Nature 353:844-846; y Murrell et al., (1991) Science 254:97-99) y se denomina variante sueca. Se informó de una doble mutación que cambia la lisina595-metionina596 a asparagina595-leucina596 (en referencia a la isoforma 695) hallada en una familia sueca en 1992 (Mullan et al., (1992) Nature Genet. 1:345-347). Los análisis de unión genética han demostrado que estas mutaciones, así como ciertas mutaciones diferentes en el gen de APP, son la causa molecular específica de AD en los miembros afectados de dichas familias. Además, se ha identificado una mutación en el aminoácido 693 de la isoforma de 770 aminoácidos de APP como la causa de la enfermedad de deposición de ßAP, HCHWA-D y parece que un cambio de alanina a glicina en el aminoácido 692 causa un fenotipo que se parece a AD en algunos pacientes pero a HCHWA-D en otros. El descubrimiento de éstas y otras mutaciones en APP en casos genéticamente basados de AD demuestra que la alteración de APP y la posterior deposición de su fragmento ßAP pueden causar AD.
A pesar de los progresos en la comprensión de los mecanismos subyacentes de AD y de otras enfermedades relacionadas con ßAP, sigue existiendo la necesidad de desarrollar métodos y composiciones para el diagnóstico y el tratamiento de la(s) enfermedad(es). Los métodos de tratamiento podrían estar basados ventajosamente en fármacos que puedan inhibir la generación de ßAP in vivo. Para identificar dichos fármacos, sería deseable proporcionar ensayos de detección para fármacos potenciales que puedan inhibir la generación de ßAP en modelos in vivo e in vitro. Sería adicionalmente deseable proporcionar métodos y composiciones para el diagnóstico de afecciones relacionadas con ßAP, en los que el diagnóstico esté basado en la identificación de ßAP en muestras fluidas del paciente. Los ensayos específicos para la detección de ßAP deben poder detectar ßAP en muestras fluidas a muy bajas concentraciones así como de distinguir entre ßAP y otros fragmentos de APP que pueden estar presentes en la muestra.
Glenner y Wong (1984) Biochem. Biophys. Res. Commun. 120:885-890 y la patente US nº 4.666.829, se han analizado anteriormente. La patente '829 sugiere el uso de un anticuerpo contra el fragmento ßAP de 28 aminoácidos para detectar el "polipéptido amiloide del Alzheimer" en una muestra del paciente y para diagnosticar AD. No se presentan datos que demuestren la detección o el diagnóstico.
Numerosos estudios bioquímicos de microscopía electrónica e inmunoquímica han informado de que ßAP es muy insoluble en soluciones fisiológicas a pH normal. Véase, por ejemplo, Glenner y Wong (1984) Biochem. Biophys. Res. Commun. 122:1131-1135; Masters et al. (1985) Proc. Natl. Acad. Sci. USA 82:4245-4249; Selkoe et al. (1986) J. Neurochem. 46:1820-1834; Joachim et al. (1988) Brain Research 474:100-111; Hilbich et al. (1991) J. Mol. Biol. 218:149-163; Barrow y Zagorski (1991) Science 253:179-182; y Burdick et al. (1992) J. Biol. Chem. 267:546-554. Además, esta insolubilidad está prevista por y es coherente con la secuencia de aminoácidos de ßAP que incluye un segmento de aminoácidos hidrófobos que constituye parte de la región que ancla la proteína precursora (APP) en las membranas lipídicas de las células. Se predice que proteínas hidrófobas de anclaje a lípidos, tales como ßAP, permanecen asociadas con membranas celulares o fragmentos de membrana y por tanto no están presentes en los fluidos extracelulares fisiológicos. Los estudios mencionados anteriormente y muchos otros han informado de la insolubilidad en solución fisiológica de ßAP nativo purificado a partir de depósitos amiloides cerebrales con AD o de péptidos sintéticos que contienen la secuencia ßAP La extracción de ßAP de depósitos amiloides cerebrales y su posterior solubilización ha requerido el uso de disolventes y desnaturalizantes potentes, no fisiológicos. Soluciones salinas fisiológicas tamponadas que imitan los fluidos extracelulares de tejidos humanos han...
Reivindicaciones:
1. Método in vitro para identificar inhibidores de la producción del péptido ß-amiloide (ßAP), comprendiendo dicho método cultivar células de mamífero en un medio de cultivo en condiciones que provocan la producción de un péptido ßAP soluble que puede detectarse en el medio de cultivo, en el que las células de mamífero cultivadas son de una línea celular que comprende ADN que codifica una variante sueca de la proteína precursora amiloide (APP) que es una doble mutación Lys595
2. Método según la reivindicación 1, en el que el efecto del compuesto de ensayo se determina comparando la acumulación de ßAP en el medio de cultivo durante un periodo de tiempo en ausencia del compuesto de ensayo con la acumulación de ßAP en el medio de cultivo en presencia del compuesto de ensayo durante el mismo periodo de tiempo.
3. Método según la reivindicación 1, que comprende cultivar una primera población de las células de mamífero en un medio de cultivo en condiciones que provocan la generación de un péptido ßAP soluble que puede detectarse en el medio de cultivo; cultivar una segunda población de las mismas células de mamífero en un segundo medio de cultivo en condiciones idénticas a las de la primera población, a excepción de que está presente el compuesto de ensayo en el segundo medio de cultivo; medir las cantidades de ßAP soluble presentes en los medios de cultivo de la primera población y la segunda población de células; y comparar las cantidades medidas de ßAP para determinar si el compuesto de ensayo ha tenido un efecto sobre la generación de péptido ßAP intacto soluble por las células cultivadas.
4. Método según cualquiera de las reivindicaciones 1 a 3, en el que las células cultivadas son de una línea celular humana.
5. Método según cualquiera de las reivindicaciones anteriores, en el que el compuesto de ensayo está presente en una concentración en el intervalo de 1 nM a 1 mM.
6. Método para identificar inhibidores de producción de ß-amiloide (ßAP), comprendiendo dicho método administrar un compuesto de ensayo a un hospedador transgénico mamífero no humano que comprende ADN que codifica una variante sueca de la proteína precursora amiloide (APP) que es una doble mutación Lys595
7. Método según la reivindicación 6, en el que el efecto del compuesto de ensayo se determina midiendo una cantidad basal de péptido ßAP soluble en un fluido corporal antes de administrar el compuesto de ensayo y volviendo a medir la cantidad de ßAP soluble en el fluido corporal después de dicha administración.
8. Método según la reivindicación 6 ó 7, en el que el hospedador transgénico mamífero se selecciona de entre el grupo constituido por monos, perros, conejos, cobayas, ratas y ratones.
9. Método según la reivindicación 8, en el que el hospedador transgénico es una rata o ratón.
10. Método según cualquiera de las reivindicaciones 6 a 9, en el que el hospedador transgénico mamífero es un hospedador transgénico que presenta susceptibilidad potenciada a la deposición de placas de ßAP en comparación con un mamífero de la misma especie que no comprende dicho ADN.
11. Método según cualquiera de las reivindicaciones 6 a 10, en el que el fluido corporal se selecciona de entre el grupo constituido por sangre, CSF, orina y fluido peritoneal.
12. Método según cualquiera de las reivindicaciones 6 a 11, en el que el compuesto de ensayo se administra por vía oral, tópica, intramuscular, intravenosa, subcutánea, intraventricular, o intraperitoneal.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Moléculas de unión con cadena J modificada, del 24 de Junio de 2020, de IGM BIOSCIENCES, INC: Una molécula de unión que comprende un anticuerpo de IgM, IgA, IgG/IgM o IgG/IgA con una cadena J modificada, donde la cadena J modificada comprende una cadena […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]