Métodos de control de la eficacia de los inhibidores de la farnesiltransferasa.
Un método para determinar una respuesta de un sujeto que padece sepsis o shock séptico al tratamiento con un inhibidor de la farnesil transferasa,
que comprende las etapas:
(i) medir un nivel de al menos un marcador seleccionado entre el grupo que consiste en proteínas identificadas en la Tabla 4 y en los transcriptos de los genes identificados en las Tablas 2 y 3 en una muestra de sangre sin tratar obtenida del sujeto antes del tratamiento con el inhibidor de la farnesil transferasa, y
(ii) medir un nivel del marcador en una muestra de sangre tratada obtenida del sujeto al menos una vez después del comienzo del tratamiento con el inhibidor de la farnesil transferasa, y
(iii) comparar dichos nivel del marcador, donde una disminución del nivel del marcador medido en la muestra de sangre sin tratar con el nivel del marcador medido en la muestra de sangre tratada indica una respuesta al tratamiento.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11158145.
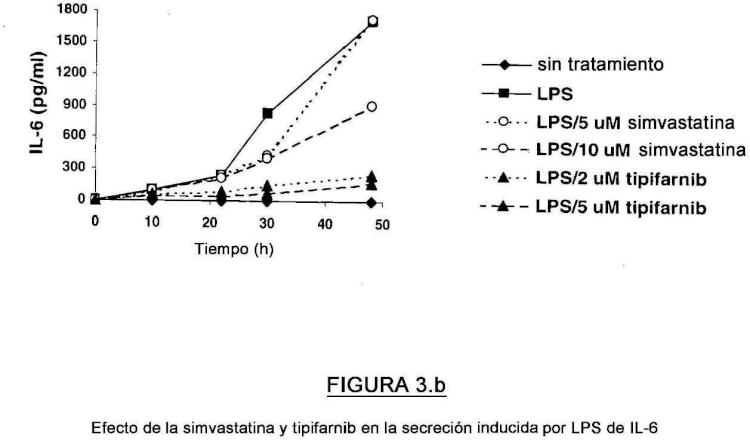
Solicitante: JANSSEN PHARMACEUTICA N.V..
Nacionalidad solicitante: Bélgica.
Dirección: TURNHOUTSEWEG 30 2340 BEERSE BELGICA.
Inventor/es: FOURIE,ANNE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4709 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Quinoleínas no condensadas conteniendo otros heterociclos.
- A61P7/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular.
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2522830_T3.pdf




Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
[0001] La presente descripción se refiere al uso de inhibidores de la farnesil transferasa para el tratamiento de sepsis o shock séptico. La invención se refiere a métodos para determinar o controlar la respuesta del paciente al tratamiento con un inhibidor de la farnesil transferasa.
ANTECEDENTES DE LA INVENCIÓN
[0002] Las estatinas inhiben la actividad de 3-hidrox¡-3-met¡lglutar¡l-coenzima A (HMG-CoA) reductasa, la enzima limitante de la velocidad en la biosíntesis del colesterol (Brown 1990), y son ampliamente prescritas para reducir el colesterol en pacientes hiperlipidémicos. Las observaciones recientes de los ensayos clínicos sugieren que las estatinas proporcionan un beneficio cardiovascular más allá de sus efectos hipolipemiantes. El reconocimiento de que la aterosclerosis implica un componente inflamatorio sugiere que algunos de los efectos beneficiosos de las estatinas podría estar relacionado con su modulación de la inmunidad y la inflamación (Schonbeck U 2004).
[0003] La inflamación es normalmente una respuesta aguda del sistema inmune a los patógenos microbianos, productos químicos o lesión física o, y se caracteriza por enrojecimiento, calor, hinchazón y dolor. Estos síntomas son el resultado de una cascada de eventos que incluyen la producción de citoquinas y quimioquinas, migración y acumulación celular, coagulación, fibrinólisis, dilatación de los vasos sanguíneos y aumento de la permeabilidad, así como la extravasación de plasma y proteínas. Si la respuesta inflamatoria no se regula de manera apropiada, puede progresar a un estado crónico, y ser la causa de las enfermedades inflamatorias, una causa importante de morbilidad y mortalidad. Una relación funcional entre la inflamación y el cáncer se ha reconocido durante mucho tiempo, pero las vías moleculares que subyacen a este enlace eran desconocidas. Estudios recientes han demostrado que la inflamación inducida por el crecimiento del tumor está mediada por la activación del factor de transcripción, NF-KB, y la producción del mediador inflamatorio, TNF-a (Luo, Maeda et al 2004;.. Pikarsky, Porat et al 2004).
[0004] El tratamiento de animales con lipopolisacárido (LPS) de bacterias Gram negativas se utiliza para inducir experimentalmente una respuesta inflamatoria sistémica, incluyendo los síntomas clásicos inflamatorios de enrojecimiento, calor, hinchazón y dolor. La administración de LPS a animales sirve como un modelo para la sepsis inducida por LPS y el crecimiento del tumor por inflamación inducida, así como un modelo más general para las respuestas inflamatorias inducidas por otros agentes en enfermedades inflamatorias. El tratamiento con LPS de células o en animales se ha usado ampliamente como un modelo experimental para evaluar el papel de mediadores tales como las citocinas y quimiocinas en la inflamación, y para estudiar los agentes que pueden modular la producción de tales mediadores.
[0005] Los posibles efectos terapéuticos de las estatinas en enfermedades inflamatorias han sido apoyados por varios estudios con animales que utilizan el tratamiento con LPS, así como otros modelos animales de enfermedades inflamatorias. Se ha demostrado que la cerivastatina reduce los niveles séricos de TNF-a, IL-ip, óxido nítrico, y mejora la supervivencia de ratones en un modelo de sepsis inducida por LPS (Ando, Takamura et al. 2000).
[0006] Se ha demostrado que la Atorvastatina y la lovastatina previenen o reveierten la encefalomielitis autoinmune experimental (EAE) (Stanislaus, Pahan et al 1999;. Youssef, Stueve et al 2002.). La simvastatina ha demostrado una actividad anti-inflamatoria en la artritis inducida por colágeno (Leung, Sattar et al. 2003), y en un modelo de asma alérgica (A McKay 2004) También se descubrió que la pravastatina alivia la caquexia, hematoquecia y la permeabilidad del epitelio intestinal en colitis inducida por sulfato de dextrano (Sasaki M, et al. 2003. J Pharmacol Exp Ther 305 (1), 78-85).
[0007] MCP-1, IL-lb, IL-6, MMP-9, MyD88 y TNF-a se han implicado en la patología de la aterosclerosis (Gu, Okada et al 1998;. Aiello, Bourassa et al 1999;. Dawson, et Kuziel al 1999;. Ito, Ikeda et al 2002;. Haddy, Sass et al 2003;. Kirii, Niwa et al 2003;. Luttun, Lutgens et al 2004;. Michelsen, Wong et al 2004) y sepsis (Bossink, Paemen. et al 1995;. Weighardt, Kaiser-Moore et al 2002;. Das 2003; Lalu, Gao et al 2003;. Mancuso, Midiri et al 2004). Las estatinas se usan para el tratamiento de la aterosclerosis, donde se cree que su efecto beneficioso se debed tanto a los efectos reductores de lípidos dependientes e independientes. Rezaie-Majd et al. (2002. Arterioscler Thromb Vasc Biol. 22, 1194-9) descubrió que la simvastatina reducía los niveles de proteína y ARN de las citocinas, IL-6, IL-8 y de la proteína-1 quimiotáctica de monocitos (MCP-1), en pacientes hipercolesterolémicos después de 6 semanas de tratamiento. En los pacientes con enfermedad arterial coronaria (CAD), la expresión de genes de las quimiocinas, MIP-1a, MIP-1 p, IL-8, y de los receptores, CCR1 y CCR2, fueron significativamente reguladas de manera negativabdespués del tratamiento con simvastatina o atorvastatina durante seis meses (Waehre T 2003). El potencial terapéutico de las estatinas para las enfermedades inflamatorias ha sido destacada por los recientes hallazgos en el ensayo de atorvastatina en la artritis reumatoide (TARA), que han demostrado que la puntuación de actividad de la enfermedad, la sedimentación globular y la proteína C-reactiva mejoraron significativamente en
comparación con la terapia existente después 6 meses de tratamiento con atorvastatina (McCarey DW 2004).
[0008] La sepsis y el shock séptico son síndromes inflamatorios complejos. Los datos recientes han demostrado que el tratamiento con estatinas está asociado con una disminución de la tasa de sepsis grave (Almog, Shefer et al. 2004) y mejora la supervivencia en un modelo murino de sepsis (Ando, Takamura et al. 2000).
[0009] Muchas observaciones de los efectos antiinflamatorios de las estatinas en modelos animales han obtenido resultados más altos que en dosis terapéuticas. Sin embargo, no hay evidencia de efectos anti-inflamatorios de las estatinas en los ensayos clínicos humanos a dosis terapéuticas (Rezaie-Majd, Maca et al 2002;. Waehre T 2003; McCarey DW2004). Mientras que los modelos animales y las observaciones clínicas en humanos demuestran que las estatinas tienen propiedades antl-lnflamatorias, el mecanismo que subyace a estas propiedades actualmente es incierto. Estudios in vitro sobre células han demostrado que las estatinas afectan a muchos procesos diferentes y no se sabe qué procesos son necesarios para los efectos antiinflamatorios in vivo. Por ejemplo, se sabe que la activación de factores de transcripción tales como NF-kB, AP 1-e y factor-la inducible por hlpoxla, que regulan la transcripción de muchos genes Inflamatorios, se regula de manera negativa in vitro por parte de la slmvastatlna, atorvastatina y lovastatina (Ortego M 1999;. Dlchtl, Dulak et al 2003).
[0010] Las estatinas Inhiben la síntesis de mevalonato, el paso limitante del índice en la producción de colesterol (Brown 1990) y también disminuyen la síntesis de los ¡soprenoides, pirofosfato de farnesilo (FPP) y geranllgeranll plrofosfato (GGPP) (ver Figura 1). GGPP y FPP son necesarios para la premiación, activación y ubicación subcelular de numerosas proteínas ¡ntracelulares (Casey PJ 1995;. Zhang FL 1996).
[0011] Los estudios han demostrado que los exógenos GGPP (o geranlol) y/o FPP (o farnesol) pueden revertir ciertas funciones anti-inflamatorias mediadas por estatinas incluyendo: (1) la adhesión de leucocitos (Liu L 1999), (2) la prollferaclón/apoptosls celular (Guijarro C 1998; Wen-Bin Zhong 2003), y (3) la actividad de NF-KB (Ortego M 1999), así como la (4) LPS Inducida por MMP-9 (Wong, Lumma et al 2001.). En contraste, la escualestatina, un inhibidor selectivo de la escualeno slntetasa y la síntesis de colesterol, no es capaz de imitar el efecto inhibidor de una estatina en la producción de quimioquinas y el reclutamiento de leucocitos inducido por LPS (Diomede L 2001).
[0012] Se ha informado que las estatinas suprimen la secreción de MMP-9 por parte de células TFIP-1 Inducida por LPS, pero que la inhibición de la farnesil transferasa (FTasa, también conocida como protema farnesil transferasa o
FPTasa) no tiene ningún efecto (Wong, B., et al. 2001. J Leukoc Biol 69, 959-62).
[0013] Los FTI fueron desarrollados originalmente para prevenir la farnesilación postraduccional y la activación de las oncoproteínas Ras (Prendergast y Rane 2001). Estudios recientes han demostrado la inhibición por parte de un FTI de la activación de NF-KB (Takada, Y., et al.... [Seguir leyendo]
Reivindicaciones:
1. Un método para determinar una respuesta de un sujeto que padece sepsis o shock séptico al tratamiento con un inhibidor de la farnesil transferasa, que comprende las etapas:
(i) medir un nivel de al menos un marcador seleccionado entre el grupo que consiste en proteínas identificadas en la Tabla 4 y en los transcriptos de los genes identificados en las Tablas 2 y 3 en una muestra de sangre sin tratar obtenida del sujeto antes del tratamiento con el inhibidor de la farnesil transferasa, y
(ii) medir un nivel del marcador en una muestra de sangre tratada obtenida del sujeto al menos una vez después del comienzo del tratamiento con el inhibidor de la farnesil transferasa, y
(Ni) comparar dichos nivel del marcador, donde una disminución del nivel del marcador medido en la muestra de sangre sin tratar con el nivel del marcador medido en la muestra de sangre tratada indica una respuesta al tratamiento.
2. El método de la reivindicación 1, en el que el método comprende las etapas:
a) aislar las células o plasma de las muestras de sangre sin tratar para obtener un extracto de la muestra sin tratar, y (ii) aislar las células o plasma de cada muestra de sangre tratada para obtener un extracto de la muestra tratada;
b) (i) medir el nivel de al menos uno de los IL - 6, MCP - 1, IL - 1(3, MMP - 9, y TNF - a en el extracto de muestra sin tratar, y (iii) comparar dichos niveles de al menos uno de los IL - 6, MCP -1, IL -1 (3, MMP - 9, y TNF - a, donde una disminución del nivel de al menos uno de los IL - 6, MCP -1, IL -1(3, MMP - 9, y TNF - a medido en el extracto de la muestra sin tratar en el nivel de al menos uno de los IL - 6, MCP -1, IL -1(3, MMP - 9, y TNF - a medidos en el extracto de la muestra tratada indica una respuesta al tratamiento.
3. El método de la reivindicación 1, en el que el método comprende las etapas:
(a) (i) aislar las células mononucleares de sangre periférica de la muestra de sangre sin tratar para obtener una muestra de CMSP, y (ii) aislar las células mononucleares de sangre periférica de cada muestra de sangre tratada para obtener una muestra de CMSP tratada;
(b) (i) estimular la muestra de CMSP sin tratar con lipopolisacáridos para obtener una muestra de CMSP sin tratar estimulada con LPS, y (ii) estimular cada muestra de CMSP tratada con lipopolisacáridos para obtener una muestra de CMSP tratada estimulada con LPS;
(c) (i) aislar el ARN de una muestra de CMSP sin tratar estimulada con LPS, y (ii) aislar el ARN de cada muestra de CMSP tratada estimulada con LPS;
(d) (i) medir la expresión de al menos uno de los IL -1 (3, MCP -1, MMP - 9, MyD88, STAT1 y IL - 6 en el ARN de la muestra de CMSP sin tratar estimulada con LPS, y (ii) medir la expresión de al menos uno de los IL - 1(3, MCP - 1, MMP - 9, MyD88, STAT1, e IL - 6 en el ARN de cada muestra de CMSP tratada estimulada con LPS, y (¡ii) comparar dichas mediciones de la expresión en al menos uno de los IL -1(3, MCP -1, MMP - 9, MyD88, STAT1, e IL - 6, donde una disminución indica una respuesta al tratamiento.
4. Un método definido en cualquiera de las reivindicaciones 1, 2, o 3, en el que el inhibidor de la farnesil transferasa comprende un compuesto de fórmula (I):
(I)
una forma estereoisomérica de la misma, una sal de adición de base o de ácido farmacéuticamente aceptable de la misma, en la que la línea de puntos representa un enlace adicional;
X es oxígeno o azufre;
R1 es hidrógeno, alquilo C-m2, Ar1, Ar2 - alquilo C-i _6, quinolinil - alquilo Ci.6, piridil - alquilo Ci.6l hidroxi - alquilo C1.6, alquiloxi Ci_ 6 - alquilo C1.6, mono - o di (alquil Ci.6) amino - alquilo Ci.6, amino - alquilo C1.6, o un radical de fórmula - Alk1 - C (= O) - R9, - Alk1 - S (O) - R9 o - Alk1 - S (0)2 - R9, donde ALK1 es alcanediil C-i. 6, R9 es hidroxi, alquilo Ci.6, alquiloxi Ci. 6, a mino, alquilamino Ci_s o alquilamino Ci_s sustituido con alquiloxicarbonilo Ci. 6, R2, R3 y R16 son cada uno independientemente hidrógeno, hidroxi, halo, ciano, alquilo C1.6, alquiloxi Ci.6, hidroxi - alquiloxi C-i-6, alquiloxi C1.6- alquiloxi Ci.6, amino - alquiloxi C1.6, mono - o di (alquil Ci.6) amlno - alquiloxi Ci-6, Ar1, Ar2
- alquilo C-i-6, Ar2 ' oxi, Ar2 " alquiloxi Ci.6, hidroxicarbonilo, alquiloxicarbonilo C-i. 6, trlhalometilo, trihalometoxl, alquenilo C2.e, 4,4 - dimetil - oxazolilo; o
cuando en posiciones contiguas R2 y R3 tomados conjuntamente pueden formar un radical bivalente de fórmula
R4 y R5 son cada uno independientemente hidrógeno, halo, Ar1, alquilo Ci_6, hidroxi - alquilo Ci_6, alquiloxi C1.6. alquilo C-i-6, alquiloxi Ci.6, alquiltio Ci.6, amino, hidroxicarbonilo, alquiloxicarbonilo Ci.6, alquil Ci_6- S (O) - alquilo C1.6 o alquil C-i-6 S(0)2. alquilo Ci_6;
R6 y R7 son cada uno independientemente hidrógeno, halo, ciano, alquilo Ci_6, alquiloxi C1.6, Ar2- oxi, trihalometilo, alquiltio Ci-6, di (alquil Ci_6) amino, o cuando en posiciones contiguas Rey R7 tomados conjuntamente pueden formar un radical bivalente de fórmula
R8 es hidrógeno, alquilo Ci_6, ciano, hidroxicarbonilo, alquiloxicarbonilo Ci_6, alquilcarbonllo Ci_6- alquilo Ci_6, ciano - alquilo Ci-e, alquiloxicarbonilo Ci-6- alquilo Ci.6, carboxl - alquilo Ci.6, hidroxi - alquilo C1.6, amlno - alquilo Ci.6, mono
- o di (alquil Ci_6) - amino - alquilo i-e, imidazolil, halo - alquilo Ci.6, alquiloxi C1.6. alquilo Ci.6, aminocarbonilo - alquilo C-i-6, o un radical de fórmula
donde R10 es hidrógeno, alquilo C1.6, alquilcarbonilo Ci.6, Ar1, Ar2 " alquilo Ci.6, alquiloxicarbonilo Ci-6- alquilo Ci.6, un radical o fórmula - Alk2 - OR13 o Alk2-NR 4R15;
R11 es hidrógeno, alquilo C-m2, Ar1 o Ar2 - alquilo Ci_6;
R12 es hidrógeno, alquilo Cve, alquilcarbonilo C-m6, alquiloxicarbonilo Ci.6, alquilamlnocarbonllo Ci.6, Ar1, Ar2' alquilo Ci. 6, alquilcarbonilo Cve - alquilo C-i-6, un aminoácido natural, Ar1 " carbonllo, Ar2 " alquilcarbonilo Ci.6, aminocarbonilcarbonilo, alquiloxi C1.6. alquilcarbonilo Ci.6, hidroxi, alquiloxi C1.6, aminocarbonilo, di (alquil Ci_6) amino - alquilocarbonilo Cve, amino, alquilamino Ci.6, alquilcarbonilamino C1.6, o un radical de fórmula -Alk2 - OR13 o -Alk2NR14R15; donde Alk2 es alcanediilo Ci_6¡ R13 es hidrógeno, alquilo C1.6, alquilcarbonilo Ci.6, hidroxi - alquilo Ci.6, Ar1 o Ar2 ' alquilo Cve; R14 es hidrógeno, alquilo Ci.6, Ar1 o Ar2 - alquilo Ci-6¡ R15 es hidrógeno, alquilo Ci.6, alquilcarbonilo Cve, Ar1 o Ar2' alquilo Ci_6;
R17 es hidrógeno, halo, ciano, alquilo Ci_6, alquiloxicarbonilo C1.6, Ar1;
R18 es hidrógeno, alquilo Ci_6, alquiloxi Ci.6o halo;
R19 es hidrógeno o alquilo Ci_6;
Ar1 es fenilo o fenilo sustituido con alquilo Ci_6, hidroxi, amino, alquiloxi Ci.6 o halo, y Ar2 es fenilo o fenilo sustituido con alquilo Ci_6, hidroxi, amino, alquiloxi Ci.6o halo.
5. El método de la reivindicación 4, en el que dicho inhibidor de la farnesiltransferasa es:
a) un compuesto de fórmula (I) en el que X es oxígeno y la línea de puntos representa un enlace; o
b) un compuesto de fórmula (I) en el que R1 es hidrógeno, alquilo C-ue, alquiloxi C-i.6.alquilo Ci_6, o, mono - o di (alquil Ci_ e) amino - alquilo C-i. 6; R2 es halo, alquilo C-ue, alquenilo C2.e, alquiloxi Ci_6, trihalometoxi, o hidroxi - alquiloxi Cve; y R3 es hidrógeno; o
c) (+) - 6 - [amino (4 - clorofenil) (1 - metil - 1H- imidazol - 5 - il) metil] - 4 - (3 - clorofenil) - 1 -metil - 2 (1H) - quinolinona; o una sal de adición de ácido farmacéuticamente aceptable de los mismos.
6. El método de la reivindicación 4, en el que R8 es hidrógeno, hidroxi, halo - alquil Ci-e, hidroxi - alquilo C-ue, ciano
- alquilo C-i-6, alquiloxicarbonilo C-ue - alquilo C-ue, imidazolil, o un radical de fórmula NR11R12 en el que R11 es hidrógeno o alquilo Cm2 y R12 es hidrógeno, alquilo C-ue, alquiloxi Ci-e, alquiloxi Cve - alquilocarbonilo Ci-e, hidroxi, o un radical de fórmula - Alk2 - OR13 en el que R13 es hidrógeno o alquilo Cve.
7. Un método según se define en la reivindicación 1, dicho al menos un marcador seleccionado del grupo entre IL
- 6, MCP - 1, IL -1 (3, MMP - 9, y TNF - a.
8. Un método según se define en cualquiera de las reivindicaciones 1 o 2, en el que en una subetapa (ii), se utilizan las muestras plurales de sangre tratada del sujeto que fueron tomadas en intervalos periódicos de tiempo después del comienzo del tratamiento con el Inhibidor de la farnesil transferasa.
9. Un método según se define en la reivindicación 1, en el que la muestra de sangre es sangre entera, plasma, suero, células totales, o células mononucleares de sangre periférica.
10. Un método según se define en la reivindicación 2, en el que las subetapas (b) (I) y (b) (ii) comprenden: aislar plasma de la muestra de sangre sin tratar mediante centrifugación para obtener un extracto de la muestra sin tratar, y (¡I) aislar plasma de cada muestra de sangre tratada mediante centrifugación para obtener un extracto de sangre tratada.
11. Un método según se define en la reivindicación 2, en el que las subetapas (b) (i) y (b) (ii) comprenden: aislar las células mononucleares de sangre periférica de la muestra de sangre sin tratar por separación por gradiente Ficoll - Paque para obtener el extracto de la muestra sin tratar, y (ii) aislar las células mononucleares de sangre periférica por separación por gradiente Ficoll - Paque de cada muestra de sangre tratada para obtener el extracto de la muestra tratada.
12. Un método según se define en la reivindicación 2, comprende además: (i) estimular el extracto de la muestra sin tratar con lipopolisacáridos, y (ii) estimular el extracto de la muestra tratada con lipopolisacáridos.
13. Un método según se define en la reivindicación 3, en el que las subetapas (b) (i) y (b) (ii) comprenden cada una aislar las células mononucleares de sangre periférica utilizando la separación por gradiente Ficoll - Paque.
14. Un método según se define en la reivindicación 13, en el que el sujeto es un paciente en un ensayo clínico.
15. Un método según se define en las reivindicaciones 1 o 14, en el que el inhibidor de la farnesil transferasa utilizado para tratar al sujeto es tipifarnib.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]