Método para producir trombomodulina soluble de gran pureza.
Un método para producir trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble,
que puede ser generado a partir de la trombomodulina soluble en condiciones ácidas, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3 % o menos, que comprende: (0) una etapa en la que se deja la trombomodulina soluble en condiciones ácidas de pH 5 o menor; (1) una etapa en la que se hace pasar un material que contiene trombomodulina soluble que contiene o se sospecha que contiene un producto desnaturalizado de la trombomodulina soluble, que se obtiene en la etapa (0) anterior, a través de un intercambiador aniónico o hidroxiapatita; y (2) un etapa en la que se obtiene una fracción que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto de trombomodulina soluble es 3% o menos, en condiciones de separación en la cuales la trombomodulina soluble puede ser separada de un producto desnaturalizado de la trombomodulina soluble.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2008/055211.
Solicitante: ASAHI KASEI PHARMA CORPORATION.
Nacionalidad solicitante: Japón.
Dirección: 1-105 Kanda Jinbocho Chiyoda-ku Tokyo 101-8101 JAPON.
Inventor/es: OHIGASHI,SUSUMU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- A61P7/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Agentes antitrombóticos; Anticoagulantes; Inhibidores de la agregación plaquetaria.
- C07K1/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › por cromatografía.
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2496596_T3.pdf



Fragmento de la descripción:
Método para producir trombomodulina soluble de gran pureza Campo técnico
La presente invención se refiere a un método para producir una trombomodulina soluble de gran pureza que no contiene sustancialmente un producto desnaturalizado de trombomodulina soluble que puede ser generado en condiciones ácidas.
Técnica anterior
Se sabe que la trombomodulina actúa como una sustancia que se une específicamente a la tromblna de modo que Inhiba su actividad de coagulación de la sangre y, al mismo tiempo, actúe para promover significativamente la capacidad de la trombina para activar la protelna C. También se sabe que la trombomodulina tiene una fuerte acción inhibidora de la coagulación de la sangre. También se sabe que la trombomodulina prolonga el tiempo de coagulación por trombina, o que suprime la agregación plaquetaria debida a la tromblna. La proteína C es una proteína dependiente de la vitamina K que desempeña un papel importante en un sistema fibrinolítico de coagulación de la sangre. La proteína C es activada por la acción de la trombina, de manera que se convierta en proteína C activada. Se sabe que la proteína C activada Inactiva in vivo un factor V de coagulación de la sangre activado y un factor VIII de coagulación de la sangre activado, y que está implicada en la generación de un activador de plasminógeno que tiene acción trombolítlca (Documento que no es patente 1). Por consiguiente, se considera que la trombomodulina promueve la activación de la proteína C por la tromblna y por tanto que es útil como un anticoagulante o un agente trombolítlco. También, está documentado en un experimento con animales, que la trombomodulina es eficaz para la terapia o prevención de enfermedades asociadas a la aceleración de la coagulación (Documento que no es patente 2).
Convencionalmente, la trombomodulina se descubrió y obtuvo como una glicoproteína que se expresa en las células endoteliales vasculares de varias especies animales, Incluyendo seres humanos como ejemplos típicos, y después se clonó con éxito. Es decir, un gen precursor de la trombomodulina humana que contiene un péptido de señal se clonó por ingeniería genética a partir de una genoteca de cDNA de pulmón humano, y se analizaron todas las secuencias del gen de la trombomodulina. Como resultado, se clarificó una secuencia de aminoácidos que consistía en 575 residuos que contenían un péptido de señal (en general, se ¡lustraron 18 residuos de aminoácidos) (Documento de patente 1). Se sabe que una trombomodulina madura, a partir de la cual se escinde el péptido de señal, está compuesta de 5 regiones, a saber, una región N-terminal (aminoácidos 1-226: esta es la posición determinada cuando se supone que el péptido de señal consta de 18 residuos de aminoácidos, y lo mismo puede decirse de otras regiones), una región que tiene seis estructuras similares al EGF (factor de crecimiento epidérmico) (aminoácidos 227-462), una región de glicosilación unida por O (aminoácidos 463-498), una región transmembránica (aminoácidos 499 a 521) y una región intracitoplásmica (aminoácidos 522-557), desde el lado N-terminal del péptido maduro. También se sabe que, entre las seis estructuras similares al EGF, las porciones 4a, 5a y 6a de estructuras similares al EGF procedentes del lado N-terminal (es decir, unidades mínimas de actividad) tienen principalmente la misma actividad que la trombomodulina de longitud completa (Documento que no es patente 3).
Salvo que esté presente un tensioactivo, la trombomodulina de longitud completa se disuelve difícilmente. Por lo tanto, es necesaria la adición de un tensioactivo para obtener una preparación de trombomodulina. Por el contrario, también existe una trombomodulina soluble que se puede disolver completamente, incluso en ausencia de un tensioactivo. La trombomodulina soluble se puede preparar eliminando al menos una parte de la región transmembránica o la región transmembránica completa. Por ejemplo, se ha confirmado que se puede obtener una trombomodulina soluble que conste sólo de 3 regiones, a saber, una región N-terminal, una región que tiene seis estructuras similares al EGF y una región de glicosilación unida por O (es decir, una trombomodulina soluble que tiene un secuencia de aminoácidos que consiste en los aminoácidos 19 a 516 de la SEQ ID NO: 1), aplicando técnicas de recombinación, y que esta trombomodulina soluble recombinante tiene la misma actividad que una trombomodulina natural (Documento de patente 1). Además, hay algunos otros documentos que se refieren a trombomodulinas solubles (Documentos de patentes 2 a 9). También, se han ilustrado como trombomodulinas naturales una trombomodulina soluble derivada de orina humana y similares (Documentos de patentes 1 y 11).
Como se reconoce en muchos casos, como resultado de mutaciones espontáneas o mutaciones que ocurren cuando se obtienen trombomodulinas, se han encontrado mutaciones polimórficas incluso en genes humanos. Actualmente, se han identificado genes de trombomodulina en los que el aminoácido en la posición 473 de un precursor de trombomodulina humana, que tiene la secuencia de aminoácidos antes mencionada que consiste en 575 residuos de aminoácidos, se convierte en Val o Ala. En una secuencia de nucleótidos que codifica este aminoácido, el nucleótido en la posición 1418 se convierte en T o C (Documento que no es de patente 4). Sin embargo, las dos trombomodulinas son completamente idénticas en cuanto a su actividad y propiedades físicas. Por lo tanto, se puede considerar que son sustancialmente idénticas.
Está documentado que la trombomodulina tiene efectos sobre la terapia de la coagulación intravascular diseminada (CID) (Documento que no es patente 5). Además de los usos previstos antes mencionados, se prevé que la
trombomodulina se usará en la terapia y prevención de diversas enfermedades, tales como síndrome coronario agudo (SCA), trombosis, obstrucción vascular periférica, arteriesclerosis obliterante, vasculitis, trastorno funcional que ocurre después de cirugía cardiaca, complicación provocada por trasplante de órganos, angina de pecho, ataque isquémico transitorio, toxemia del embarazo, diabetes, EVO hepática (enfermedad veno-oclusiva hepática, por ejemplo, hepatitis fulminante, enfermedad veno-oclusiva del hígado que ocurre después de trasplante de médula ósea), trombosis venosa profunda (TVP) y síndrome de dificultad respiratoria del adulto (SDRA).
Como productos desnaturalizados de la trombomodulina, se conocen un agregado generado en un proceso de liofilización y un agregado generado durante la conservación a largo plazo en estado liofilizado (Documentos de patentes 12 a 16).
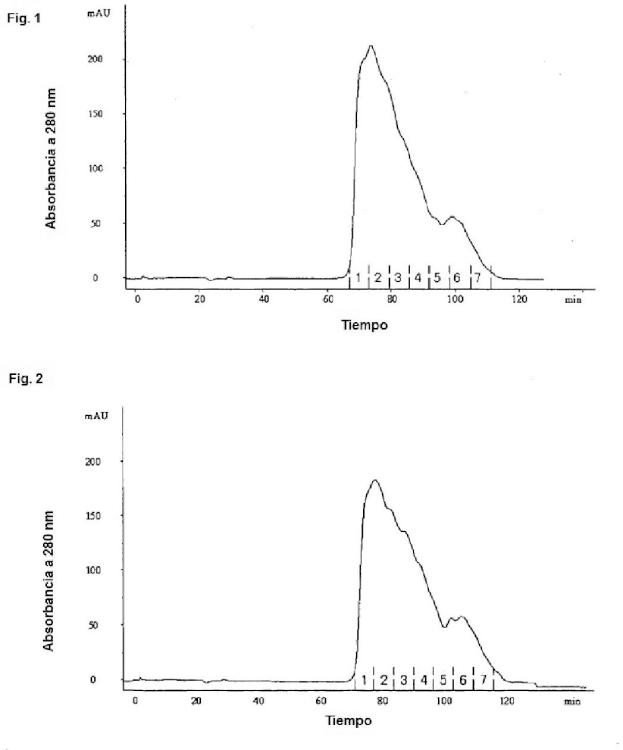
Los métodos conocidos para producir trombomodulina soluble a nivel industrial para uso en productos farmacéuticos incluyen: un método que utiliza cromatografía de afinidad en la que un anticuerpo que reacciona con la trombomodulina se mantiene en una etapa de purificación; un método para producir trombomodulina soluble de gran pureza que no contiene sustancialmente ni productos derivados de suero ni productos derivados de anticuerpos, que se caracteriza por que la trombomodulina soluble se obtiene como una fracción de paso en una etapa que permite que la trombomodulina soluble obtenida por cromatografía de afinidad se ponga en contacto con un intercambiador catiónico en condiciones que consisten en una conductividad específica de 25 a 34 mS/cm y pH de 3 a 4 (Documento de patente 17); y un método para purificar trombomodulina, que se caracteriza porque comprende purificar en primer lugar una muestra que contiene trombomodulina de orina humana por cromatografía de afinidad de trombina fijada y a continuación purificar la muestra por cromatografía de adsorción utilizando hidroxiapatita como adsorbente (Documento de patente 18).
Documento de patente 1: Publicación de patente japonesa (Kokai) N° 64-6219 A (1989)
Documento de patente 2: Publicación de patente japonesa (Kokai) N° 2-255699 A (199)
Documento de patente 3: Publicación de patente japonesa (Kokai) N° 3-13338 A (1991)
Documento de patente 4: Publicación de patente japonesa (Kokai) N° 3-25984 A (1991)
Documento de patente 5: Publicación de patente japonesa (Kokai) N° 4-217 A (1992)
Documento de patente 6: Publicación de patente japonesa (Kokai) N° 5-213998 A (1993)
Documento de patente 7: W92/325 Documento de patente 8: WO92/3149 Documento de patente 9: W93/15755
Documento de patente 1: Publicación de patente japonesa (Kokai) N° 3-869 A (1991)
Documento de patente 11: Publicación de patente japonesa (Kokai) N° 3-218399 A (1991)
Documento de patente 12: Publicación de patente japonesa (Kokai) N° 6-32185 A (1994)
Documento... [Seguir leyendo]
Reivindicaciones:
1. Un método para producir trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, que puede ser generado a partir de la trombomodulina soluble en condiciones ácidas, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3 % o menos, que comprende: () una etapa en la que se deja la trombomodulina soluble en condiciones ácidas de pH 5 o menor; (1) una etapa en la que se hace pasar un material que contiene trombomodulina soluble que contiene o se sospecha que contiene un producto desnaturalizado de la trombomodulina soluble, que se obtiene en la etapa () anterior, a través de un intercambiador aniónico o hidroxiapatita; y (2) un etapa en la que se obtiene una fracción que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto de trombomodulina soluble es 3% o menos, en condiciones de separación en la cuales la trombomodulina soluble puede ser separada de un producto desnaturalizado de la trombomodulina soluble.
2. El método de producción de acuerdo con la reivindicación 1, en donde la etapa en la que se deja la trombomodulina soluble en condiciones ácidas de pH 5 o menor es una etapa en la que se deja la trombomodulina soluble en condiciones ácidas de pH 4 o menor.
3. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 2, en donde la etapa en la que se hace pasar el material que contiene trombomodulina soluble a través del ¡ntercambiador aniónico o hidroxiapatita es la etapa en la que se hace pasar el material que contiene trombomodulina soluble a través del ¡ntercambiador aniónico.
4. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 2, en donde la etapa en la que se hace pasar el material que contiene trombomodulina soluble a través del ¡ntercambiador aniónico o hidroxiapatita es la etapa en la que se hacer pasar el material que contiene trombomodulina soluble a través de la hidroxiapatita.
5. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en donde el contenido de la trombomodulina soluble es 8% o más con respecto a las proteínas totales en el material que contiene trombomodulina soluble.
6. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (2) es una etapa en la que se realiza una elución en gradiente lineal, una elución en gradiente escalonado, o una elución en gradiente en la que se combina la elución en gradiente lineal con la elución en gradiente escalonado, de modo que se obtiene una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustanclalmente el producto desnaturalizado es 3% o menos.
7. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (2) es una etapa en la que se obtiene una fracción de paso, en la cual se obtiene una fracción que contiene trombomodulina soluble que no contiene sustanclalmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustanclalmente el producto desnaturalizado de trombomodulina soluble es 3% o menos.
8. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (2) es una etapa en la que se realiza una elución ¡socrática para obtener una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos.
9. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (1) es una etapa en la que se hace pasar el material que contiene trombomodulina soluble a través de un ¡ntercambiador aniónico usando una solución tampón de pH 4 a 9; y la etapa (2) es una etapa en la que se realiza una elución en gradiente lineal, una elución en gradiente escalonado o una elución en gradiente en la cual se combina la elución en gradiente lineal con la elución en gradiente escalonado, usando una solución tampón de pH 5 a 9 que tiene una concentración de sal de a 1 M, de modo que se obtiene una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustanclalmente el producto desnaturalizado de trombomodulina soluble es 3% o menos, confirmando mientras la presencia de la trombomodulina soluble en la fracción de elución.
1. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (1) es una etapa en la que se hace pasar el material que contiene trombomodulina soluble a través de un ¡ntercambiador aniónico usando una solución tampón de pH 5 a 8 que tiene una concentración de sal de ,1 a ,2 M; y la etapa (2)
es una etapa en la que se obtiene una fracción de paso usando una solución tampón de pH 5 a 8 que tiene una concentración de sal de ,1 a ,2 M, de modo que se obtiene una fracción que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos.
11. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (1) es una etapa en la que se hace pasar el material que contiene trombomodulina soluble a través de hldroxlapatlta usando una solución tampón de pH 6 a 9 que tiene una concentración de fosfato de 8 mM o menor; y la etapa (2) es una etapa en la que se realiza una elución en gradiente lineal, una elución en gradiente escalonado o una elución en gradiente en la que se combina la elución en gradiente lineal con la elución en gradiente escalonado, usando una solución tampón de pH 6 a 9 que tiene una concentración de fosfato de a ,5 M, de modo que se obtiene una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos, confirmando mientras la presencia de la trombomodulina soluble en la fracción de elución.
12. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde la etapa (1) es una etapa en la que se hace pasar el material que contiene trombomodulina soluble a través de hldroxlapatlta usando una solución tampón de pH 6 a 9 que tiene una concentración de fosfato de 5 a 2 mM o menor; y la etapa (2) es una etapa en la que se obtiene una fracción de paso usando una solución tampón de pH 6 a 9 que tiene una concentración de fosfato de 5 a 2 mM, de modo que se obtiene una fracción que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos.
13. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 12, que no comprende una etapa en la que se ajusta el pH de una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble a pH 4 o menor, después de que se haya obtenido la fracción de elución, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos.
14. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 13, que es un método de producción que comprende una etapa de concentración y/o una etapa de desalación, en donde el pH de una fracción de elución que contiene trombomodulina soluble que no contiene sustancialmente un producto desnaturalizado de la trombomodulina soluble no se ajusta a pH 4 o menor después de que se haya obtenido la fracción de elución, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 3% o menos, y en donde el método de producción se usa para convertir la trombomodulina soluble en un material farmacéutico.
15. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 14, en donde el contenido del producto desnaturalizado de la trombomodulina soluble en la trombomodulina soluble que no contiene sustancialmente el producto desnaturalizado de trombomodulina soluble es 1% o menos.
16. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 15, en donde la trombomodulina soluble es trombomodulina obtenida a partir de células transformantes preparadas transfectando células hospedantes con DNAque codifica la secuencia de aminoácidos mostrada en la SEQ ID NO: 9 u 11.
17. El método de producción de acuerdo con una cualquiera de las reivindicaciones 1 a 16, en donde la trombomodulina soluble es un péptldo que consiste en una secuencia que consiste en los aminoácidos en las posiciones 19 a 516 de la secuencia de aminoácidos mostrada en la SEQ ID NO: 9 u 11, o un péptido que comprende una sustitución, una deleción, o una adición de uno o múltiples aminoácidos en la secuencia de aminoácidos de dicho péptido y tiene actividad de trombomodulina.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]