METODO PARA OBTENER ENANTIOMEROS PUROS DE UN DERIVADO DE PIRIDAZINONA.
Un método para la resolución óptica de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona racémica,
método que comprende las etapas de:
(a)poner en contacto la mezcla racémica con ácido D- o L-tartárico en disolvente de acetato de etilo, en donde el disolvente comprende hasta 6% en peso de agua;
(b)recuperar la sal cristalina; y
(c)opcionalmente basificar la sal para formar la base libre correspondiente
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05010245.
Solicitante: ORION CORPORATION.
Nacionalidad solicitante: Finlandia.
Dirección: ORIONINTIE 1,02200 ESPOO.
Inventor/es: MUTTONEN, ESA, TIMMERBACKA, MIKA, LEHTONEN, JORMA, TANNINEN, VELI, PEKKA, KAUKONEN, JUKKA, HYPPOLA, RIIKKA, BACKSTROM, REIJO.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Marzo de 1997.
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07D237/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 237/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,2 o diazina-1,2 hidrogenada. › que tienen menos de tres enlaces dobles entre miembros cíclicos o entre miembros cíclicos y no cíclicos.
Clasificación PCT:
- C07D237/04 C07D 237/00 […] › que tienen menos de tres enlaces dobles entre miembros cíclicos o entre miembros cíclicos y no cíclicos.
Clasificación antigua:
- C07D237/04 C07D 237/00 […] › que tienen menos de tres enlaces dobles entre miembros cíclicos o entre miembros cíclicos y no cíclicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Lituania, Letonia.
Fragmento de la descripción:
Método para obtener enantiómeros puros de un derivado de piridazinona.
Campo técnico
La presente invención se refiere a un método para preparar enantiómeros ópticamente activos de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona (II) y a un método para preparar enantiómeros ópticamente activos de [[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)fenil]-hidrazono]propanodinitrilo (I), particularmente, se describe el enantiómero (-) de (I). También se describe una nueva forma polimórfica cristalina del enantiómero (-).
Antecedentes de la invención
La mezcla racémica de [[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)fenil]hidrazono]propanodinitrilo (I) se ha descrito previamente en la Patente Europea Nº 383449 B1 del solicitante. Se ha mostrado que el compuesto (I) es potente en el tratamiento del fallo cardíaco congestivo y tiene una significativa unión dependiente del calcio a troponina.

Enantiómeros ópticamente activos de (I) se han descrito anteriormente en la Patente Europea Nº 565546 B1 del solicitante. Se ha mostrado que la potencia cardiotónica se debe predominantemente al enantiómero (-) de (I). También se describió un método para preparar el enantiómero (-) puro de (I) usando el enantiómero (-) ópticamente puro de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona (II) como un compuesto intermedio.
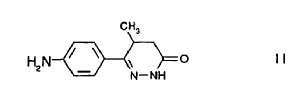
El compuesto (II) racémico puede sintetizarse mediante métodos conocidos en la bibliografía (J. Med. Chem., 17, 273-281 (1974)). Sin embargo, la resolución del compuesto (II) racémico ha resultado muy difícil debido a que el grupo amino en 4 de la molécula es débilmente básico. Las sales de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona con ácidos ópticamente activos se hidrolizan fácilmente durante la cristalización de nuevo hasta el compuesto (II) y hasta el compuesto de resolución que interfieren con el procedimiento de resolución o lo hacen totalmente imposible.
La separación de los enantiómeros puros del compuesto (II) en una columna quiral de HPLC se ha descrito en la solicitud de patente europea Nº 208518. Sin embargo, este método no es aplicable a escala industrial. Una síntesis enantioselectiva en siete etapas de (-)-6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona partiendo de ácido (+)-2-cloropropiónico también se ha descrito en la bibliografía (J. Org.Chern., 56, 1963 (1991)). El rendimiento total en este método es sólo 12%, dando (-)-6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona con una pureza óptica de 97,2%.
En la Patente Europea Nº 565546 B1 mencionada anteriormente se encontró que el producto intermedio (II) racémico puede resolverse tratando (II) con ácido L- o D-tartárico en exceso en 2-propanol y recuperando la sal cristalina diastereoisómera. La pureza óptica del producto se incrementaba adicionalmente disolviendo en dioxano el producto basificado recuperado. El residuo racémico se cristalizó en dioxano y el filtrado se evaporó hasta sequedad dando el enantiómero puro deseado del producto intermedio (II). El enantiómero (-) puro de (I) se preparó tratando el enantiómero (-) del producto intermedio (II) adicionalmente con nitrito sódico y malononitrilo en condiciones ácidas, según se describe en la Patente Europea Nº 383449 B1 mencionada anteriormente.
Incluso si este procedimiento da el enantiómero (-) puro de (I), la necesidad de usar dioxano nocivo limita su aplicabilidad a gran escala. Por lo tanto, existe una necesidad de un procedimiento mejorado para preparar enantiómero (-) puro de (I).
Descripción de los dibujos
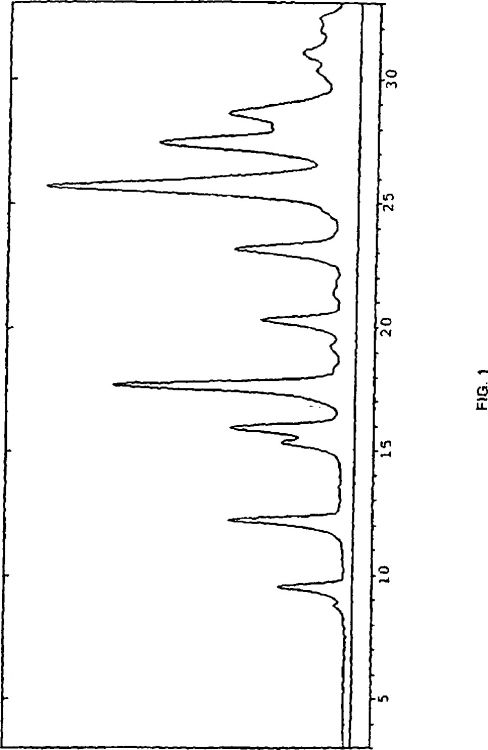
La Fig. 1 es el diagrama de difracción de rayos X del polvo en el intervalo de 3-33 2?º de la forma polimórfica I de (-)-[[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)-fenil]hidrazono]propanodinitrilo.
Sumario de la invención
Se ha encontrado ahora que el enantiómero (-) sustancialmente puro de (I) puede prepararse más cómodamente y sin dioxano si la resolución se efectúa en dos fases de síntesis diferentes. La etapa de resolución inicial comprende resolver el producto intermedio (II) racémico y la etapa de resolución final comprende resolver el producto final (I) enantiómeramente enriquecido. Se ha encontrado que la etapa de resolución inicial da como resultado una pureza óptica superior del producto intermedio (II) si se usa acetato de etilo como disolvente en lugar de 2-propanol. Por otra parte, se encontró que el componente secundario en una mezcla de enantiómeros parcialmente enriquecida del producto final (I) puede cristalizarse en acetona.
Así, la presente invención proporciona un método para la resolución óptica de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona racémica, método que comprende las etapas de:
Se describe un método para preparar (-)-[[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)-fenil]hidrazono]propanodinitrilo sustancialmente ópticamente puro, comprendiendo el método las etapas de
También se describe un método para preparar (-)-[[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)-fenil]hidrazono]propanodinitrilo sustancialmente ópticamente puro, comprendiendo el método las etapas de
También se describen una nueva forma polimórfica cristalina I de (-)-[[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)-fenil]hidrazono]propanodinitrilo y métodos para la preparación de la misma.
Descripción detallada
El término "sustancialmente ópticamente puro" significa en la presente memoria una pureza óptica por encima de aproximadamente 90%, preferiblemente por encima de 95% y más preferiblemente por encima de 99%, expresada como el porcentaje de exceso enantiómero. Los términos "resolver" y "resolución" están destinados a abarcar la separación completa o parcial de los dos enantiómeros ópticos.
De acuerdo con la presente invención, el compuesto (II) racémico se resuelve haciendo reaccionar la mezcla racémica de (II) con ácido D- o L-tartárico en disolvente de acetato de etilo. El disolvente de acetato de etilo contiene de 0 a aproximadamente 6% en peso, preferiblemente de 2 a 4% en peso, más preferiblemente aproximadamente 3% en peso de agua. Se prefiere usar ácido D- o L-tartárico y compuesto (II) en cantidades aproximadamente equimolares. Las sales...
Reivindicaciones:
1. Un método para la resolución óptica de 6-(4-aminofenil)-4,5-dihidro-5-metil-3(2H)-piridazinona racémica, método que comprende las etapas de:
2. Un método de acuerdo con la reivindicación 1, en el que el disolvente comprende 2-4% en peso de agua.
3. Un método de acuerdo con la reivindicación 1, en el que el disolvente comprende aproximadamente 3% en peso de agua.
Patentes similares o relacionadas:
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Derivados de piridina-3(2H)-ona en tanto que agentes de formación de imágenes para la detección de perfusión miocárdica, del 9 de Octubre de 2019, de LANTHEUS MEDICAL IMAGING, INC: compuesto A de la Fórmula (I): **Fórmula** o una sal farmacéuticamente aceptable del mismo, en donde: R1 se selecciona entre el […]
Compuestos y métodos para la determinación de fármacos inmunosupresores de unión a FKBP, del 18 de Septiembre de 2018, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Uso de una composicion para liberar un farmaco inmunosupresor de union a FKBP de sustancias de union endogenas en una muestra de la que se sospecha […]
 Tioamidas y sus sales e inhibidores de la producción de citoquinas que contienen ambos, del 2 de Mayo de 2012, de ISHIHARA SANGYO KAISHA, LTD.: Un compuesto tioamida representado por la fórmula (I) o una sal del mismo:
donde A es un átomo de nitrógeno, N-óxido, C-NO2 O C-CN; Hal […]
Tioamidas y sus sales e inhibidores de la producción de citoquinas que contienen ambos, del 2 de Mayo de 2012, de ISHIHARA SANGYO KAISHA, LTD.: Un compuesto tioamida representado por la fórmula (I) o una sal del mismo:
donde A es un átomo de nitrógeno, N-óxido, C-NO2 O C-CN; Hal […]
MÉTODO PARA OBTENER ENANTIÓMEROS PUROS DE UN DERIVADO DE PIRIDAZINONA, del 22 de Diciembre de 2011, de ORION CORPORATION: Forma polimórfica cristalina de -[[4-(1,4,5,6-tetrahidro-4-metil-6-oxo-3-piridazinil)fenil]-hidrazono]propanodinitrilo, caracterizada por el patrón de difracción […]
BENZOILPIRIDAZINAS, del 7 de Enero de 2011, de MERCK PATENT GMBH: Compuestos de fórmula I **(Ver fórmula)****(Ver fórmula)****(Ver fórmula)****(Ver fórmula)**R4 es A1, cicloalquilo que tiene de 3 a 7 átomos […]
ARILOXIMAS, del 24 de Mayo de 2010, de MERCK PATENT GMBH: Compuestos de la fórmula I
METODO PARA LA ELABORACION DE CARBOXILATOS DE DIFLUORMETILPIRAZOLILO, del 5 de Mayo de 2010, de BASF SE: Método para la preparación de carboxilatos de pirazol-4-ilo sustituidos con difluormetilo de la fórmula general (I),