MÉTODO Y KIT PARA EL AISLAMIENTO RÁPIDO DE CÉLULAS Foxp3+Treg HUMANAS.
Un método para aislar células T reguladoras Foxp3+ CD25+ humanas (células Foxp3+ Treg) a partir de una muestra que contiene células mononucleares de sangre periférica (PBMC),
comprendiendo el método las etapas de: (a) tratar la muestra con un anticuerpo anti-CD127 y un anticuerpo anti-CD49d; (b) separar las células Foxp3+ Treg
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07020026.
Solicitante: MAX-DELBRÜCK-CENTRUM FÜR MOLEKULARE MEDIZIN (MDC).
Nacionalidad solicitante: Alemania.
Dirección: BERLIN-BUCH, ROBERT-RÖSSLE-STRASSE 10 13125 BERLIN ALEMANIA.
Inventor/es: FALK, KIRSTEN, ROTZSCHKE, OLAF, Kleinewietfeld,Markus.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Octubre de 2007.
Clasificación Internacional de Patentes:
- C12N5/00P9B
- C12N5/06B11C
Clasificación PCT:
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N5/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
La presente invención se refiere a métodos para aislar células T reguladoras CD4+CD25+ de la caja de cabeza de tenedor (forkhead box) P3 (Foxp3+) humanas (denominadas aquí como células Foxp3+ Treg) a partir de una muestra que contiene células mononucleares de sangre periférica (PBMC), a un kit para aislar células Foxp3+ Treg 5 humanas, y al uso de anticuerpo anti-CD49d y anticuerpo anti-CD127 para el aislamiento de células Foxp3+ Treg humanas.
Antecedentes de la Técnica
Las células T reguladoras, o “Treg” son fundamentales para controlar diversas respuestas inmunitarias, por cuanto las Treg suprimen rápidamente la actividad de otras células inmunitarias. En particular, las Treg son cruciales 10 para mantener la tolerancia disminuyendo respuestas inmunitarias indeseadas frente a antígenos propios y no propios (véanse, por ejemplo, Fontenot, J. D. y Rudensky, A. Y. Nat Immunol 6, 331-7 (2005); Sakaguchi, S., Annu Rev Immunol 22, 531-62 (2004)). Por ejemplo, se han descubierto defectos de Treg en pacientes con esclerosis múltiple (EM), diabetes tipo I (T1D), psoriasis, miastenia grave (MG) y otras enfermedades autoinmunitarias (Baecher-Allan, C. y Hafler, D. A., Immunol Rev 212, 203-16 (2006)). También existen relaciones similares para atopia y enfermedades 15 alérgicas (Robinson, D. S., Larche, M. y Durham, S. R., J Clin Invest 114, 1389-97 (2004)). Para todas estas enfermedades existen informes que apuntan a una supresión inmunitaria in vitro reducida de las células Treg de los pacientes. Esto ha conducido a un creciente interés en la posibilidad de usar las Treg en inmunoterapia para tratar o prevenir infecciones crónicas, enfermedades autoinmunitarias, alergias y complicaciones relacionadas con transplantes, tales como el rechazo de injertos o la enfermedad de injerto contra huésped (EICH) (para un repaso, véase Roncarolo, 20 M. G. y Battaglia, M., Nat Rev Immunol 7, 585-98 (2007)).
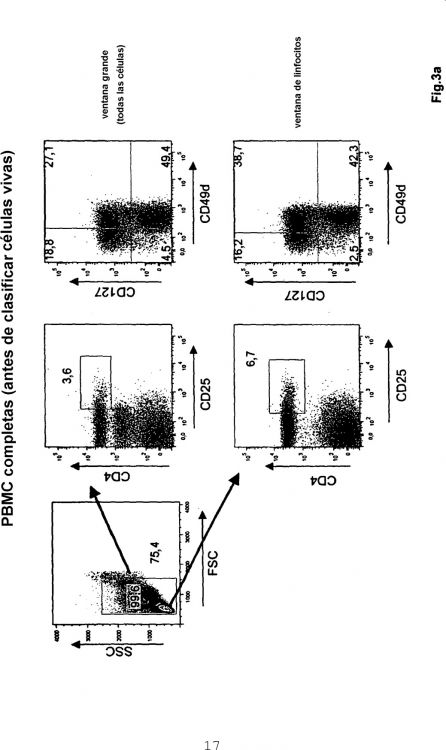
El marcador característico de las Treg es Foxp3. Se conocen métodos para el aislamiento de células Foxp3 Treg humanas. Por ejemplo, Hoffmann, P. et al. Biol Blood Marrow Transplant 12, 267-74 (2006) describen el aislamiento de células T CD4+CD25+ con función reguladora a partir de productos de leucaféresis estándar usando un protocolo de separación celular magnética de dos etapas. Los productos celulares generados contenían de media 25 49,5% de células Foxp3+ Treg. También, existen kits comerciales, por ejemplo el kit CD4+CD25+ Regulatory T Cell Isolation Kit de Miltenyi Biotec, o el kit Dynal® CD4+CD25+ Treg Kit de Invitrogen.
Todos los métodos descritos hasta ahora para el aislamiento de células Foxp3+ Treg humanas emplean la selección positiva de células Foxp3+ Treg basándose en marcadores de la superficie celular de las Treg (véase, por ejemplo, Seddiki, N. et al., J Exp Med 203, 1693-700 (2006)). Esto es, las células Foxp3+ Treg se aíslan usando 30 anticuerpos para marcadores de la superficie celular asociados a Treg, principalmente CD25. Sin embargo, la mayoría de los marcadores de la superficie celular de las Treg, tales como CD4, CD25 y Foxp3, no están restringidos a las Treg. Por ejemplo, el CD25 empleado habitualmente también es expresado por células T CD4+ efectoras y de memoria (véase, por ejemplo, Baecher-Allan, C., Brown, J. A., Freeman, G. J. y Hafler, D. A., J Immunol 167, 1245-53 (2001)). En consecuencia, estos métodos de selección positiva no permiten el aislamiento de una población uniforme que dé cuenta 35 de la mayoría de las células Foxp3+ Treg como se esquematiza anteriormente; Hoffmann, P. et al. obtuvieron de media 49,5% de células Foxp3+ Treg.
También, la aplicación en terapia celular de células Foxp3+ Treg, que se han aislado mediante selección positiva basándose en marcadores de superficie celular de las Treg, plantea varios problemas. En primer lugar, el aislamiento de células Foxp3+ Treg basado en marcadores de superficie celular, por ejemplo CD25, conduce a 40 contaminaciones más o menos importantes de la población de células Foxp3+ Treg con otras células, por ejemplo células efectoras CD4+ que representan la diana principal de la supresión por Treg. En consecuencia, existe un riesgo elevado si tales células Foxp3+ Treg seleccionadas positivamente se aplicasen en terapia celular, puesto que puede conducir a la activación potencialmente mortal del sistema inmunitario del paciente tratado. Tal respuesta inmunitaria mortal se documentó recientemente en el fracaso de los ensayos “Tegenero” (Suntharalingam, G. et al., N Engl J Med 45 355, 1018-28 (2006)). En segundo lugar las células Foxp3+ Treg seleccionadas positivamente que han sido marcadas mediante un anticuerpo pueden exhibir función deteriorada. Puesto que las células marcadas mediante un anticuerpo están potencialmente preactivadas, pueden sufrir depleción mediada por el complemento o por las células, o pueden mostrar patrones de ecotaxia y migración alterados. En consecuencia, las células Foxp3+ Treg seleccionadas como dianas por anticuerpos durante su aislamiento son indeseables no sólo por razones de seguridad. 50
Como se explica, los métodos y kits descritos anteriormente muestran desventajas importantes con respecto al aislamiento de células Foxp3+ Treg. Adicionalmente, hasta ahora no existe ningún método que permita acceder a las células Foxp3+ Treg mediante selección negativa, es decir, dejando las células Foxp3+ Treg sin
marcadores/anticuerpos. Por lo tanto, es un objeto de la presente invención proporcionar un método que evite las desventajas mencionadas anteriormente de la técnica anterior. Adicionalmente, es un objeto adicional de la presente invención proporcionar un kit para el aislamiento de células Foxp3+ Treg.
Descripción de la invención
La presente invención se basa en los resultados acerca de la correlación de marcadores de la superficie 5 celular específicos de células Foxp3+ Treg y marcadores de la superficie celular de células T CD4+ no reguladoras. En particular, se examinaron los marcadores de la superficie celular CD127 y CD49d. Durante los experimentos en el contexto de la presente invención, se pudo demostrar que los marcadores de superficie CD127 y CD49d están ausentes en la mayoría de las células Foxp3+ Treg. En el contexto de la presente invención, se pudo demostrar que las células Foxp3+ Treg humanas sin tocar se pueden aislar con gran pureza en una única etapa de depleción, mediante el uso 10 combinado de anticuerpos dirigidos contra CD127 y CD49d, por ejemplo una pureza de >90% (es decir, las células Foxp3+ Treg constituyen más del 90% de las células en el producto celular aislado). Adicionalmente, la actividad supresora de las células Foxp3+ Treg aisladas se confirmó mediante experimentos en el contexto de la presente invención. Las células Foxp3+ Treg aisladas inhibieron fuertemente reacciones mixtas de linfocitos (MLR) in vitro, y evitaron el ataque mortal de PBMC humana transferida in vivo en un modelo de GvHD basado en ratones Rag2-/- c-/-. 15
En un primer aspecto de la presente invención, uno de sus objetos se resuelve mediante un método para aislar células Foxp3+ Treg humanas a partir de una muestra que contiene células mononucleares de sangre periférica, o “PBMC”, comprendiendo el método las etapas de:
(a) tratar la muestra con un anticuerpo anti-CD127 y un anticuerpo anti-CD49d;
(b) separar las células Foxp3+ Treg. 20
La expresión “tratar la muestra”, como se usa en la presente invención, debe implicar especialmente que las células contenidas en la muestra se ponen en contacto físico directo con los anticuerpos de una manera tal que los anticuerpos pueden interaccionar con las células seleccionadas como dianas. En otras palabras, en el método según la presente invención, las células mononucleares de sangre periférica PBMC se ponen en contacto con un anticuerpo anti-CD127 y un anticuerpo anti-CD49d, y las células Foxp3+ Treg se separan. 25
El término “separar”, como se usa en la presente invención, se refiere a la retirada por medios físicos de un tipo celular, por ejemplo células Foxp3+ Treg, a partir de otros tipos celulares, por ejemplo células efectoras CD4+, o de todas las células T CD4+ no reguladoras a partir de las células Foxp3+ Treg. Para una descripción más detallada de las técnicas de separación, refiérase a P.T. Sharpe, Methods of Cell Separation, Laboratory Techniques in Biochemistry and Molecular Biology, Vol. 18, ELSEVIER (1988), y D. Fisher, G. E. Francis, D. Rickwood (Eds.), Cell Separation: A 30 Practical...
Reivindicaciones:
1. Un método para aislar células T reguladoras Foxp3+ CD25+ humanas (células Foxp3+ Treg) a partir de una muestra que contiene células mononucleares de sangre periférica (PBMC), comprendiendo el método las etapas de:
(a) tratar la muestra con un anticuerpo anti-CD127 y un anticuerpo anti-CD49d;
(b) separar las células Foxp3+ Treg. 5
2. El método según la reivindicación 1, en el que las etapas (a) y (b) se llevan a cabo simultáneamente.
3. El método según la reivindicación 1 o la reivindicación 2, en el que la etapa (a) comprende adicionalmente la separación de células T no CD4+ a partir de las PBMC.
4. El método según la reivindicación 3, en el que las células T no CD4+ se separan de las PBMC 10 mediante selección negativa usando un anticuerpo anti-CD4.
5. El método según la reivindicación 3, en el que uno o más anticuerpo/anticuerpos que permiten la depleción específica de células T no CD4+ a partir de las PBMC se usa o usan para la separación de células T no CD4+ a partir de las PBMC.
6. El método según la reivindicación 5, en el que el anticuerpo/anticuerpos usado o usados para la 15 depleción específica de células T no CD4+ a partir de las PBMC se selecciona o seleccionan del grupo que comprende anticuerpo anti-CD8, anticuerpo anti-CD14, anticuerpo anti-CD15, anticuerpo anti-CD16, anticuerpo anti-CD19, anticuerpo anti-CD36, anticuerpo anti-CD49b, anticuerpo anti-CD56, anticuerpo anti-CD123, anticuerpo anti-TCRg/d, y anticuerpo anti-CD235a, o mezclas.
7. El método según la reivindicación 5 o reivindicación 6, en el que el anticuerpo anti-CD14, 20 anticuerpo anti-CD15, y/o anticuerpo anti-CD16 se usa o usan para la depleción específica de células T no CD4+ a partir de las PBMC.
8. El método según cualquiera de las reivindicaciones 5 a 7, en el que el anticuerpo anti-CD14 y/o el anticuerpo anti-CD16 se usa o usan para la depleción específica de células T no CD4+ a partir de las PBMC.
9. El método según cualquiera de las reivindicaciones 1 a 8, en el que al menos uno de los 25 anticuerpos usados en la etapa (a) está marcado o inmovilizado.
10. El método según la reivindicación 9, en el que al menos un anticuerpo usado en la etapa (a) está inmovilizado.
11. El método según la reivindicación 9 o la reivindicación 10, en el que al menos un anticuerpo usado en la etapa (a) está inmovilizado en una matriz de nailon. 30
12. El método según la reivindicación 9, en el que los anticuerpos usados en la etapa (a) están marcados uniformemente.
13. El método según la reivindicación 9 o reivindicación 12, en el que el marcador se selecciona del grupo que comprende isótopos, marcadores de fluorescencia o luminiscencia, anticuerpos o fragmentos de anticuerpos, marcadores de afinidad, y enzimas o sustratos enzimáticos. 35
14. El método según cualquiera de las reivindicaciones 1 a 9, 12 ó 13, en el que el anticuerpo anti-CD127 está marcado con biotina, fluoresceína (FITC) o ficoeritrina (PE).
15. El método según cualquiera de las reivindicaciones 1 a 9 y 12 a 14, en el que el anticuerpo anti-CD49d está marcado con biotina, fluoresceína (FITC) o ficoeritrina (PE).
16. El método según cualquiera de las reivindicaciones 1 a 15, en el que la etapa (b) se lleva a cabo 40 usando centrifugación, elutriación celular, separación magnética, clasificación celular activada por fluorescencia, separación inmunológica, adhesión, lisis por complemento o citometría de flujo.
17. El método según cualquiera de las reivindicaciones 1 a 16, en el que la etapa (b) se lleva a cabo
usando separación celular magnética, clasificación celular activada por fluorescencia, o una separación inmunológica a base de columna.
18. El método según cualquiera de las reivindicaciones 1 a 17, en el que se usa un anticuerpo anti-CD45RO como anticuerpo adicional en la etapa (a), y en el que las células Foxp3+ Treg aisladas son células T CD45RA+. 5
19. El método según cualquiera de las reivindicaciones 1 a 17, en el que se usa un anticuerpo anti-CD45RA como anticuerpo adicional en la etapa (a), y en el que las células Foxp3+ Treg aisladas son células T CD45RO+.
20. Un kit para aislar células Foxp3+ Treg humanas, que comprende un anticuerpo anti-CD49d y un anticuerpo anti-CD127. 10
21. El kit según la reivindicación 20, en el que el kit comprende adicionalmente uno o más anticuerpo/anticuerpos seleccionados del grupo que comprende anticuerpo anti-CD8, anticuerpo anti-CD14, anticuerpo anti-CD15, anticuerpo anti-CD16, anticuerpo anti-CD19, anticuerpo anti-CD36, anticuerpo anti-CD49b, anticuerpo anti-CD56, anticuerpo anti-CD123, anticuerpo anti-TCRg/d, y anticuerpo anti-CD235a.
22. El kit según la reivindicación 20 o reivindicación 21, en el que al menos uno de los anticuerpos está 15 inmovilizado.
23. El kit según la reivindicación 20 o reivindicación 21, en el que al menos uno de los anticuerpos está marcado.
24. El kit según la reivindicación 23, en el que los anticuerpos usados están marcados uniformemente.
25. El kit según la reivindicación 23 o reivindicación 24, en el que el marcador se selecciona del grupo 20 que comprende isótopos, marcadores de fluorescencia o luminiscencia, anticuerpos o fragmentos de anticuerpos, marcadores de afinidad, y enzimas o sustratos enzimáticos.
26. El kit según cualquiera de las reivindicaciones 20, 21, 23, 24 ó 25, en el que el anticuerpo anti-CD127 está marcado con biotina, FITC, o PE, y el anticuerpo anti-CD49d está marcado con biotina, FITC, o PE.
27. Uso de un anticuerpo anti-CD49d y un anticuerpo anti-CD127 o de un kit según cualquiera de las 25 reivindicaciones 20 a 26 para el aislamiento de células Foxp3+ Treg humanas.
28. El uso según la reivindicación 27, caracterizado porque la separación de las células Foxp3+ Treg humanas se logra separando las PBMC CD49d+CD127+, incluyendo células T CD4+ no reguladoras, de células Foxp3+ Treg no marcadas vía centrifugación, elutriación celular, separación magnética, clasificación celular activada por fluorescencia, separación inmunológica, adhesión, lisis por complemento o citometría de flujo. 30
29. El uso según la reivindicación 27 o la reivindicación 28, caracterizado porque la depleción de células T no CD4+ a partir de las PBMC se lleva a cabo usando al menos un anticuerpo seleccionado del grupo que comprende anticuerpo anti-CD8, anticuerpo anti-CD14, anticuerpo anti-CD15, anticuerpo anti-CD16, anticuerpo anti-CD19, anticuerpo anti-CD36, anticuerpo anti-CD49b, anticuerpo anti-CD56, anticuerpo anti-CD123, anticuerpo anti-TCRg/d, y anticuerpo anti-CD235a. 35
Patentes similares o relacionadas:
OBTENCIÓN DE CÉLULAS TR1 ESPECÍFICAS DE ANTÍGENOS DE LOS ALIMENTOS O DE AUTOANTÍGENOS A PARTIR DE UNA POBLACIÓN DE LEUCOCITOS O PBMC, del 14 de Noviembre de 2011, de TXCELL S.A. INSTITUT NATIONAL DE LA SANTÉ ET DE LA RECHERCHE MÉDICALE (INSERM): Un método in vitro para la obtención de una población de células Tr1 específicas de antígenos de alimentos o autoantígenos proveniente de una población de leucocitos o de […]
UTILIZACIÓN DE LA PROTEÍNA GILZ PARA MODULAR LA RESPUESTA INMUNOESPECÍFICA DE UN ANTÍGENO, del 13 de Julio de 2011, de ASSISTANCE PUBLIQUE, HOPITAUX DE PARIS: Utilización de al menos: a) una proteína GILZ o un vector recombinante de expresión de la dicha proteína, aislados o expresados en células dendríticas […]
PROCESO PARA PRODUCIR LINFOCITOS CITOTÓXICOS, del 13 de Abril de 2011, de TAKARA BIO INC.: Un método para preparar un linfocito citotóxico o una preparación de linfocitos citotóxicos en donde dicho método comprende el paso de llevar a cabo al menos uno de inducción, […]
ACTIVACIÓN Y EXPANSIÓN DE CÉLULAS T, del 10 de Marzo de 2011, de LIFE TECHNOLOGIES CORPORATION: Un método in vitro para expandir selectivamente una población de células T CD8 + de memoria, que comprende: poner en contacto una población de células en la […]
SOBRENADANTE PROCEDENTE DE CÉLULAS MADRE MESENQUIMÁTICAS PARA LA PREVENCIÓN Y EL TRATAMIENTO DE RESPUESTAS INMUNITARIAS EN TRASPLANTES, del 1 de Febrero de 2011, de OSIRIS THERAPEUTICS, INC.: Utilización de un sobrenadante procedente de un cultivo de células madre mesenquimáticas para la preparación de un medicamento destinado a reducir una respuesta […]
PEPTIDO CON CAPACIDAD PARA UNIRSE A ESCURFINA Y APLICACIONES, del 6 de Julio de 2010, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Péptidos de fórmula general (I), donde X está ausente, o bien, X está presente y es X14 o X14-X15, donde X14 y X15, independientemente entre sí, representan un aminoácido; […]
 PRODUCCION DE CELULAS TTCR GAMMA DELTA, del 12 de Abril de 2010, de HEMOSOL INC.: Procedimiento para expandir las células T TcR?d+ en una muestra de partida, que comprende:
cultivar las células en la muestra de partida en un primer medio de cultivo que […]
PRODUCCION DE CELULAS TTCR GAMMA DELTA, del 12 de Abril de 2010, de HEMOSOL INC.: Procedimiento para expandir las células T TcR?d+ en una muestra de partida, que comprende:
cultivar las células en la muestra de partida en un primer medio de cultivo que […]
METODO DE ENRIQUECIMIENTO DE CELULAS FETALES, del 1 de Septiembre de 2010, de REVEALCYTE: Un método para enriquecer células fetales en una muestra de sangre materna en el que las células que son CD34+ y son capaces de adherirse a un soporte sólido se seleccionan, […]