MÉTODO DE TERAPIA.
Un método para analizar el ciclo del sistema inmune para determinar cuándo se debe administrar un agente a un paciente que sufre de una enfermedad caracterizado por la producción de células T reguladoras,
el método comprende monitorear muestras obtenidas del paciente para una oscilación regular de por lo menos uno de: a) números de células T efectoras y/o actividad, b) números de células T reguladoras y/o actividad, c) una molécula marcadora asociada con la enfermedad, y/o d) un marcador del sistema inmune, en donde el agente inhibe la producción de, limita la función de, y/o destruye, las células T reguladoras, y en donde el agente se selecciona del grupo que consiste de fármacos antiproliferativos, radiación, dsARN y anticuerpos que inhiben la producción y/o actividad de células T reguladoras, y en donde la enfermedad es cáncer o una infección, y en donde el momento cuando se debe administrar el agente se selecciona de tal manera que el agente ejerce un efecto proporcionalmente mayor contra las células T reguladoras que las células T efectoras
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/AU2004/001456.
Solicitante: IMMUNAID PTY LTD.
Nacionalidad solicitante: Australia.
Dirección: 60-66 HANOVER STREET FITZROY, VICTORIA 3065 AUSTRALIA.
Inventor/es: ASHDOWN,Martin,Leonard.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Octubre de 2004.
Clasificación Internacional de Patentes:
- G01N33/569H2
- G01N33/569K2
- G01N33/574V
Clasificación PCT:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357430_T3.pdf



Fragmento de la descripción:
Campo de la Invención
Numerosas enfermedades se han ligado a la producción de células reguladoras. La presente invención se relaciona con la observación que el sistema inmune es cíclico en estas enfermedades. Con base en estas observaciones, se 5 describen aquí métodos para tratar enfermedades tales como cáncer y una infección por VIH. La presente invención también se relaciona con métodos para determinar cuándo se debe administrar a un paciente una terapia que trata una enfermedad caracterizada por la producción de células reguladoras.
Antecedente de la Invención
En el pasado, se han hecho intentos para activar el sistema inmune para montar una respuesta eficiente contra 10 células malignas. A pesar de los progresos significativos y promisorios, tal una respuesta todavía no se ha alcanzado plenamente y muchas terapias con base inmune han resultado decepcionantes.
Numerosos estudios utilizando ensayos celulares in vitro demuestran que los linfocitos citotóxicos tienen la capacidad de matar células de tumor. Por qué está destrucción con base inmune no controla efectivamente el crecimiento de tumor in vivo es un enigma. El paciente con cáncer también ha incrementado la concentración de 15 complejos inmunes circulantes, lo que indica que el sistema inmune está activo, particularmente contra ciertos antígenos de tumor. El nivel de estos complejos inmunes puede aumentar con el progreso de la enfermedad (Horvath et al, 1982; Aziz et al, 1998).
Las células reguladoras (también denominadas en la técnica como células supresoras) han estado implicadas en la respuesta inmune de los sujetos sensibles al cáncer (North and Awwad, 1990; WO 03/068257). Como la mayoría de 20 los antígenos contra el cáncer son producidos actualmente por el paciente ellos son considerados como “auto” por el sistema inmune. Luego de la presencia, y/o cantidad incrementada, de antígeno de tumor, el sistema inmune del anfitrión monta una respuesta caracterizada por la producción de células efectoras que objetivan las células que producen el antígeno de tumor. Sin embargo, en muchos casos estas células efectoras son reconocidas por el sistema inmune como destinadas a las propias células anfitrionas, y por lo tanto se produce una población de células 25 reguladoras para regular por descenso la población de células efectoras. Así, la producción de estas células reguladoras limita la capacidad del sistema inmune para remover efectivamente las células cancerígenas.
Más recientemente, se ha mostrado que las células reguladoras están involucradas en una respuesta inmune de los sujetos a una infección vírica. La WO 02/13828 describe la producción de células reguladoras durante la infección retrovírica, y métodos para tratar tales infecciones al regular por descenso la población de células reguladoras 30 mientras que se mantiene la población de células efectoras. Adicionalmente, Peterson et al (2002) observa que en una población de células reguladoras CD4+ se suprime la capacidad de las células efectoras CD8+ para controlar infecciones de retrovirus de murino Friend en ratones.
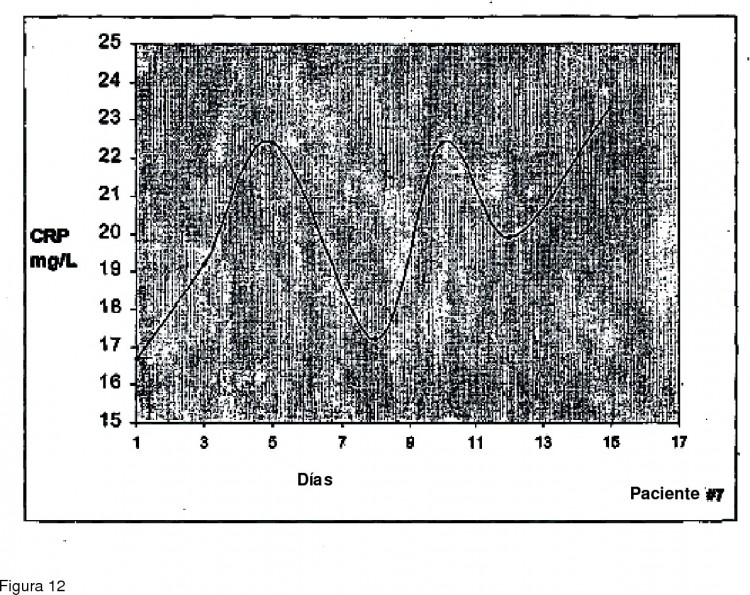
Las mediciones de ciertas concentraciones de proteína de fase aguda en plasma puede ser de valor diagnóstico o pronóstico bajo condiciones clínicas específicas. La proteína de fase aguda mejor conocida es la proteína reactiva C 35 (CRP). La CRP es una proteína de plasma que se eleva en la sangre con la inflamación de ciertas afecciones. El nivel de CRP en el plasma sanguíneo puede subir tan alto como 1000 veces con la inflamación. Las afecciones llevan comúnmente a cambios marcados en la CRP que incluyen infección vírica y bacteriana, trauma, cirugía, quemaduras, afecciones inflamatorias, enfermedad coronaria y vascular y cáncer avanzado.
Se sintetizan las proteínas de fase más aguda mediante hepatocitos, algunas se producen mediante otros tipos 40 celulares, que incluyen monocitos, células endoteliales, fibroblastos y adipocitos. Las proteínas de fase aguda incluyen amiloide A de suero (SAA), CRP y componente amiloide P de suero (SAP).
La capacidad de respuesta inmediata de CRP y SAA para estimular, junto con su amplio rango de concentración y facilidad de medición automatizada, ha dado lugar a niveles de CRP y SAA en plasma que se utilizan monitorear exactamente la severidad de la inflamación y la eficacia de del manejo de la enfermedad durante ciertas condiciones 45 de enfermedad.
La WO 03/070270 describe el uso de marcadores inflamatorios de fase aguda en regímenes para el tratamiento efectivo de VIH. Estos métodos se basan en por lo menos “reajustar” parcialmente el sistema inmune mediante un tratamiento tal como HAART seguido por el análisis de proteínas inflamatorias de fase aguda como marcadores para la expansión de célula efectora/reguladora. La emergencia de proteínas inflamatorias de fase aguda parece estar 50 vinculado a la expansión de célula efectora, que ocurre antes de la expansión de la célula reguladora, y así el paciente se puede tratar con un agente adecuado que permite que se mantenga la población de células efectoras
mientras que destruye, evita la producción de, o reduce la actividad de, células reguladoras. En esencia, luego del retiro de tratamiento de HAART se considera que el sistema inmune de los pacientes podría tratar la re-emergencia de partículas de VIH como una nueva infección, y por lo tanto se podría producir una nueva población de células efectoras.
Sin embargo, de manera similar a la WO 03/070270, la WO 03/068257 se relaciona con por lo menos el reajuste 5 parcial del sistema inmune, en este caso en el contexto del tratamiento de cáncer. De nuevo, el tratamiento se centra en la re-emergencia inicial de las células efectoras que sigue a una reducción en la carga de tumor a través de técnicas tales como cirugía o la administración de fármacos antiproliferativos.
Ninguna de la WO 02/13828, WO 03/070270 o WO 03/068257 aprecian que la respuesta inmune es cíclica en un paciente con cáncer o VIH independiente de la administración del tratamiento para estas enfermedades. La presente 10 invención se basa en la realización de este ciclo
Resumen de la Invención
El presente inventor ha encontrado de forma sorprendente que el sistema inmune es cíclico durante los estados de enfermedad caracterizados por la presencia de células reguladoras. Este ciclo ocurre sobre una base regular de aproximadamente 14 a 15 días en humanos. 15
Aunque no se desea estar limitado por la teoría, parece que la expansión de la célula efectora contra un antígeno objetivo está seguido por la expansión de células reguladoras dirigidas contra las efectoras. Luego del control de las células efectoras por las células reguladoras los números y/o actividad de ambos tipos de células disminuye, lo que a su vez está seguido por el mismo ciclo debido a la presencia continua o remoción incompleta del antígeno que resulta en una persisten oscilación, pero inefectiva, la respuesta inmune contra, por ejemplo, el tumor o virus. 20
El conocimiento de este ciclo se puede utilizar para tratar enfermedades donde se sabe que la emergencia de células reguladoras es perjudicial para el paciente. Ejemplos de tales enfermedades incluyen cáncer y infecciones persistentes tales como por el virus de inmunodeficiencia humana. Más específicamente, el tratamiento de un paciente se puede programar de tal manera que se maximizan los números de células efectoras contra un antígeno celular o vírico mientras que se reducen o eliminan los números de células reguladoras. 25
De hecho, el presente inventor ha notado que el tratamiento de una amplia variedad de cánceres con fármacos antineoplásicos resulta, en promedio, en un índice de respuesta completo en el rango de 6.5 a 7%. Este rango de 6.5 a 7% es consistente con un ciclo de aproximadamente 14 a 15 días de expansión de célula efectora seguido por expansión de célula reguladora. Más específicamente, cuando no se toma en consideración el ciclo células efectoras y reguladoras, un médico tiene una oportunidad aproximada de 1 en 14.5 (6.8%) de administrar un fármaco anti-30 proliferativo cuando los números de células efectoras son altos pero los números de células reguladoras solo han comenzado a expandirse y por lo tanto son vulnerables a tratamientos que están dirigidos a las células en división. Esto lleva a altos números de células efectoras que objetivan las células cancerígenas, que resultan en una respuesta completa... [Seguir leyendo]
Reivindicaciones:
1. Un método para analizar el ciclo del sistema inmune para determinar cuándo se debe administrar un agente a un paciente que sufre de una enfermedad caracterizado por la producción de células T reguladoras, el método comprende monitorear muestras obtenidas del paciente para una oscilación regular de por lo menos uno de: a) números de células T efectoras y/o actividad, b) números de células T reguladoras y/o actividad, c) una molécula 5 marcadora asociada con la enfermedad, y/o d) un marcador del sistema inmune, en donde el agente inhibe la producción de, limita la función de, y/o destruye, las células T reguladoras, y en donde el agente se selecciona del grupo que consiste de fármacos antiproliferativos, radiación, dsARN y anticuerpos que inhiben la producción y/o actividad de células T reguladoras, y en donde la enfermedad es cáncer o una infección, y en donde el momento cuando se debe administrar el agente se selecciona de tal manera que el agente ejerce un efecto proporcionalmente 10 mayor contra las células T reguladoras que las células T efectoras.
2. Uso de un agente en la fabricación de una composición para el tratamiento de la enfermedad caracterizada por la producción de células T reguladoras, en donde un paciente que sufre de la enfermedad se ha analizado para el ciclo del sistema inmune al monitorear el paciente para una oscilación regular de por lo menos uno de:
a) número y/o actividad de células T reguladoras, 15
b) número y/o actividad de células T efectoras,
c) una molécula marcadora asociada con la enfermedad, y/o
d) un marcador de sistema inmune, y
en donde el tiempo de administración del agente para tratar la enfermedad se selecciona de tal manera que el agente ejerce un efecto proporcionalmente mayor contra las células T reguladoras que las células T efectoras, en 20 donde el agente inhibe la producción de, limita la función de, y/o destruye, células T reguladoras, y en donde el agente se selecciona del grupo que consiste de fármacos antiproliferativos, radiación, dsARN y anticuerpos que inhiben la producción y/o actividad de células T reguladoras, y en donde la enfermedad es cáncer o una infección.
3. El método de la reivindicación 1 o el uso de la reivindicación 2, en donde la infección es una infección persistente crónica caracterizado por el sistema inmune de los pacientes que no es capaz de eliminar la infección. 25
4. El método o el uso de la reivindicación 3, en donde el paciente se infecta con VIH o virus de la Hepatitis C.
5. El método de acuerdo con una cualquiera de la reivindicaciones 1, 3 o 4 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-4, en donde el marcador del sistema inmune refleja el número y/o actividad de células T reguladoras, y/o el número y/o actividad de células T efectoras.
6. El método de acuerdo con una cualquiera de las reivindicaciones 1, 3 o 4 o el uso de acuerdo con una 30 cualquiera de las reivindicaciones 2-4, en donde el marcador del sistema inmune es un marcador inflamatorio de fase aguda.
7. El método o el uso de la reivindicación 6, en donde el marcador inflamatorio de fase aguda se selecciona del grupo que consiste de amiloide A de suero, amiloide P de suero y proteína reactiva c.
8. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-7 o el uso de acuerdo con una 35 cualquiera de las reivindicaciones 2-7, en donde las células T reguladoras son células T CD4+CD8-.
9. El uso de acuerdo con una cualquiera de las reivindicaciones 2 a 4, en donde se administra el agente aproximadamente cuando se detectan las células T CD4+ CD8-.
10. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-9, en donde las células T efectoras son células T CD8+CD4-. 40
11. El uso de acuerdo con una cualquiera de las reivindicaciones 2 a 4, en donde se administra el agente aproximadamente cuando ha alcanzado los números pico de célula T CD8+ CD4-.
12. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8 o 10 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-11, en donde la molécula marcadora asociada con el cáncer es un antígeno producido por una célula cancerígena. 45
13. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8 o 10 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-11, en donde la molécula marcadora asociada con la infección es un antígeno producido por un agente infeccioso.
14. El uso de acuerdo con una cualquiera de las reivindicaciones 2 a 4, en donde se administra el agente aproximadamente cuando los niveles de la molécula marcadora asociada con el cáncer o infección empieza a 5 disminuir.
15. El método de acuerdo con una cualquiera de las reivindicaciones 1, 3 o 4 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-4, en donde se monitorea el paciente para un marcador inflamatorio de fase aguda, y una molécula marcadora asociada con el cáncer o infección.
16. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13 o 15 o el uso de 10 acuerdo con una cualquiera de las reivindicaciones 2-15, en donde se monitorea el paciente durante un periodo de por lo menos 21 días.
17. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13, 15 o 16 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-16, el paciente se monitorea por lo menos aproximadamente cada 3 días. 15
18. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13 o 15-17 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-17, en donde el fármaco antiproliferativo se selecciona del grupo que consiste de taxol, vincristina, vinblastina y vinblastina anhidro.
19. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13 o 15-17 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-17, en donde el anticuerpo se selecciona del grupo que 20 consiste de: anti-CD4+, anti-CTLA-4 (antígeno-4 asociado a linfocito citotóxico), anti-GITR (receptor del factor de necrosis de tumor inducido por glucocorticoide), anti-CD28 y anti-CD25.
20. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13 o 15-19 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-19, en donde el paciente no se ha expuesto a un tratamiento para el cáncer o infección durante por lo menos 21 días. 25
21. El método de acuerdo con una cualquiera de las reivindicaciones 1 o 3-8, 10, 12, 13 15-20 o el uso de acuerdo con una cualquiera de las reivindicaciones 2-20, en donde el paciente es un humano.
22. Un método para determinar cuándo se debe administrar una vacuna a un paciente que sufre de una enfermedad caracterizado por la producción de células T reguladoras, el método comprende monitorear muestras obtenidas del paciente, para una oscilación regular de por lo menos uno de: a) números de células T efectoras y/o 30 actividad, b) números de células T reguladoras y/o actividad, c) una molécula marcadora asociada con la enfermedad, y/o d) un marcador de sistema inmune, y en donde la enfermedad es cáncer o una infección, y en donde el tiempo de cuando la vacuna se debe administrar se selecciona de tal manera que la vacuna inocula la respuesta inmune innata, produce números incrementados y/o actividad de células T efectoras, antes de la emergencia de células T reguladoras. 35
23. Uso de una vacuna en la fabricación de una composición para el tratamiento de una enfermedad caracterizada por la producción de células T reguladoras, en donde un paciente que amortigua la enfermedad se ha analizado para el ciclo del sistema inmune al monitorear el paciente para una oscilación regular de por lo menos uno de:
a) número y/o actividad de células T reguladoras, 40
b) número y/o actividad de células T efectoras,
c) una molécula marcadora asociada con la enfermedad, y/o
d) un marcador de sistema inmune, y en donde el tiempo de administración de la vacuna para tratar la enfermedad se selecciona de tal manera que la vacuna inocula la respuesta inmune innata, produce números incrementados y/o actividad de células T efectoras, antes de la emergencia de células T reguladoras, y en donde la enfermedad es 45 cáncer o una infección.
24. El uso de la reivindicación 23, en donde la vacuna se administra aproximadamente cuando se incrementan los niveles de células T efectoras.
25. El uso de la reivindicación 23, en donde la vacuna se administra aproximadamente cuando los niveles de una molécula marcadora asociada con la enfermedad empiezan a disminuir.
Patentes similares o relacionadas:
ENSAYO PARA IDENTIFICAR CÉLULAS PRODUCTORAS DE ANTICUERPOS, del 13 de Febrero de 2012, de UCB PHARMA, S.A.: Un ensayo homogéneo in vitro para identificar una célula productora de anticuerpos que produce un anticuerpo que se une a un antígeno seleccionado que comprende: a) […]
MARCADORES PARA ATEROSCLEROSIS, del 15 de Junio de 2011, de IMMUNOCLIN LTD: Método para el diagnóstico, prognosis o identificación de una predisposición hacia aterosclerosis y la susceptibilidad al desarrollo de placas ateroscleróticas […]
DIAGNÓSTICO DE ENFERMEDADES O AFECCIONES INFLAMATORIAS PARA LA MEDICIÓN DE COMPONENTES DEL COMPLEMENTO SOBRE LA SUPERFICIE DE GLÓBULOS BLANCOS, del 1 de Marzo de 2011, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un método para diagnosticar o controlar lupus sistémico eritematoso (SLE), que comprende: (a) determinar, en una muestra sanguínea del individuo, el nivel […]
UN MÉTODO PARA DETECTAR CÉLULAS T ACTIVADAS POR MITÓGENOS O ESPECÍFICAS DE ANTÍGENO, del 30 de Diciembre de 2010, de ST VINCENT'S HOSPITAL SYDNEY LIMITED: Un método para la detección cualitativa o cuantitativa de células T CD4+ específicas de antígeno y/o Células T CD8+ en un sujeto, dicho método […]
METODO DE ENRIQUECIMIENTO DE CELULAS FETALES, del 1 de Septiembre de 2010, de REVEALCYTE: Un método para enriquecer células fetales en una muestra de sangre materna en el que las células que son CD34+ y son capaces de adherirse a un soporte sólido se seleccionan, […]
PEPTIDOS ANTIGENICOS DEL CANCER DERIVADOS DE WT1, del 28 de Junio de 2010, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Utilización de un péptido de una secuencia de aminoácidos como la mostrada en cualquiera de las SEC ID Nos: 2, 8 y 9 para la preparación de […]
 PROCEDIMIENTO PARA ESTIMAR LA CANTIDAD DE TIPOS CELULARES DE NEUTROFILOS ESPECIFICOS, del 4 de Junio de 2010, de PHADIA AB: Un procedimiento para estimar in vitro la cantidad de células específicas en una muestra de un paciente, en el que se usan moléculas con especificidad celular para calcular […]
PROCEDIMIENTO PARA ESTIMAR LA CANTIDAD DE TIPOS CELULARES DE NEUTROFILOS ESPECIFICOS, del 4 de Junio de 2010, de PHADIA AB: Un procedimiento para estimar in vitro la cantidad de células específicas en una muestra de un paciente, en el que se usan moléculas con especificidad celular para calcular […]
EXPRESIÓN DIFERENCIAL DE LA CITOCINA EN CÁNCER HUMANO, del 29 de Diciembre de 2011, de APOGENIX GMBH: Un método in vitro para diagnosticar un tipo de cáncer, que comprende las etapas: (a) proporcionar una muestra procedente de un tumor epitelial que comprende células tumorales, […]