Método de producción de proteína TRAIL antitumoral.
Un método de producción de un medicamento para el tratamiento de tumor que comprende:
preparar un vector retroviral que codifica una molécula de TRAIL soluble (sTRAIL) y transfectar establemente pericitos adiposos (ADPC) con dicho vector retroviral.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2010/051850.
Solicitante: Dominici, Massimo.
Nacionalidad solicitante: Italia.
Dirección: Via Belfiore 16 44100 Ferrara (FE) ITALIA.
Inventor/es: DOMINICI,MASSIMO, BUSSOLARI,RITA, GRISENDI,GIULIA, CONTE,PIERFRANCO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción.
- A61K35/12 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N5/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
PDF original: ES-2519169_T3.pdf
Fragmento de la descripción:
Método de producción de proteína TRAIL antitumoral Campo de la invención
[1] La presente invención se refiere a un medicamento antitumoral que comprende pericitos adiposos (AD-PC) que expresan establemente TRAIL soluble (sTRAIL) de un vector retroviral.
Técnica anterior
[2] La palabra TRAIL se conoce para definir técnicamente una molécula que pertenece a la familia de los llamados ligandos de muerte, es decir, una familia de moléculas de factor de necrosis tumoral (TNF).
[3] En la práctica, una molécula de TRAIL puede inducir muerte celular en tejidos enfermos solo, y dejar los tejidos sanos, y por esta característica es una molécula particularmente interesante para su uso en tratamientos oncológicos y en otros campos biomédicos.
[4] El tratamiento basado en TRAIL de un organismo afectado por células tumorales puede producirse de dos maneras particulares: en la primera, la molécula de TRAIL se sintetiza químicamente de antemano, en cuyo caso se define como TRAIL recombinante, y después se administra al organismo afectado por el tumor; en la última, la molécula de TRAIL puede Introducirse en un organismo afectado por el tumor mediante un portador que consiste en una célula productora de TRAIL.
[5] En el primer caso, la necesidad se encontró para el uso combinado de agentes quimioterapéuticos para potenciar efectos antitumorales debido a que se ha encontrado que los últimos disminuyen progresivamente, debido a la semivida muy corta de la molécula de TRAIL, es decir, del orden de 2/3 minutos, la alta tasa de secreción renal de esta molécula y la resistencia de TRAIL. La combinación con fármacos quimioterapéuticos alenta el uso de la molécula de TRAIL recombinante debido a su capacidad de eliminación de células tumorales específica, pero esta combinación está afectada por la alta toxicidad hacia hepatocitos, linfocitos y osteoblastos, y conduce a efectos secundarios no deseados para el organismo.
[6] Además, debido a la corta semivida y la alta tasa de secreción, se requirió la administración repetida de fármacos quimioterapéuticos en combinación con TRAIL y esto provocó un aumento considerable de los costes globales tras administraciones repetidas de TRAIL. En el último caso, la molécula de TRAIL está contenida en un virus que se usa como vector para el mismo y permite la liberación de su composición genética que contiene la secuencia codificante de TRAIL, que después se traduce en una proteína y se transfiere a la membrana de la célula infectada por tal vector viral.
[7] Estas células infectadas se convierten en el medio que lleva TRAIL en contacto directo con células tumorales diana, produciendo así la apoptosis de las mismas.
[8] Los vectores virales usados para esto son vectores que pertenecen a la familia de los lentivirus o adenovirus.
[9] Las células infectadas por estos vectores pueden llevar la molécula de TRAIL a la localización del organismo en la que se requiere un efecto antitumoral, es decir, apoptosis de células neoplásicas.
[1] Para este fin se usan múltiples tipos de células, que tienen todas un tropismo particular por sitios de enfermedad tumoral: por ejemplo, se usan citoblastos hematopoyéticos y citoblastos mesenquimatosos.
[11] La técnica anterior desvela células humanas infectadas con un AAV2 recombinante (véase: Shi, Cáncer Res. 65(5): 1687-1692 (25)) o un plásmido (véase: Zhang, Acta Biochim. Pol 54(2): 37-313 (27)) o una construcción genérica (véase Courtete, Int. Advanced ICAS/APOTRAIN abstract book, abstract 15 (28)) que expresan sTRAIL.
[12] TRAIL soluble consiste en el dominio extracelular, concretamente los aminoácidos 114-281 (véase Shi, Cáncer Res. 65(5): 1687-1692 (25)) o 95-281 (véase: Zhang, Acta Biochim. Pol 54(2): 37-313 (27)), fusionado con un péptido señal de IgG humana (véase: Zhang, Acta Biochim. Pol 54(2) : 37-313 (27)).
[13] Mohr, J. Cell. Mol. Med. 12(6b): 2628-2643(28) desvelan citoblastos mesenquimatosos humanos que expresan TRAIL de un vector de adenovirus (como una fusión con E1, para tratar tumores.
[14] Sin embargo, esta técnica anterior todavía tiene ciertos inconvenientes.
[15] Un primer inconveniente es que el vector viral en uso puede tener restricciones considerables de uso debido a sus propiedades biológicas.
[16] Por ejemplo, si se usa un adenovirus, la mayor restricción consiste en la incapacidad del genoma viral de ser establemente integrado en el genoma de células infectadas, y esta característica genera una forma de corta duración transitoria de TRAIL, que está diseñada para agotarse, produciendo así una limitación de la duración del efecto terapéutico, como en la infusión de TRAIL recombinante.
[17] Un inconveniente adicional, independiente del vector viral en uso, es que los estudios que se han realizado y publicado hasta la fecha se han referido a la aplicación de TRAIL solo como proteína transmembrana y han ignorado la existencia de un dominio biológicamente activo de la molécula incluso en forma de un ligando soluble que tiene una fuerte actividad antitumoral. Esto implicó la generación de vectores celulares que podrían solo producir células de TRAIL como proteínas membrana que pueden inducir la apoptosis selectiva de la célula tumoral diana solo mediante el contacto directo permitido por la interacción entre TRAIL sobre la célula portadora y su receptor sobre la célula tumoral diana; por tanto, la célula portadora de TRAIL de membrana debe estar necesariamente localizada en la proximidad de o en contacto con la masa tumoral para garantizar su efecto terapéutico.
[18] Otro inconveniente es que la célula portadora de TRAIL de membrana localizada en la masa tumoral debe sobrevivir y proliferar durante el tiempo requerido para ejercer su acción antitumoral; así, la dosis de células que va a infundirse debe ser sustancialmente comparable al número de células tumorales que van a eliminarse, debido a que la acción citotóxica solo se produce mediante el contacto con células.
[19] Como se ha mencionado anteriormente, esto produce altos costes de producción de células y puede dar lugar a efectos secundarios asociados a la infusión en el paciente.
[2] Otro inconveniente es que la ausencia de una forma de TRAIL secretada ha prevenido estudios farmacocinéticos más intensos sobre células difusas, y la duración de su efecto con el tiempo podría no entenderse.
[21] Otro inconveniente es que células portadoras tales como células derivadas de hueso-médula ósea se han usado en los estudios, sin considerar que éstas podrían producir moléculas que pueden inhibir o incluso bloquear la acción antitumoral de moléculas de TRAIL. La célula usada como portador debe producir un pequeño número de o ningún receptor señuelo (tal como OPG), es decir, receptores que pueden secuestrar TRAIL, y prevenir que se una al receptor sobre la célula tumoral.
[22] Finalmente, la célula que se usa como portador, en el caso de citoblastos, no debe tener los receptores específicos de TRAIL (DR4 y DR5) que potencialmente pueden causar el suicidio de la célula portadora, y de ahí dificultar cualquier efecto terapéutico.
Divulgación de la invención
[23] La presente invención mejora la técnica anterior proporcionando un medicamento antitumoral que comprende pericitos adiposos (AD-PC) que expresan establemente TRAIL soluble (sTRAIL) de un vector retroviral. Por consiguiente, la invención se refiere a:
1. Un método para la producción de un medicamento para el tratamiento de un tumor, que comprende:
- preparar un vector retroviral que codifica una molécula de TRAIL soluble (sTRAIL), y
- transfectar establemente pericitos adiposos (AD-PC) con dicho vector retroviral.
2. El método de [1], en el que el vector retroviral se produce irreversiblemente por una línea celular productora.
3. El método de una cualquiera de [1] o [2], en el que el vector retroviral se produce constantemente y establemente por una línea celular productora.
4. El método una cualquiera de [1]-[3], en el que la célula AD-PC es una célula autóloga, alógena, humana o de animal.
5. El método de una cualquiera de [1]-[4], en el que TRAIL soluble se obtiene uniendo la secuencia codificante de TRAIL a una secuencia que codifica un péptido secretor. 6
6. Un medicamento antitumoral que comprende una célula de pericito adiposo (AD-PC) establemente transfectada con un retrovirus que expresa una molécula de TRAIL soluble (sTRAIL).
Breve descripción de los dibujos
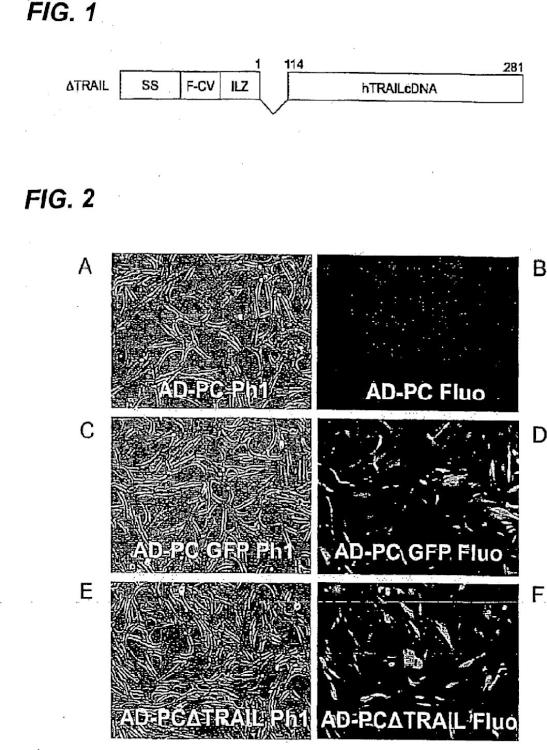
[24]
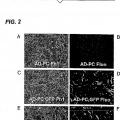
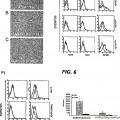
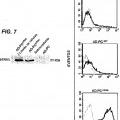
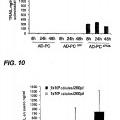
La Figura 1 es una representación esquemática de diversos dominios funcionales de la construcción de ATRAIL, en la que:
- SS es una... [Seguir leyendo]
Reivindicaciones:
1. Un método de producción de un medicamento para el tratamiento de tumor que comprende: preparar un vector retroviral que codifica una molécula de TRAIL soluble (sTRAIL) y transfectar establemente pericitos adiposos (AD-
PC) con dicho vector retroviral.
2. El método según la reivindicación 1, en el que dicho vector retroviral se produce irreversiblemente por una línea celular productora.
3. El método de una cualquiera de las reivindicaciones 1 o 2, en el que el vector retroviral se produce
constantemente y establemente por una línea celular productora.
4. El método de una cualquiera de las reivindicaciones 1-3, en el que las células (AD-PC) son una célula autóloga, alógena, humana o de animal.
5. El método de una cualquiera de las reivindicaciones 1-4, en el que TRAIL soluble se obtiene uniendo la secuencia codificante de TRAIL a una secuencia que codifica un péptido secretor.
6. Un medicamento antitumoral que comprende una célula de pericito adiposo (AD-PC) establemente transfectada 2 con un retrovirus que expresa una molécula de TRAIL soluble (sTRAIL).
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]