METODO Y COMPOSICIONES PARA LA PREVENCIÓN Y TRATAMIENTO DE LA ANEMIA.
Un análogo de la eritropoyetina humana que comprende al menos un sitio de glucosilación adicional en cualquiera de las posiciones 52,
53, 55, 86 y 114 de la secuencia de eritropoyetina humana, en el que una cadena de carbohidratos N-ligada se añade al sitio
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07004087.
Solicitante: AMGEN INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE THOUSAND OAKS, CA 91320-1799 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ELLIOTT, STEVEN, G., BROWNE, JEFFREY, K., EGRIE,JOAN,C.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Octubre de 1999.
Fecha Concesión Europea: 11 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A61K38/18B
- C07K14/505 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Eritropoyetina (EPO).
Clasificación PCT:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61P7/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antianémicos.
- C07K14/505 C07K 14/00 […] › Eritropoyetina (EPO).
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
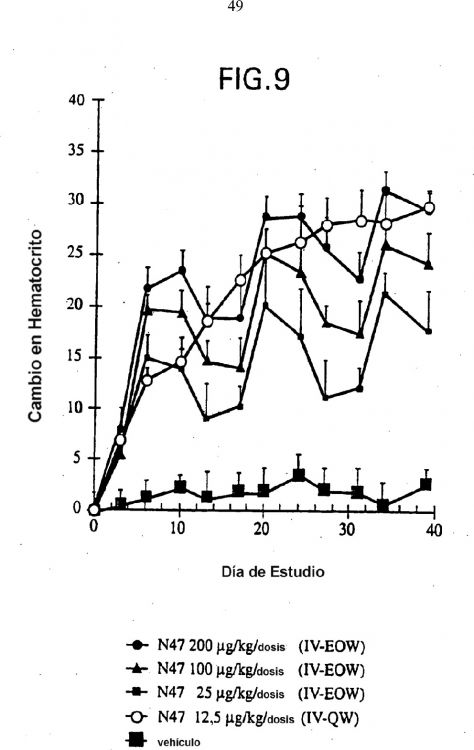
Fragmento de la descripción:
Campo de la Invención
La invención se refiere al aumento del hematocrito en un mamífero mediante el uso de análogos hiperglucosilados de eritropoyetina. Más particularmente, la invención se refiere a una dosificación menos frecuente de un análogo hiperglucosilado en comparación con eritropoyetina humana recombinante para aumentar y mantener el hematocrito y tratar la anemia. La invención también se refiere a la administración de cantidades más bajas de análogo hiperglucosilado en comparación con la eritropoyetina humana recombinante a una frecuencia de dosificación equivalente para aumentar y mantener el hematocrito y tratar la anemia. Los análogos hiperglucosilados nuevos de eritropoyetina también se proporcionan como se define en las reivindicaciones. Antecedentes de la Invención
La eritropoyetina (Epo) es una hormona glucoproteica necesaria para la maduración de células progenitoras eritroides a eritrocitos. Se produce en el riñón y es esencial para la regulación de los niveles de glóbulos rojos en la circulación. Las afecciones marcadas por niveles bajos de señal de oxígeno de tejido aumentaron la producción de Epo, lo que a su vez estimula la eritropoyesis. Una pérdida de la función renal como se observa en el fallo renal crónico (CRF), por ejemplo, da como resultado típicamente la producción disminuida de Epo y una reducción concomitante de glóbulos rojos.
La Epo urinaria humana se purificó por Miyake et al. (J. Biol. Chem. 252, 5558 (1977)) a partir de pacientes con anemia aplástica. Sin embargo, la cantidad de proteína Epo purificada obtenida a partir de esta fuente fue insuficiente para las aplicaciones terapéuticas. La identificación y clonaje del gen que codifica la Epo humana y la expresión de la proteína recombinante se describió en la Patente de Estados Unidos Nº 4.703.008 de Lin, la descripción de la cual se incorpora en el presente documento por referencia. Un método para la purificación de eritropoyetina humana recombinante a partir del medio celular se describe en la Patente de Estados Unidos Nº 4.667.016 de Lai et al. La producción de Epo biológicamente activa a partir de células hospedadoras de mamífero ha puesto a disposición, por primera vez, cantidades de Epo adecuadas para aplicaciones terapéuticas. Además, el conocimiento de la secuencia génica y la disponibilidad aumentada de proteína purificada ha conducido a un mejor entendimiento en modo de acción de esta proteína.
Tanto la Epo derivada urinaria humana (Miyake et al. anteriormente) como la Epo humana recombinante expresadas en células de mamífero contienen tres cadenas de oligosacáridos N-ligadas y una O-ligada que juntas comprenden aproximadamente el 40% del peso molecular de la glucoproteína. La glucosilación N-ligada se produce en restos de asparagina localizados en las posiciones 24, 38 y 83 mientras que la O-glucosilación se produce en un resto de serina localizado en la posición 126 (Lai et al. J. Bio. Chem. 261, 3116 (1986); Broudy et al. Arch. Biochem. Biophys. 265, 329 (1988)). Se ha mostrado que las cadenas de oligosacáridos se modifican con restos de ácido siálico terminales con cadenas N-ligadas que tienen típicamente hasta cuatro ácidos siálicos por cadena y cadenas O-ligadas que tienen hasta dos ácidos siálicos. Un polipéptido de Epo puede por lo tanto incorporar hasta un total de 14 ácidos siálicos.
Diversos estudios han mostrado que las alteraciones de las cadenas de carbohidratos de Epo pueden afectar la actividad biológica. En un estudio, sin embargo, la eliminación de unas cadenas de oligosacáridos N-ligadas u O-ligadas, individualmente o juntas, por mutagénesis de restos de asparagina o serina que son sitios de glucosilación reduce bruscamente la actividad in vitro de la Epo alterada que se produce en células de mamífero (Dube et. al. J. Biol. Chem. 263, 17516 (1988)). Sin embargo, DeLorme et al. (Biochemistry 31, 9871-9876 (1992)) presentaron que la eliminación de los sitios de glucosilación N-ligados en Epo redujo la actividad biológica in vivo pero no in vitro.
La relación entre el contenido de ácido siálico de Epo y la actividad biológica in vivo se describió determinando la actividad in vivo de isoformas de Epo aisladas. Se descubrió que un incremento gradual en el contenido de ácido siálico por molécula de Epo proporcionó un incremento gradual correspondiente en la actividad biológica in vivo como se midió por la capacidad de las concentraciones equimolares de isoformas de Epo aisladas para aumentar el hematocrito de ratones normales (Egrie et al. Glycoconjugate
J. 10, 263 (1993)). Aquellas isoformas Epo que tienen el contenido más alto de ácido siálico también exhibieron una semivida sérica más larga pero una afinidad disminuida por el receptor de Epo, lo que sugiere que la semivida sérica es un determinante importante de la actividad biológica in vivo.
La introducción de nuevos sitios de glucosilación en el polipéptido de Epo puede dar como resultado la producción de moléculas con cadenas de carbohidratos adicionales. Véase las Publicaciones PCT Nº WO 91/05867 y WO 94/09257. Se describen los análogos de glucosilación de Epo que tienen al menos una cadena de carbohidratos N-ligada adicional y/o que tienen al menos una cadena de carbohidratos O-ligada adicional. Se determinó que un análogo de glucosilación que tiene una cadena N-ligada adicional tenía una semivida circulante más larga en comparación con la Epo humana recombinante (rHuEpo) (isoformas 9-14) y con una isoforma purificada de rHuEpo que tiene 14 ácidos siálicos por molécula.
La administración de eritropoyetina humana recombinante (rHuEpo) es eficaz en el aumento de los niveles de glóbulos rojos en pacientes anémicos con una enfermedad renal en etapa terminal (Eschbach et al. New Eng. J. Med. 316,73-38 (1987)). Estudios posteriores han mostrado que el tratamiento con rHuEpo pueden corregir la anemia asociada con la variedad de otras afecciones. (Fischl et al. New Eng. J. Med. 322, 1488-1493 (1990); Laupacis, Lancet 1228-1232 (1993). Se han proporcionado aprobaciones reguladoras por el uso de rHuEpo en el tratamiento de la anemia asociada con CRF, anemia relacionada con la terapia con AZT (zidovudina) en pacientes infectados por VIH, anemia en pacientes con tumores no mieloides que reciben quimioterapia y anemia en pacientes que se han sometido a cirugía para reducir la necesidad de transfusiones sanguíneas alogénicas. La terapia actual para todas las indicaciones aprobadas (excepto la indicación de cirugía) implica una dosis de partida de entre 50-150 unidades/kg tres veces por semana (TIW) administrados por una inyección intravenosa (IV) o subcutánea (SC) para alcanzar un intervalo de hematocrito diana sugerido. Para la indicación de cirugía, rHuEpo se administra cada día 10 días antes de la cirugía, el día de la cirugía y cuatro días después de ella (Prospecto EPOGEN®, 12/23/96). En general, las dosis de partida recomendadas actuales para rHuEpo aumentan el hematocrito en el intervalo diana en aproximadamente de seis a ocho semanas. Una vez el intervalo de hematocrito diana se ha conseguido, se establece un régimen de dosificación de mantenimiento que variará dependiendo del paciente, pero es típicamente de tres veces por semana para pacientes anémicos con CRF. La administración de rHuEpo descrita anteriormente es un régimen eficaz y bien tolerado para el tratamiento de la anemia.
El documento EP 0267678 describe una célula epiteloide de roedor transformada con un vector de ADN recombinante incluyendo una secuencia de ADN que codifica la eritropoyetina humana, que es capaz de producir eritropoyetina humana glucosilada N-ligada y O-ligada.
Sería deseable tener una terapéutica con mayor potencia que rHuEPO. Una ventaja para esta molécula sería que podría administrarse menos frecuentemente y/o en una dosis menor. Los tratamientos actuales para pacientes que padecen anemia requieren la administración de EPOGEN® tres veces por semana y para los pacientes de cirugía la administración de una vez al día. Un régimen de dosificación menos frecuente sería más conveniente tanto para médicos como pacientes, especialmente aquellos pacientes que no hacen visitas programadas regularmente a los despachos o clínicas de los doctores o para aquellos que se inyectan a sí mismos su Epo. Otra ventaja de una molécula más potente es que se introduce menos fármaco en el paciente para un aumento comparable en el hematocrito.
Es por lo tanto un objetivo de la invención identificar moléculas más potentes para el tratamiento de la anemia que permitirán un régimen de...
Reivindicaciones:
1. Un análogo de la eritropoyetina humana que comprende al menos un sitio de glucosilación adicional en cualquiera de las posiciones 52, 53, 55, 86 y 114 de la secuencia de eritropoyetina humana, en el que una cadena de carbohidratos N-ligada se añade al sitio.
2. El análogo de la reivindicación 1 que comprende al menos dos sitios de glucosilación adicionales en el que una cadena de carbohidratos se une a cada uno de los sitios.
3. El análogo de la reivindicación 1 que comprende al menos tres sitios de glucosilación adicionales en el que la cadena de carbohidratos se une a cada uno de los sitios.
4. El análogo de la reivindicación 1 que comprende al menos cuatro sitios de glucosilación adicionales en el que la cadena de carbohidratos se une a cada uno de los sitios.
5. Un análogo de la eritropoyetina humana que se selecciona del grupo que
consiste en: Asn52 Thr64 Epo; Asn53 Thr55 Epo; Asn114 Thr118 Epo; Asn30 Thr32 Asn53 Thr5 Val87 Asn88 Thr90 Epo; Asn55 Thr57 Epo; Asn88 Val87 Thr88 Epo; Asn30 Thr32 Asn53 Thr55 Epo; Asn30 Thr32 Asn114 Thr116 Epo, y Asn30 Thr32 Asn53 Thr55 Val87 Asn88 Thr90 Asn114 Thr116 Epo.
6. El análogo de las reivindicaciones 1-5 que es el producto de la expresión de una secuencia de ADN exógena.
7. Una secuencia de ADN que codifica el análogo de las reivindicaciones 1
5.
8. Una célula hospedadora eucariota transfectada con la secuencia de ADN de la reivindicación 7 de un modo que permite a la célula hospedadora expresar el análogo.
9. Una composición que comprende una cantidad terapéuticamente eficaz del análogo de las reivindicaciones 1-5 junto con un vehículo, adyuvante o diluyente farmacéuticamente aceptable.
10. Uso del análogo de cualquiera de las reivindicaciones 1 a 5 para la preparación de una composición farmacéutica para el aumento y mantenimiento del hematocrito en un mamífero.
11. Uso del análogo de la reivindicación 10, en el que el análogo se va a administrar menos frecuentemente que una cantidad molar equivalente de eritropoyetina humana recombinante para obtener un hematocrito diana comparable.
12. Uso del análogo de la reivindicación 11, en el que la cantidad de análogo se va a administrar aproximadamente una vez por semana, aproximadamente una vez cada dos semanas o aproximadamente una vez al mes.
13. Uso del análogo de la reivindicación 10, en el que el análogo se va a administrar a una cantidad molar menor que una eritropoyetina humana recombinante para obtener un hematocrito diana comparable.
14. Uso del análogo de la reivindicación 12, en el que la cantidad del análogo que se va a administrar es aproximadamente de 0,025 a 1,5 g de péptido de eritropoyetina por kg por dosis tres veces por semana.
15. Uso del análogo de la reivindicación 12, en el que la cantidad de análogo que se va a administrar es menor aproximadamente de 0,025 g de péptido de eritropoyetina por kg por dosis tres veces por semana.
16. El análogo de cualquiera de las reivindicaciones 1 a 5 para su uso en el aumento y mantenimiento del hematocrito en un mamífero.
17. Un método para la producción de un análogo de eritropoyetina humana que comprende el cultivo de la célula hospedadora de la reivindicación 8 en condiciones que permitan la expresión del análogo y la recuperación del análogo del medio celular.
Patentes similares o relacionadas:
Método para purificar antitrombina, del 25 de Diciembre de 2019, de Kyowa Kirin Co., Ltd: Método para purificar antitrombina, que comprende las etapas de: (a) adsorber la antitrombina sobre el portador de intercambio aniónico, (b) lavar […]
Polipéptidos de acción prolongada y métodos para producirlos y administrarlos, del 4 de Diciembre de 2019, de OPKO Biologics Ltd: Un polipéptido que comprende una actividad biológica, dicho polipéptido comprende un péptido de interés, un solo péptido carboxilo terminal (CTP) de gonadotropina coriónica unido […]
Método simple para eliminación simultánea de múltiples impurezas a partir de sobrenadantes de cultivo a niveles ultrabajos, del 24 de Julio de 2019, de Serum Institute of India Private Limited: Un proceso de purificación que comprende: poner en contacto una mezcla que contiene una sustancia diana y uno o más contaminantes, en el que al menos […]
Expresión modificada de prolil-4-hidroxilasa en physcoitrella patens, del 19 de Junio de 2019, de Albert-Ludwigs-Universität Freiburg: Un procedimiento de fabricación de una proteína recombinante que comprende los pasos de - proporcionar células de Physcomitrella patens que comprende […]
ARN con una combinación de nucleótidos no modificados y modificados para la expresión de proteínas, del 3 de Abril de 2019, de ethris GmbH (100.0%): Polirribonucleótido con una secuencia que codifica una proteína o un fragmento de proteína, en el que el polirribonucleótido contiene una combinación […]
Terapia celular selectiva para el tratamiento de la insuficiencia renal, del 27 de Marzo de 2019, de WAKE FOREST UNIVERSITY HEALTH SCIENCES: Un metodo de produccion de una poblacion aislada de celulas productoras de EPO, comprendiendo dicho metodo las etapas de: proporcionar celulas […]
Animales no humanos modificados genéticamente que expresan EPO humana, del 6 de Febrero de 2019, de REGENERON PHARMACEUTICALS, INC.: Un roedor modificado geneticamente, que comprende: una secuencia de acido nucleico que codifica una proteina de eritropoyetina humana […]
Medicamentos para tratar anemia asociada con enfermedad renal, del 18 de Octubre de 2018, de FIBROGEN, INC.: Un compuesto para su uso en la prevención o tratamiento de anemia asociada con enfermedad renal en un sujeto, en donde el compuesto es un compuesto […]