Meganucleasa diseñada racionalmente con afinidad de formación de dímeros alterada.
Un monómero de meganucleasa recombinante que tiene afinidad alterada para la formación de dímeros con un monómero de meganucleasa de referencia,
que comprende:
un polipéptido que tiene al menos un 85 % de similitud de secuencia con los restos 2-153 del monómero de meganucleasa I-Crel de SEC ID Nº: 1;
en el que la afinidad por la formación de monómeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en:
(a) sustitución de K7, K57 o K96 por D o E; o
(b) sustitución de E8 o E61 por K o R.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E13164623.
Solicitante: Precision Biosciences.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 302 East Pettigrew Street Dibrell Building, Suite A-100 Durham, North Carolina 27701 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HELLINGA,HOMME,W, Smith,James Jefferson, Jantz,Derek.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/90 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción estable de ADN extraño en el cromosoma.
- C12N9/22 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Ribonucleasas.
PDF original: ES-2539616_T3.pdf



Fragmento de la descripción:
Meganucleasa diseñada racionalmente con afinidad de formación de dímeros alterada
Esta solicitud reivindica el beneficio de prioridad de la Solicitud Provisional de Patente de los Estados Unidos N2 60/727.512, presentada el 18 de octubre de 2005.
Apoyo gubernamental
La invención fue apoyada en parte por las subvenciones 2R01 -GM-0498712, 5F32-GM072322 y 5 DP1 OD000122 del National Institute of General Medical Sciences de los National Institues of Health de los Estados Unidos de América. Por lo tanto, el Gobierno de los Estados Unidos tiene determinados derechos sobre la invención.
Campo de la invención
La invención se refiere al campo de la biología molecular y de tecnología de ácidos nucleicos recombinantes. En particular, la invención se refiere a meganucleasas de origen no natural diseñadas racionalmente con especificidad de secuencia de reconocimiento de ADN alterada y/o afinidad alterada. La invención también se refiere a métodos para producir tales meganucleasas y métodos para producir ácidos nucleicos recombinantes y organismos que usan tales meganucleasas.
Antecedentes de la invención
La ingeniería genómica requiere la capacidad de insertar, suprimir, sustituir y manipular de otro modo secuencias genéticas específicas dentro de un genoma y tiene numerosas aplicaciones terapéuticas y biotecnológicas. El desarrollo de medios eficaces para modificación del genoma sigue siendo un objetivo importante en la terapia génica, agrotecnología y biología sintética (Porteus et al (2005), Nat. Biotechnol. 23:967-73; Tzfira et al (2005), Trends Biotechnol. 23:567-9; McDaniel et al (2005), Curr. Opin. Biotechnol. 16:476-83). Un método habitual para insertar o modificar una secuencia de ADN implica introducir una secuencia de ADN transgénico flanqueada por secuencias homologas a la diana genómica y seleccionar o explorar con respecto a un acontecimiento de recombinación homologa exitoso. La recombinación con el ADN transgénico se produce en pocas ocasiones pero puede estimularse por una rotura de doble cadena en el ADN genómico en el sitio diana. Se han empleado numerosos métodos para crear roturas de doble cadena de ADN, incluyendo irradiación y tratamientos químicos. Aunque estos métodos estimulan eficazmente la recombinación, las roturas de doble cadena se dispersan de forma aleatoria en el genoma, lo que puede ser altamente mutagénico y tóxico. En la actualidad, la incapacidad de dirigir modificaciones génicas a sitios únicos dentro de un fondo cromosómico es un impedimento importante para la ingeniería genómica exitosa.
Un enfoque para conseguir este objetivo es estimular la recombinación homologa en una rotura de doble cadena en un locus diana usando una nucleasa con especificidad para una secuencia que es suficientemente grande para estar presente solamente en un sitio sencillo dentro del genoma (véase, por ejemplo, Porteus et al (2005), Nat. Biotechnol. 23:967-73). La eficacia de esta estrategia se ha demostrado en diversos organismos usando fusiones quiméricas entre un dominio de unión de ADN de dedo de cinc obtenido por ingeniería genética y el dominio de nucleasa no específico de la enzima de restricción Fokl (Porteus (2006), Mol Ther 13:43846; Wright et al (2005), Plant J. 44:693-705; Umov et al (2005), Nature 435:646-51). Aunque estas nucleasas de dedos de cinc artificiales estimulan la recombinación específica de sitio, conservan actividad de escisión no específica residual resultante de la baja regulación del dominio nucleasa y escinden frecuentemente en sitios no pretendidos (Smith etal. (2000), Nucleic Acids Res. 28:3361-9). Tal escisión no pretendida puede provocar mutaciones y toxicidad en el organismo tratado (Porteus et al (2005), Nat. Biotechnol. 23:967-73).
Un grupo de nucleasas de origen natural que reconocen sitios de escisión de 15-40 pares de bases habitualmente hallados en los genomas de plantas y hongos puede proporcionar una alternativa de ingeniería genómica menos tóxica. Tales "meganucleasas" o "endonucleasas de búsqueda" se asocian frecuentemente con elementos de ADN parasitarios, tales como intrones de auto-corte y empalme de grupo 1 e inteínas. Promueven de forma natural la recombinación homologa o inserción génica en localizaciones específicas en el genoma hospedador produciendo una rotura de doble cadena en el cromosoma, que recluta la maquinaria de reparación de ADN celular (Stoddard (2006), Q. Rev. Biophys. 38:49-95). Las meganucleasas se agrupan habitualmente en cuatro familias: la familia LAGLIDADG, la familia GIY-YIG, la familia de caja His-Cys y la familia HNH. Estas familias se caracterizan por motivos estructurales, que afectan a la actividad catalítica y secuencia de reconocimiento. Por ejemplo, los miembros de la familia LAGLIDADG se caracterizan porque tienen una o dos copias del motivo LAGLIDADG conservado (véase Chevalier et al (2001), Nucleic Acids Res 29(18): 3757-3774). Las meganucleasas LAGLIDADG con una copia sencilla del motivo LAGLIDADG forman homodímeros, mientras que los miembros con dos copias del motivo LAGLIDADG se encuentran como monómeros. De forma similar, los miembros de la familia GIY-YIG tienen un módulo GIY-YIG, que es de 70-100 restos de longitud e incluye cuatro o cinco motivos de secuencia conservados con cuatro restos invariantes, dos de los cuales se requieren para actividad (véase Van Roey etal(2002), Nature Struct. Biol. 9:806-811). Las meganucleasas de caja His-Cys se caracterizan por una serie altamente conservada de histidinas y cisternas sobre una región que abarca varios cientos de restos de aminoácidos (véase Chevalier etal(2001), Nucleic Acids Res 29(18): 3757-3774).
En el caso de la familia NHN, los miembros se definen por motivos que contiene dos pares de histidinas conservadas rodeadas por restos de asparagina (véase Chevalier et al (2001), Nucleic Acids Res 29(18): 3757-3774). Las cuatro familias de meganucleasas están ampliamente separadas entre sí con respecto a elementos estructurales conservados y, en consecuencia, la especificidad de secuencia de reconocimiento de ADN y actividad catalítica.
Se han usado meganucleasas naturales, principalmente de la familia LAGLIDADG, para promover de forma eficaz la modificación genómica específica de sitio en plantas, levaduras, Drosophila, células de mamífero y ratones, pero este enfoque se ha limitado a la modificación de genes homólogos que conservan la secuencia de reconocimiento de meganucleasa (Monnat et al (1999), Biochem. Biophys. Res Commun. 255:88-93) o genomas previamente modificados por ingeniería genética en los que se ha introducido una secuencia de reconocimiento (Rouet efa/(1994), Mol Cell. Biol. 14:8096-106; Chilton et al (2003), Plant Physiol. 133:956 65; Puchta et al (1996), Proc. Nati. Acad. Sci. USA 93:5055-60; Rong et al (2002), Genes Dev 16:1568-81; Gouble et al (2006), J. Gene Med. 8(5):616-622).
La implementación sistemática de modificación génica estimulada por nucleasas requiere el uso de enzimas modificadas por ingeniería genética con especificidades adaptadas para dirigir roturas de ADN a sitios existentes en un genoma y, por lo tanto, ha habido gran interés en la adaptación de meganucleasas para promover las modificaciones génicas en sitios médica o biotecnológicamente relevantes (Porteus et al (2005), Nat. Biotechnol. 23:967-73; Sussman et al (2004), J. Mol. Biol. 342:31 -41; Epinat et al (2003), Nucleic Acids Res 31:2952-62).
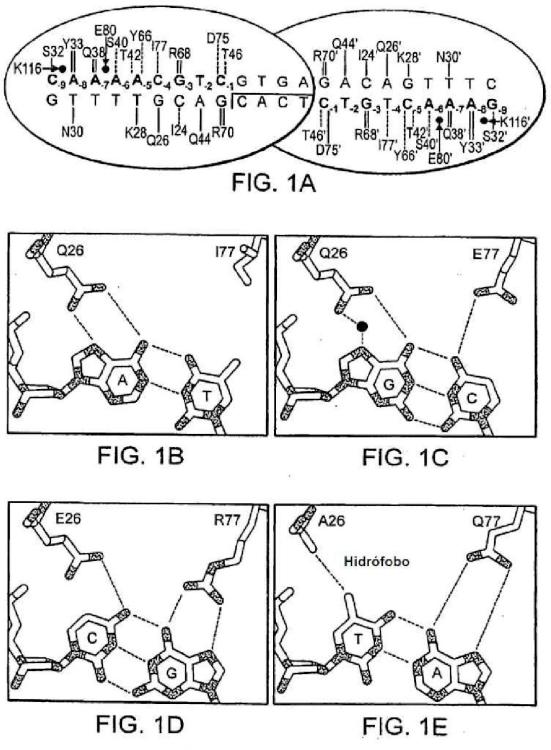
La meganucleasa l-Crel de Chlamydomonas reinhardtiies un miembro de la familia LAGLIDADG que reconoce y corta una secuencia de reconocimiento de 22 pares de bases en el cromosoma de cloroplastos y que presenta una diana atractiva para rediseño de meganucleasas. La enzima de tipo silvestre es un homodímero en el que cada monómero entra en contacto directo con 9 pares de bases en la secuencia de reconocimiento de longitud completa. Se han usado técnicas de selección genética para identificar mutaciones en l-Crel que alteran la preferencia de bases en una posición sencilla en esta secuencia de reconocimiento (Sussman et al (2004), J. Mol. Biol. 342:31 -41; Chames et al. (2005), Nucleic Acids Res 33: e178; Seligman et al (2002), Nucleic Acids Res 30:3870-9) o, más recientemente, en tres posiciones en la secuencia de reconocimiento (Arnould et al (2006), J. Mol Biol. 355:443-58). La interfaz de ADN-proteína l-Crel contiene nueve aminoácidos que entran en contacto con las bases de ADN directamente y al menos cinco posiciones adicionales que pueden formar contactos potenciales en interfaces modificadas. El tamaño de esta interfaz impone una complejidad combinatoria de la que es poco probable tomar muestras de forma adecuada en bibliotecas de secuencias construidas para seleccionar con respecto a enzimas con sitios de escisión drásticamente alterados..
... [Seguir leyendo]
Reivindicaciones:
1. Un monómero de meganucleasa recombinante que tiene afinidad alterada para la formación de dímeros con un monómero de meganucleasa de referencia, que comprende:
un polipéptido que tiene al menos un 85% de similitud de secuencia con los restos 2-153 del monómero de meganucleasa l-Crel de SEC ID N2: 1;
en el que la afinidad por la formación de monómeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en:
(a) sustitución de K7, K57 o K96 por D o E; o
(b) sustitución de E8 o E61 por K o R.
2. El monómero de meganucleasa recombinante de la reivindicación 1, en el que dicho polipéptido comprende las sustituciones K7D, K57D y K96D.
3. El monómero de meganucleasa recombinante de la reivindicación 1, en el que dicho polipéptido comprende las sustituciones K7E, K57E y K96E.
4. El monómero de meganucleasa recombinante de la reivindicación 1, en el que dicho polipéptido comprende las sustituciones E8K y E61K.
5. El monómero de meganucleasa recombinante de la reivindicación 1, en el que dicho polipéptido comprende las sustituciones E8R y E61R.
6. La meganucleasa recombinante de cualquier reivindicación anterior, en donde dicho monómero de meganucleasa de referencia es el monómero de meganucleasa de l-Crel de SEC ID N2: 1.
7. Un método para producir una célula eucariota genéticamente modificada que incluye una secuencia exógena de interés insertada en un cromosoma de dicha célula eucariota, que comprende:
transfectar una célula eucariota con uno o más ácidos nucleicos, incluyendo
(i) una primera secuencia de ácido nucleico que codifica un primer monómero de meganucleasa recombinante,
(ii) una segunda secuencia de ácido nucleico que codifica un segundo monómero de meganucleasa recombinante, y
(iii) una tercera secuencia de ácido nucleico que incluye dicha secuencia de interés;
en el que dichos primer y segundo monómeros de meganucleasa recombinante se expresan en dicha célula; en el que dichos monómeros de meganucleasa recombinante producen un sitio de escisión en dicho cromosoma y dicha secuencia de interés se inserta en dicho cromosoma en dicho sitio de escisión;
en el que dicho primer monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de la reivindicación 1, en donde la afinidad por la formación de dímeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en: (a) sustitución de K7, K57 o K96 con D o E; o en el que dicho primer monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de las reivindicaciones 2 o 3; y
en el que dicho segundo monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de la reivindicación 1, en donde la afinidad por la formación de dímeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en: (b) sustitución de E8 o E61 con K o R; o en el que dicho segundo monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de las reivindicaciones 4 o 5; y
en el que dicha célula eucariota no es una célula madre embrionaria humana (ES) o una célula germinal embrionaria humana (EG).
8. Un método para producir una célula eucariota genéticamente modificada alterando una secuencia diana en un cromosoma de dicha célula eucariota, que comprende:
transfectar una célula eucariota con uno o más ácidos nucleicos, incluyendo
(i) una primera secuencia de ácido nucleico que codifica un primer monómero de meganucleasa recombinante;
y
(ii) una segunda secuencia de ácido nucleico que codifica un segundo monómero de meganucleasa recombinante
en el que dicho primer monómero de meganucleasa recombinante y dicho segundo monómero de meganucleasa recombinante se expresan en dicha célula;
en el que dichos monómeros de meganucleasa recombinantes producen un sitio de escisión en dicho cromosoma y dicha secuencia diana se altera mediante la unión de extremos no homólogos en dicho sitio de escisión; en el que dicho primer monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de la reivindicación 1, en donde la afinidad por la formación de dímeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en: (a) sustitución de K7, K57 o K96 por D o E; o en el que dicho primer monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de las reivindicaciones 2 o 3; y
dicho segundo monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de la reivindicación 1, en donde la afinidad por la formación de dímeros se ha alterado mediante al menos una modificación correspondiente a una sustitución seleccionada del grupo que consiste en;
(b) sustitución de E8 o E61 por K o R; o en el que dicho segundo monómero de meganucleasa recombinante es un monómero de meganucleasa recombinante de las reivindicaciones 4 o 5; y en el que dicha célula eucariota no es una célula madre embrionaria humana (ES) o una célula germinal embrionaria humana (EG).
9. Un método para producir un organismo no humano genéticamente modificado que comprende:
producir una célula eucariota genéticamente modificada de acuerdo con el método de una cualquiera de las reivindicaciones 7 u 8; y
cultivar dicha célula eucariota genéticamente modificada para producir dicho organismo genéticamente modificado.
10. El método como en la reivindicación 9 en el que:
dicha célula eucariota se selecciona del grupo que consiste en un gameto, un cigoto, una célula de blastocisto, una célula madre embrionaria y una célula de protoplasto.
11. Una meganucleasa recombinante de una cualquiera de las reivindicaciones 1 a 6 para su uso como medicamento.
12. Un ácido nucleico aislado que codifica una meganucleasa recombinante de una cualquiera de las reivindicaciones 1 a 6 para su uso como medicamento.
13. El método como en la reivindicación 7, en el que:
dicho ácido nucleico que incluye dicha secuencia de interés comprende además secuencias homologas a secuencias que flanquean dicho sitio de escisión y dicha secuencia de interés se inserta en dicho sitio de escisión mediante recombinación homologa; o dicho ácido nucleico que incluye dicha secuencia de interés carece de homología sustancial con dicho sitio de escisión y dicha secuencia de interés se inserta en dicho cromosoma mediante unión de extremos no homólogos.
14. La meganucleasa recombinante de la reivindicación 11 para el uso de la reivindicación 11 o el ácido nucleico aislado que codifica una meganucleasa recombinante de la reivindicación 12 para el uso de la reivindicación 12, en donde dicho medicamento comprende además:
una secuencia de ácido nucleico que incluye una secuencia exógena de interés que se hay que insertar en el sitio de escisión en un cromosoma y secuencias homologas a secuencias que flanquean dicho sitio de escisión, en donde dicho sitio de escisión hay que escindirlo mediante dicha meganucleasa recombinante.
15. Uso de una meganucleasa recombinante de una cualquiera de las reivindicaciones 1 a 6 en la fabricación de un medicamento para tratar una infección por un patógeno viral o procariota en un hospedador eucariota alterando una secuencia diana en un genoma de dicho patógeno viral o procariota.
16. El uso de la reivindicación 15, en el que el patógeno es viral.
17. El uso de la reivindicación 15, en el que el patógeno es procariota.
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Métodos y composiciones para el tratamiento de enfermedades por almacenamiento lisosomal, del 27 de Mayo de 2020, de Sangamo Therapeutics, Inc: Uno o más transgenes y una o más nucleasas con dedos de zinc (ZFN) para su uso en un método de tratamiento de una enfermedad por almacenamiento lisosomal, el método […]
Terapias de aumento génico de la degeneración retiniana causada por mutaciones en el gen PRPF31, del 6 de Mayo de 2020, de MASSACHUSETTS EYE & EAR INFIRMARY: Un vector de virus adeno-asociado de tipo 2 (AAV2) que comprende una secuencia que codifica PRPF31 humano, operativamente enlazado a un promotor […]
Proteínas que tienen actividad nucleasa, proteínas de fusión y usos de estas, del 18 de Marzo de 2020, de HELMHOLTZ ZENTRUM MUNCHEN DEUTSCHES FORSCHUNGSZENTRUM FUR GESUNDHEIT UND UMWELT (GMBH): Una molécula de ácido nucleico que codifica (I) un polipéptido que tiene la actividad de una endonucleasa, que es (a) una molécula de ácido nucleico que […]
Animales no humanos que tienen una interrupción en un locus C9ORF72, del 19 de Febrero de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor que comprende en su genoma una deleción de la porción codificante del exón 2 hasta la porción codificante del exón 11 de un locus C9orf72 endógeno, […]
Métodos y composiciones para modificar un locus objetivo, del 12 de Febrero de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para la modificación en serie de un locus objetivo en una célula, que comprende: (a) proporcionar la célula que comprende el locus objetivo, en donde el locus objetivo […]
Modelo de cerdo para la diabetes, del 29 de Enero de 2020, de AARHUS UNIVERSITET: Un cerdo transgénico que comprende un gen de polipéptido amiloide de los islotes (IAPP) mutado humano o parte del mismo, y que muestra al menos […]
Procedimientos de modificación de células hospedadoras, del 22 de Enero de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una célula hospedadora procariota aislada, en la que i) un gen heterólogo que codifica una oligosacaril transferasa y ii) ADN de al menos 8 kb que codifica […]