Medios y procedimientos para influenciar la estabilidad de las células productoras de anticuerpos.
Un procedimiento para aumentar el ciclo de vida de replicación de una célula productora de anticuerpos,
quecomprende aumentar o mantener la cantidad del producto de expresión BCL6 y Blimp-1 en comparación con unlinfocito B de memoria o un linfocito B no expuesto previamente dentro de dicha célula productora de anticuerpos
- proporcionar dicha célula productora de anticuerpos con un compuesto capaz de potenciar la expresión deBCL6 y/o cultivar dicha célula productora de anticuerpos en presencia de un compuesto capaz de potenciar laexpresión de BCL6, y
- proporcionar dicha célula productora de anticuerpos con un compuesto capaz de aumentar la expresión deBlimp-1 y/o cultivar dicha célula productora de anticuerpos en presencia de un compuesto capaz de incrementarla expresión de Blimp-1.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2006/000625.
Solicitante: Academisch Medisch Centrum bij de Universiteit van Amsterdam.
Nacionalidad solicitante: Países Bajos.
Dirección: Meibergdreef 9 1105 AZ Amsterdam PAISES BAJOS.
Inventor/es: SPITS, HERGEN, SCHEEREN,FERENC ALEXANDER, BEAUMONT,TIM, DIEHL,SEAN ANDREW.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N5/0781 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células B; Sus progenitores.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
PDF original: ES-2444465_T3.pdf
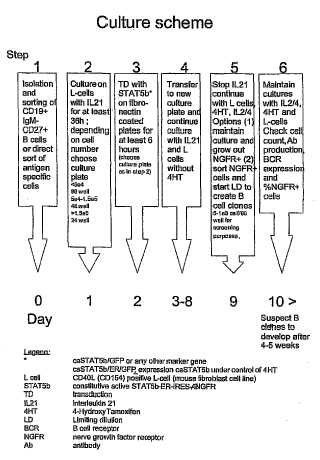
Fragmento de la descripción:
Medios y procedimientos para influenciar la estabilidad de las células productoras de anticuerpos La invención se refiere al campo de la biología celular.
Los cultivos celulares ex vivo son importantes herramientas en las actuales aplicaciones biológicas y médicas. Una importante aplicación es cultivar las células productoras de anticuerpos con el fin de cosechar anticuerpos, preferentemente anticuerpos monoclonales. Los anticuerpos monoclonales (AcMo) representan múltiples copias idénticas de una única molécula de anticuerpo cuyas copias se unen a los antígenos con la misma afinidad y estimulan las mismas funciones efectoras. Entre los beneficios de los AcMo está su especificidad por el mismo epítopo en un antígeno. Esta especificidad confiere determinadas ventajas clínicas en los AcMo en más tratamientos convencionales al tiempo que ofrece a los pacientes una opción terapéutica eficaz y bien tolerada con efectos secundarios generalmente bajos. Además, los mass son útiles para investigación biológica y médica.
La capacidad proliferativa de la mayoría de las células primarias en cultivo está limitada por la inducción de senescencia. Este estado de parada del crecimiento irreversible se caracteriza por la expresión de una serie de marcadores asociados con la senescencia, tales como la beta-galactosidasa asociada con la senescencia, el inhibidor del activador del plasminógeno 1 (PAI= 1) , p19ARF, p53, p21CIP1 y p16INK4A. Con el fin de proporcionar una línea celular proliferante, las células a menudo se unen a células cancerosas con el fin de producir células de hibridoma. Las células de hibridoma resultantes son capaces de dividirse indefinidamente y de crecer bien en los cultivos celulares. Los hibridomas individuales con una característica deseada se pueden seleccionar para un fin dado.
Con el fin de obtener directamente anticuerpos monoclonales humanos con una especificidad deseada, sería inconveniente aislar un linfocito B capaz de producir dicho anticuerpo y cultivar el linfocito B ex vivo. No obstante, la tecnología de los hibridomas con linfocitos B humanos no ha tenido éxito porque los hibridomas resultantes son inestables. Se han realizado muchos intentos para cultivar ex vivo linfocitos B. Está bien documentado que los linfocitos B humanos no expuestos previamente y de memoria se pueden cultivar durante un periodo de tiempo limitado tras el engarce de CD40 en presencia de citocinas, incluidas IL-2, IL-4 e IL-10 (Banchereau et al., 1991) y se cree que este sistema imita la respuesta in vivo de los linfocitos B frente los linfocitos T colaboradores que expresan CD40L al antígeno afín. En ausencia de unión a CD40, la IL-10 sola o combinada con IL-2 induce diferenciación en células productoras de anticuerpos (Malisan et al., 1996) . Los mecanismos de regulación de la supervivencia y la proliferación de los linfocitos B maduros cultivados en estas condiciones solo se conocen parcialmente.
La interacción de CD40 sobre los linfocitos B tiene múltiples efectos, incluida la protección contra la apoptosis, la inhibición (parcial) de la diferenciación y la inducción de la respuesta de los linfocitos B a las citocinas. La expresión de un gran número de inhibidores del ciclo celular disminuyó mediante la interacción de CD40, incluidos Rb-1 y Rb-2 (Dadgostar et al., 2002) y es probable que la regulación por disminución de dichos genes libere a los linfocitos B en reposo de la quiescencia. Aunque la activación de CD40 conduce a una breve respuesta proliferativa, las citocinas son un instrumento a la hora de mantener la progresión del ciclo celular de los linfocitos B activados. La IL-2 y la IL-4 son las citocinas más eficaces que estimulan una continua progresión del ciclo celular de CD40 o de linfocitos B estimulados por Ig en superficie. En cualquier caso, los cultivos de linfocitos B en los artículos mencionados anteriormente solo son estables durante un periodo de tiempo limitado.
Otro enfoque para inmortalizar los linfocitos B es la transformación del virus de Epstein-Barr virus (EBV) . No obstante, la frecuencia de los linfocitos B que son transformados por el EBV es baja y, por tanto, los intentos para generar linfocitos B transformados con el VEB que producen los anticuerpos deseados han tenido poco éxito. Recientemente, Traggiai et al han notificado un procedimiento para una transformación más eficiente del virus de Epstein-Barr de los linfocitos B que aumentó la frecuencia de linfocitos B transformados. Con este procedimiento, los linfocitos B obtenidos de un paciente que se recuperó de una infección por coronavirus que produce el síndrome respiratorio agudo grave (SRAG-CoV) se transformaron con el EBV y se aislaron clones de linfocitos B transformados que producen anticuerpos monoclonales específicos del SRAG y otras proteínas (Traggiai et al, 2004) .
Otro enfoque más para inmortalizar los linfocitos B se describe en la solicitud de patente WO 03/052083. Esta solicitud describe un procedimiento de estabilizar linfocitos B en el que los linfocitos B humanos se transducen con un transductor de la señal activo de forma constitutiva de la activación y la transcripción (CA-STAT) . Se observó un ciclo de vida prolongado de los linfocitos B. No obstante, los linfocitos B en replicación no fueron capaces de producir anticuerpos al mismo tiempo. Los anticuerpos se pudieron obtener deteniendo la replicación de las células, de modo que se produjo la diferenciación terminal. Las células diferenciadas terminalmente produjeron anticuerpos durante un tiempo restringido, tras el cual las células diferenciadas murieron. No obstante, los linfocitos B en replicación del documento WO 03/052083 pierden su capacidad de desarrollarse en células productoras de anticuerpos después de cultivar 1, 5-2 meses o más, haciendo que estos cultivos de linfocitos B sean inadecuados para la producción de anticuerpos.
Aunque se han descrito varios enfoques para cultivar las células productoras de anticuerpos, todavía existe la necesidad de medios y procedimientos para influir sobre la estabilidad de las células productoras de anticuerpos. Es un objeto de la presente invención proporcionar dichos medios y procedimientos.
De acuerdo con lo anterior, la invención proporciona un procedimiento para influir sobre la estabilidad de una célula productora de anticuerpos, que comprende, directa o indirectamente, influir sobre la cantidad de los productos de expresión BCL6 y Blimp-1 dentro de dicha célula productora de anticuerpos. Las cantidades de ambos productos de expresión BCL6 y Blimp-1 dentro de dicha célula productora de anticuerpos están reguladas, ya que ambos productos de expresión están implicados en la estabilidad de una célula productora de anticuerpos. La estabilidad de una célula productora de anticuerpos se define como la capacidad de dicha célula productora de anticuerpos para permanecer en determinada etapa del desarrollo (opcionalmente después de haber llevado a dicha célula a dicha etapa) . Diferentes etapas del desarrollo de una célula implican al menos una característica diferente de dicha célula. Por ejemplo, se sabe que un linfocito B de memoria se diferencia tras la estimulación en una célula plasmáticas secretora de anticuerpos mediante una etapa que algunos investigadores denominan plasmablastos. Un linfocito B de memoria, un plasmablasto y una célula plasmática son diferentes etapas del desarrollo de un linfocito B, en el que el linfocito B tiene diferentes características. Un linfocito B de memoria exhibe baja proliferación y secreción de anticuerpos. Un plasmablasto exhibe una proliferación más alta y niveles más altos de secreción de anticuerpos en comparación con un linfocito B de memoria, mientras que una célula plasmática secreta niveles altos de anticuerpos pero no es capaz de proliferar. Estas tres etapas del desarrollo también se caracterizan por diferencias en los marcadores de superficie celular, como se muestra en la Tabla 1.
Con un procedimiento de la invención, ha sido posible regular el ciclo de vida replicativo de una célula productora de anticuerpos. Un ciclo de vida replicativo de una célula productora de anticuerpos se define en el presente documento como el ciclo de vida en el que un linfocito B y sus células progenie son capaces de replicarse al tiempo que mantienen su capacidad de producir anticuerpos y/o de desarrollarse en una célula que produce un anticuerpo. El ciclo de vida replicativo de una célula productora de anticuerpos se acorta, por ejemplo, forzando el paso de una célula productora de anticuerpos a otra etapa de desarrollo. En una realización, el ciclo de vida replicativo de una célula productora de anticuerpos se acorta forzando el paso de dicha célula a la diferenciación terminal. Esta se... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para aumentar el ciclo de vida de replicación de una célula productora de anticuerpos, que comprende aumentar o mantener la cantidad del producto de expresión BCL6 y Blimp-1 en comparación con un linfocito B de memoria o un linfocito B no expuesto previamente dentro de dicha célula productora de anticuerpos
- proporcionar dicha célula productora de anticuerpos con un compuesto capaz de potenciar la expresión de BCL6 y/o cultivar dicha célula productora de anticuerpos en presencia de un compuesto capaz de potenciar la expresión de BCL6, y -proporcionar dicha célula productora de anticuerpos con un compuesto capaz de aumentar la expresión de Blimp-1 y/o cultivar dicha célula productora de anticuerpos en presencia de un compuesto capaz de incrementar la expresión de Blimp-1.
2. Un procedimiento de acuerdo con la reivindicación 1, que comprende proporcionar dicha célula productora de anticuerpos con una secuencia de ácido nucleico que codifica BCL6 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
3. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-2, que comprende proporcionar dicha célula productora de anticuerpos con STAT5 o una parte funcional o derivado funcional capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
4. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-3, que comprende proporcionar dicha célula productora de anticuerpos con una secuencia de ácido nucleico que codifica STAT5 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos y/o en el que dicha célula productora de anticuerpos se cultiva en presencia de STAT5 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
5. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-4, en el que dicho compuesto capaz de aumentar la expresión de Blimp-1 comprende:
- STAT3 o una parte funcional o derivado funcional de la misma capaz de aumentar por regulación la expresión de Blimp-1 y/o -un compuesto capaz de potenciar la expresión de STAT3.
6. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-5, en el que dicho compuesto capaz de aumentar la expresión de Blimp-1 comprende IL-21, IL-6, IL-7, IL-10, IL-15, IL-27, una proteína SOCS, una de las proteínas E47, E12, E2-2 o HEB, una Janus quinasa mutada y/o una secuencia de ácido nucleico que codifica STAT3 o una parte funcional o derivado funcional de la misma capaz de aumentar por regulación la expresión de r Blimp 1.
7. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-6, que comprende proporcionar dicha célula productora de anticuerpos con un agente de inmortalización adicional.
8. Un procedimiento de acuerdo con la reivindicación 7, en el que dicho agente de inmortalización comprende un agente transformante.
9. Un procedimiento de acuerdo con la reivindicación 7 u 8, en el que dicho agente de inmortalización comprende el virus de Epstein-Barr.
10. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 7-9, en el que dicha célula productora de anticuerpos se cultiva en presencia de IL-21 antes de proporcionar a dicha célula productora de anticuerpos una secuencia de ácido nucleico que codifica BCL6 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos y/o una secuencia de ácido nucleico que codifica STAT5 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
11. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-10, en el que dicha célula productora de anticuerpos se cultiva en presencia de IL-21 y está provista del virus de Epstein-Barr.
12. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-11, que además comprende aumentar la cantidad del producto de expresión Bcl-xL dentro de dicha célula productora de anticuerpos.
13. Un procedimiento de acuerdo con la reivindicación 12, que comprende proporcionar dicha célula productora de anticuerpos con una secuencia de ácido nucleico que codifica Bcl-xL o una parte funcional, derivado y/o análogo de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
14. Un procedimiento de acuerdo con la reivindicación 13, que comprende proporcionar dicha célula productora de anticuerpos con un compuesto capaz de potenciar la expresión de Bcl-xL.
15. Un procedimiento de acuerdo con la reivindicación 14, en el que dicho compuesto comprende estimulación con APRIL, BAFF, CD40, BCR, citocinas, factores de crecimiento o efectores cadena abajo como JNK y AKT (PKB) .
16. Un procedimiento para producir una célula productora de anticuerpos que es capaz de replicarse durante al menos una semana, comprendiendo el procedimiento:
-incrementar un nivel de expresión de Blimp-1 en un linfocito B en comparación con un linfocito B de memoria o linfocito B de memoria, proporcionando dicho linfocito B con un compuesto capaz de incrementar la expresión de Blimp -1 y/o cultivando dicho linfocito B en presencia de un compuesto capaz de incrementar la expresión de Blimp-1; y
-incrementar y/o mantener un nivel de expresión de BCL6 en comparación con un linfocito B de memoria o linfocito B no expuesto previamente, proporcionando dicho linfocito B con un compuesto capaz de potenciar la expresión de BCL6 y/o cultivando dicho linfocito B en presencia de un compuesto capaz de potenciar la expresión de BCL6.
17. Un procedimiento de acuerdo con la reivindicación 16, en el que el nivel de expresión de BCL6 en dicha célula se consigue y/o se mantiene esencialmente al mismo nivel, o a un nivel superior, en comparación con un plasmablasto.
18. Un procedimiento de acuerdo con la reivindicación 16 o 17, que comprende:
-proporcionar dicho linfocito B con un compuesto capaz de potenciar la expresión de Blimp-1 y/o cultivar dicho linfocito B en presencia de un compuesto capaz de potenciar la expresión de Blimp-1; y
-proporcionar dicho linfocito B con una secuencia de ácido nucleico que codifica BCL6 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos y/o una secuencia de ácido nucleico que codifica STAT5 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos, y/o -cultivar dicho linfocito B en presencia de STAT5 o una parte funcional o derivado funcional de la misma capaz
de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
19. Un procedimiento de acuerdo con la reivindicación 18, en el que dicho compuesto capaz de potenciar la expresión de Blimp-1 comprende IL-21, IL-6, IL-7, IL-10, IL-15, IL-27, una proteína SOCS, las proteínas E E47, E12, E2-2 o HEB, una Janus quinasa mutada y/o una secuencia de ácido nucleico que codifica STAT3 o una parte funcional o derivado funcional de la misma capaz de aumentar por regulación la expresión de r Blimp 1.
20. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 16-19, que además comprende aumentar un nivel de expresión de Bcl-xL dentro de dicha célula.
21. Un procedimiento de acuerdo con la reivindicación 20, que comprende proporcionar dicho linfocito B con un compuesto capaz de potenciar la expresión de Bcl-xL.
22. Un procedimiento de acuerdo con la reivindicación 21, en el que dicho compuesto capaz de potenciar la
expresión de Bcl-xL comprende un ácido nucleico que codifica Bcl-xL o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
23. Un procedimiento de acuerdo con la reivindicación 21, en el que dicho compuesto capaz de potenciar la expresión de Bcl-xL comprende estimulación con APRIL, BAFF, CD40, BCR, citocinas, factores de crecimiento o efectores cadena abajo como JNK y AKT (PKB) .
24. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 2-23, en el que la expresión de dicha secuencia de ácido nucleico que codifica BCL6, STAT5, STAT3, Bcl-xL, o una parte funcional, derivado funcional y/o análogo funcional de BCL6, STAT5 y/o STAT3 y/o Bcl-xL está regulada por un activador y/o represor que es inducible por un compuesto exógeno.
25. Un procedimiento de acuerdo con una cualquiera de las reivindicacione.
16. 24, que comprende:
-incrementar un nivel de expresión de Blimp-1 en un linfocito B; -proporcionar dicho linfocito B con BCL6 y/o STAT5, o una parte funcional o derivado funcional de las mismas capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos; -proporcionar dicho linfocito B con el virus de Epstein-Barr; y -cultivar dicho linfocito B.
26. Un procedimiento de acuerdo con la reivindicación 25, que comprende:
- analizar en una pluralidad de linfocitos B una especificidad por un antígeno dado; -seleccionar al menos un linfocito B con una especificidad por dicho antígeno dado; -incrementar un nivel de expresión de Blimp-1 en dicha célula; -proporcionar dicho linfocito B seleccionado con BCL6 y/o STAT5 exógenas, o una parte funcional o derivado
funcional de las mismas capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos; -seleccionar un linfocito B que comprende BCL6 y/o STAT5 exógenas, o una parte funcional o derivado funcional de las mismas capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos; y -proporcionar dicho linfocito B con el virus de Epstein-Barr.
27. Un procedimiento de acuerdo con la reivindicación 25 o 26, en el que dicho linfocito B se cultiva en presencia de IL-21.
28. Un procedimiento de acuerdo con una cualquiera de las reivindicacione.
2. 27, en el que dicho linfocito B se cultiva en presencia de IL-21 antes de introducir en dicho linfocito B BCL6 y/o STAT5, o una parte funcional o derivado funcional de las mismas capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
29. Un procedimiento de acuerdo con una cualquiera de las reivindicacione.
2. 28, que comprende además proporcionar dicho linfocito B con Bcl-xL o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
30. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-29, en el que se cultiva una célula productora de anticuerpos que es capaz de replicarse durante al menos tres meses.
31. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-30, en el que dicha célula productora de anticuerpos es capaz de producir anticuerpos contra un antígeno de interés.
32. Un procedimiento de acuerdo con la reivindicación 31, en el que dicha célula productora de anticuerpos se ha obtenido de un individuo en el que el individuo ha estado expuesto previamente a dicho antígeno de interés.
33. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-32, que además comprende expresar un gen de dicho linfocito B que codifica la cadena pesada de Ig y/o la cadena ligera de Ig en una segunda célula.
34. Una célula productora de anticuerpos que es capaz de replicarse durante al menos nueve semanas, en la que se coexpresan BCL6 and Blimp-1.
35. Una célula productora de anticuerpos que es capaz de replicarse durante al menos nueve semanas y que comprende un compuesto que aumenta o mantiene la cantidad del producto de expresión Blimp-1 y que comprende una secuencia de ácido nucleico exógena que codifica BCL6 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos y/o una secuencia de ácido nucleico exógena que codifica STAT5 o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
36. Una célula productora de anticuerpos de acuerdo con la reivindicación 35, que comprende una secuencia de ácido nucleico exógena que codifica Bcl-xL o una parte funcional o derivado funcional de la misma capaz de aumentar el ciclo de vida de replicación de una célula productora de anticuerpos.
37. Una célula productora de anticuerpos de acuerdo con una cualquiera de las reivindicacione.
3. 36, que comprende un compuesto que aumenta o mantiene la expresión de Blimp-1.
38. Una célula productora de anticuerpos de acuerdo con una cualquiera de las reivindicacione.
3. 37, que comprende una secuencia de ácido nucleico exógena que codifica STAT3 o una parte funcional o derivado funcional de la misma capaz de regular por aumento la expresión de Blimp-1.
39. Una célula productora de anticuerpos de acuerdo con una cualquiera de las reivindicacione.
3. 38, en la que la expresión de dicha secuencia de ácido nucleico que codifica BCL6, STAT5, STAT3, Bcl-xL, o una parte funcional o derivado funcional de BCL6, STAT5 y/o STAT3 y/o Bcl-xLy/o está regulada por un activador y/o represor que es inducible por un compuesto exógeno.
40. Una célula productora de anticuerpos que comprende:
- un agente de inmortalización, preferentemente un agente transformante, más preferentemente el virus de Epstein Barr; y -un compuesto que aumenta o mantiene la cantidad del producto de expresión Blimp-1 en dicha célula y -BCL6 exógena o una parte funcional o derivado funcional de la misma que aumenta el ciclo de vida de replicación de una célula productora de anticuerpos o STA5 exógena o una parte funcional o derivado funcional de la misma que aumenta el ciclo de vida de replicación de una célula productora de anticuerpos.
41. Una célula productora de anticuerpos de acuerdo con la reivindicación 40, que comprende:
- un compuesto que aumenta o mantiene la cantidad del producto de expresión Bcl-xL en dicha célula.
42. Un procedimiento para producir una línea de linfocitos B, que comprende:
-obtener una célula productora de anticuerpos con un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-33, y -cultivar dicha célula productora de anticuerpos ex vivo.
43. Un procedimiento de acuerdo con la reivindicación 42, que comprende:
-producir una célula productora de anticuerpos que es capaz de replicarse durante al menos una semana usando un linfocito B de memoria y/o un linfocito B no expuesto previamente de un individuo que ha estado expuesto a un antígeno de interés en un procedimiento de acuerdo con una cualquiera de las reivindicaciones 133, y
-cultivar dicha célula productora de anticuerpos ex vivo.
44. Un procedimiento para obtener anticuerpos, que comprende:
-obtener una célula productora de anticuerpos con un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-33; -cultivar dicha célula productora de anticuerpos ex vivo, y
-cosechar los anticuerpos producidos por dicha célula productora de anticuerpos.
45. Un procedimiento para producir anticuerpos capaces de unirse específicamente a un antígeno de interés, comprendiendo el procedimiento:
-producir una célula productora de anticuerpos que es capaz de replicarse durante al menos una semana usando un linfocito B de memoria capaz de diferenciarse en un linfocito B, en el que el linfocito B produce
anticuerpos capaces de unirse específicamente a dicho antígeno de interés en un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-33, y -obtener anticuerpos producidos por dicha célula productora de anticuerpos.
46. Un procedimiento de acuerdo con la reivindicación 45, que comprende cultivar adicionalmente dicha célula productora de anticuerpos ex vivo.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]