Procedimiento de producción de lipasa, célula de Yarrowia lipolytica transformada apta para producir dicha lipasa y sus aplicaciones.
Procedimiento de producción de lipasa recombinante que comprende:
a) una etapa en el transcurso de la cual se procede a la puesta en cultivo de células de Yarrowia lipolytica transformadas por un vector de expresión que comprende un módulo de expresión de una lipasa acidorresistente de levadura, y
b) una etapa en el transcurso de la cual se recoge, en el sobrenadante de dicho cultivo, la lipasa recombinante producida por dichas células;
estando caracterizado dicho procedimiento porque la etapa a) de puesta en cultivo se pone en práctica en un medio de cultivo desprovisto de productos de origen animal o de mezclas no caracterizadas constituidas por materiales proteicos de origen animal o de sus productos de digestión enzimática,
y porque dicha etapa a) comprende:
a1) el precultivo de las células transformadas de Yarrowia lipolytica en un medio que contiene una fuente de carbono de origen glucídico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas; y
a2) una etapa de fermentación que comprende una fase de crecimiento celular en un medio que contiene como única fuente de carbono una fuente de carbono de origen glucídico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas, y una fase de producción de lipasa en un medio que contiene como única fuente de carbono ácido oleico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2006/001352.
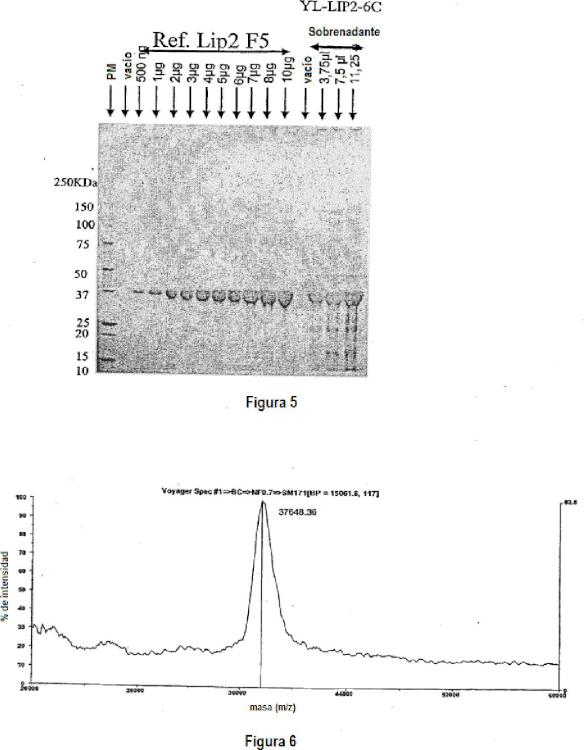
Solicitante: LABORATOIRES MAYOLY SPINDLER.
Nacionalidad solicitante: Francia.
Dirección: 6, AVENUE DE L'EUROPE 78400 CHATOU FRANCIA.
Inventor/es: MARTY, ALAIN, LEBLOND,YVES, MOUZ,NICOLAS, URIBELARREA,JEAN-LOUIS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K14/39 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de levaduras.
- C12N9/20 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Escisión de triglicéridos, p. ej. por medio de lipasa.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2550537_T3.pdf
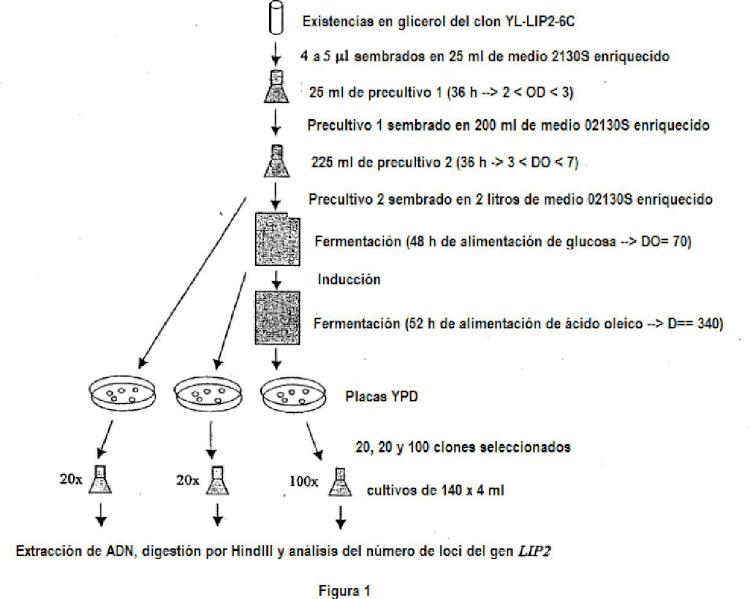
Fragmento de la descripción:
Procedimiento de producción de lipasa, célula de Yarrowia lipolytica transformada apta para producir dicha lipasa y sus aplicaciones
La presente invención se refiere a un procedimiento de producción de lipasa que emplea células de levadura Yarrowia lipolytica productoras de una lipasa recombinante acidorresistente, permitiendo dicho procedimiento la obtención de una lipasa apta para emplearse como medicamento; la presente invención se refiere igualmente a una cepa de Yarrowia lipolytica sobreproductora de lipasa recombinante acidorresistente y a sus aplicaciones.
Los alimentos ingeridos diariamente por el hombre están constituidos esencialmente por lípidos, proteínas y azúcares. Todos estos constituyentes experimentan, antes de su absorción, una hidrólisis catalizada por las enzimas del tracto digestivo. Un déficit de alguna de estas enzimas puede conllevar por tanto problemas digestivos y conducir a una desnutrición importante. Es por ejemplo el caso en ciertas situaciones patológicas, como la muscoviscidosis o la insuficiencia pancreática exocrina, a las que está asociado un déficit de lipasa pancreática. Se ha propuesto clásicamente para corregir este déficit administrar por vía oral extractos pancreáticos. Sin embargo, la eficacia de esta terapia está limitada por el hecho de que las enzimas contenidas en estos extractos (lipasas, amilasas y proteasas) se inactivan rápidamente por la acidez del medio gástrico.
Se ha propuesto por tanto utilizar preparaciones de lipasas que resistan a las condiciones gástricas, tales como por ejemplo preparaciones de lipasa gástrica de mamíferos producidas por ingeniería genética, como la descrita en la solicitud de patente francesa publicada con el número 2.699.179 a nombre del INSTITUI DE RECHERCHE JOUVENIAL SA o preparaciones de lipasas de microorganismos que posean una actividad correcta en medio ácido [ZENTLER-MONRO et al.. Páncreas, 7, 311-319(1992)].
Entre las lipasas de microorganismos activas en medio ácido, se citarán en particular las lipasas fúngicas, tales como las de Candida ernobii, [YOSHIDA et al., Biochim. Biophvs, Acta; 154, 586-588, (1968)], de Trichosporon asteroide [DHARMSTHITI et al., Biotechnol. AppI. Biochem., 26, 111-116 (1997)], de Rhizopus javanicus [(UYTTENBROECK et al., Biol. Chem. Hoppe Sevler. 374, 245-254, (1993)] o de Yarrowia lipolytica [HADEBALL, Acta Biotechnol.. 2, 159-167 (1991); NOVOTNY et al., J. Basic Microbiol., 28, 221-227 (1988)]. Además de su actividad a pH ácido, estas lipasas presentan las características comunes de ser resistentes, en presencia de su sustrato, a la digestión por proteasas (tripsina, quimotripsina y pepsina) y de ser resistentes a la acción de las sales biliares (su actividad se conserva en presencia de taurocolato de sodio 10 mM).
Se ha descrito ya la utilización de Yarrowia lipolytica para la producción de un gen de interés. Así, la solicitud EP 1.108.043, a nombre del INRAy del CNRS, describe la utilización de un vector ¡ntegrativo que comprende un módulo de expresión de un gen de interés y secuencias zeta, correspondientes a las secuencias de LTR del retrotransposón Ylt de Yarrowia lipolytica. Dicho vector de expresión permite la integración no homologa y dispersada de varias copias del inserto de interés en el ADN genómico de una cepa de Yarrowia lipolytica desprovista de secuencias zeta. Este sistema se ha usado especialmente para la integración del gen LIP2 que codifica una lipasa en el ADN de Yarrowia lipolytica y ha permitido, en condiciones de cultivo que no se detallan, una secreción de lipasa de 10 a 15 veces superior a la de cepas no transformadas.
Otros estudios describen la utilización del mismo vector de expresión que el descrito en la solicitud de patente EP 1.108.043 para la producción de una lipasa recombinante en Yarrowia lipolytica (solicitud internacional WO 01/83773; PIGNEDE et al., Journal of Bacterioloav. vol. 182, n° 10, pág. 2802-2810 (2000) y PIGNEDE et al., Applied and Enviromnental Microbioloqy. vol. 66, n° 8, p3283-3289 (2000). Así:
La solicitud internacional WO 01/83773, a nombre de Laboratoires MAYOLY SPINDLER, describe la obtención del clon de Yarrowia lipolytica MS4 (CNCM I-2294) que comprende 10 copias del módulo de expresión del gen LIP2 integradas en su ADN, así como su utilización para la producción de lipasa con un rendimiento del orden de 0,5 g de lipasa por litro de sobrenadante de cultivo, y una actividad catalítica de 12.000 U/ml, medida usando aceite de oliva como sustrato, correspondiendo una unidad a la cantidad de enzima capaz de catalizar la liberación de 1 pmol de ácido graso por minuto, es decir, 200 veces más que la cepa inicial. No obstante, el procedimiento de producción de lipasa descrito en esta solicitud presenta un inconveniente importante, ya que emplea medios de cultivo que contienen bactopeptona o bactotriptona. Estos productos, que no están caracterizados y que contienen diversos hidrolizados proteicos, se utilizan clásicamente como fuente de nitrógeno y carbono. En consecuencia, el procedimiento descrito en esta solicitud no permite obtener una lipasa directamente utilizable como medicamento.
PIGNEDE et al. (Journal of Bacterioloav. 2000) han caracterizado más particularmente la lipasa extracelular codificada por el gen LIP2 de Yarrowia lipolytica (cepa P01d). En este artículo, se han estudiado así:
la secreción de la lipasa a partir de diferentes cepas silvestres (P01d en la que Yltl está ausente y E150 en la que Yltl está presente) y de diferentes cepas recombinantes como JMY184 (P01d-6- 15) y JMY279 (P01d-6-17), así como
la sobreproducción de lipasa especialmente por el transformante JMY184.
Este artículo de PIGNEDE et al. compara la producción de lipasa por cepas silvestres, cepas mutantes y cepas recombinantes obtenidas según el procedimiento descrito anteriormente (solicitud internacional WO 01/83773). Las cepas silvestres secretan entre 30 y 50 U de lipasa/ml, mientras que las cepas mutantes obtenidas por la acción de la A/-metil-A/'-nitro-A/-nitrosoguanidina (NNNG) producen 25 veces más lipasa, es decir, 1.200 U/ml en condiciones de cultivo optimizadas que hacen intervenir un medio que contiene peptona (medio de precultivo) y un medio que contiene suero lácteo (medio de fermentación) (véase igualmente DESTAIN et al., 1997). Se obtienen las cepas recombinantes con la ayuda de la construcción que comprende el gen LIP2 regulado por el promotor POX2 y mediante integración no homologa, en copias múltiples y de forma dispersada, de este módulo de expresión. PIGNEDE et al. han obtenido transformantes estables (por ejemplo, la cepa JMY184) que producen 2.000 U/ml en condiciones no optimizadas, es decir, en medio YPDH (que comprende 10 g/l de extracto de levadura, 10 g/l de bactopeptona, 10 g/l de glucosa y 10 g/ de aceite de oliva) correspondientes a aproximadamente 0,5 g de lipasa/l de sobrenadante. De la misma manera que anteriormente, las preparaciones de lipasa descritas por PIGNEDE et al. y por DESTAIN et al., son inapropiadas, como tales, para un uso médico y más particularmente para la constitución de lotes clínicos, ya que su producción requiere la utilización de medios de cultivo que contienen peptonas o suero láctico.
Prosiguiendo sus trabajos, el equipo de PIGNEDE (Applied and Environmental Microbioloqy. 2000) ha estudiado cepas de Yarrowia lipolytica transformadas por un vector que comprende un módulo de expresión del gen LIP2. Los autores han determinado que, para 8 de estos transformantes, el número de copias del módulo de expresión del gen LIP2 está comprendido entre 6 y 16 (10 copias de media), lo que se traduce en 2 a 15 eventos de integración de dicho módulo en loci diferentes. La cepa JMY184 comprende así 12 copias del módulo de expresión del gen LIP2, integradas en 4 loci diferentes. Los autores han estudiado por otro lado más precisamente este transformante JMY184. Confirman que la cepa JMY184 produce 0,5 g de lipasa/l de sobrenadante con una actividad de 1.500 U/ml en medio rico YPDH (que contiene bactopeptona) (frente a 50 U/ml para una cepa silvestre P01d), medida utilizando aceite de oliva como sustrato. Estos valores permiten deducir una actividad específica de aproximadamente 3.000 U/mg de lipasa. Los autores anuncian además que la producción optimizada de lipasa en termentador por la cepa JMY184 permite obtener preparaciones que tienen una actividad de hasta 10.000 U/ml. No obstante, las condiciones de cultivo que han permitido este resultado no se han divulgado. En este artículo, los autores han estudiado además la estabilidad en cultivo de estos transformantes, y especialmente del clon JMY184, y han mostrado su estabilidad durante 120 generaciones. PIGNEDE et al. han considerado que, para optimizar la producción... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de producción de lipasa recombinante que comprende:
a) una etapa en el transcurso de la cual se procede a la puesta en cultivo de células de Yarrowia lipolytica transformadas por un vector de expresión que comprende un módulo de expresión de una lipasa acidorresistente de levadura, y
b) una etapa en el transcurso de la cual se recoge, en el sobrenadante de dicho cultivo, la lipasa recombinante producida por dichas células;
estando caracterizado dicho procedimiento porque la etapa a) de puesta en cultivo se pone en práctica en un medio de cultivo desprovisto de productos de origen animal o de mezclas no caracterizadas constituidas por materiales proteicos de origen animal o de sus productos de digestión enzimática,
y porque dicha etapa a) comprende:
a1) el precultivo de las células transformadas de Yarrowia lipolytica en un medio que contiene una fuente de carbono de origen glucídico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas; y
a2) una etapa de fermentación que comprende una fase de crecimiento celular en un medio que contiene como única fuente de carbono una fuente de carbono de origen glucídico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas, y una fase de producción de lipasa en un medio que contiene como única fuente de carbono ácido oleico, nitrógeno mineral y sales minerales, oligoelementos y vitaminas.
2. Procedimiento de producción de lipasa recombinante según la reivindicación 1, caracterizado porque dicha fuente de nitrógeno es sulfato de amonio.
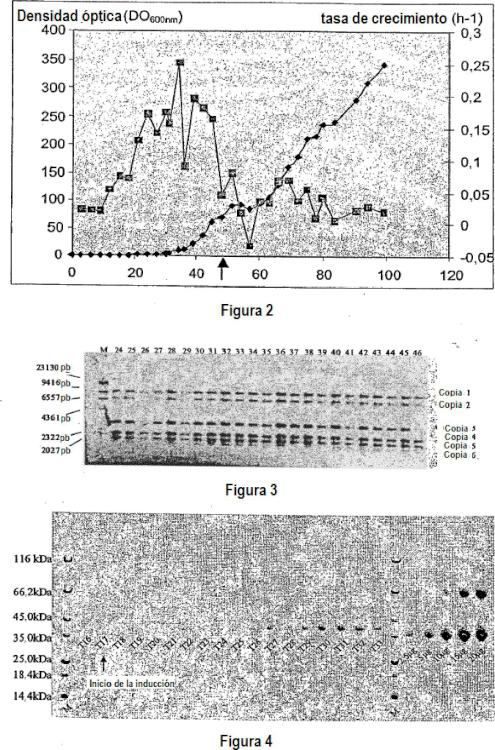
3. Procedimiento de producción según la reivindicación 1 o 2, caracterizado porque la fermentación se pone en práctica ventajosamente con una pC>2 constante comprendida entre 15 y 25 % y un pH preferiblemente inferior a 6,5.
4. Procedimiento de producción según la reivindicación 2 o la reivindicación 3, caracterizado porque la etapa a1) de precultivo se realiza hasta alcanzar un valor de DOsoonm comprendido entre 3 y 10 para 1 mi, y porque en la etapa a2) de fermentación dicha fase de producción de lipasa se inicia cuando la DOeoonm del cultivo alcanza un valor comprendido entre 60 y 80 para 1 mi.
5. Procedimiento de producción según una cualquiera de las reivindicaciones 1 a 4, caracterizado porque la etapa b) en el transcurso de la cual se recoge la lipasa se realiza cuando la DOeoonm alcanza un valor comprendido entre 300 y 350 para 1 mi.
6. Procedimiento de producción según una cualquiera de las reivindicaciones 1 a 5, caracterizado porque la etapa b) comprende:
b1) la separación de la lipasa de dicho sobrenadante de cultivo, y
b2) la purificación de la lipasa obtenida en b1).
7. Procedimiento de producción según la reivindicación 6, caracterizado porque dicha separación se efectúa mediante una técnica elegida entre filtración tangencial en fibra hueca, filtración frontal y centrifugación continua o discontinua, y dicha purificación se efectúa mediante una técnica elegida entre filtración, precipitación fraccionada, cromatografía de intercambio iónico, cromatografía de interacción hidrófoba y cromatografía por filtración en gel.
8. Procedimiento de producción según una cualquiera de las reivindicaciones 1 a 7, caracterizado porque la etapa a) consiste en la puesta en cultivo del clon denominado YL-LIP2-6C, depositado en la Collection Nationale de Cultures de Microorganismes (C.N.C.M.), 28 rué du Docteur Roux, 75724 París Cedex 15, con el número I-3542, el 15 de diciembre de 2005.
9. Preparación de la lipasa recombinante acidorresistente de levadura codificada por el gen Lip2 o LIP2, caracterizada porque es susceptible de obtenerse mediante un procedimiento según la reivindicación 8, porque tiene una actividad catalítica a pH 6 de al menos 15.000 unidades por mi de sobrenadante de cultivo, preferiblemente superior a 20.000 unidades por mi de sobrenadante de cultivo, correspondiendo una unidad a la cantidad de enzima capaz de catalizar la liberación de 1 pmol de ácido graso por minuto cuando el sustrato utilizado es trioctanoína, y porque la concentración de dicha lipasa en dicha preparación es superior a 1 g de lipasa por litro.
10. Utilización de una preparación de lipasa según la reivindicación 9 para la obtención de un medicamento destinado al tratamiento de un síndrome de malabsorción de grasas, ligado a una insuficiencia pancreática.
11. Preparación de lipasa según la reivindicación 9 para utilización como medicamento.
12. Célula de Yarrowia lipolytica transformada por un vector que comprende un módulo de expresión de una lipasa extracelular acidorreslstente de levadura, caracterizada porque se trata del clon denominado YL-LIP2-6C, depositado en la Collectlon Natlonale de Cultures de Microorganlsmes (C.N.C.M.) con el número I-3542, el 15 de diciembre de 2005.
5 13. Utilización de la célula según la reivindicación 12 para la producción de la lipasa acidorreslstente de
levadura codificada por el gen Llp2 o LIP2.
Patentes similares o relacionadas:
NANOPARTÍCULAS MULTIFUNCIONALES PARA TERAGNOSIS, del 30 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Nanopartículas multifuncionales para teragnosis. La presente invención se refiere al campo de la medicina, en particular a nanopartículas (NP) […]
Formulaciones estables que contienen anticuerpos anti-PCSK9, del 15 de Julio de 2020, de AMGEN INC.: Una formulación estable que comprende un anticuerpo monoclonal que se une específicamente a PCSK9, en donde PCSK9 comprende los aminoácidos de la SEQ ID NO: […]
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]
Modificación de FVIII dirigida al sitio, del 15 de Julio de 2020, de BAYER HEALTHCARE LLC: Un conjugado que tiene actividad procoagulante del factor VIII que comprende un factor VIII polipeptídico funcional con el dominio B eliminado que está mutado […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Composición a base de hidroxiapatita en polvo para el tratamiento del linfoma B o T, del 1 de Julio de 2020, de URODELIA: Composición para uso como autovacuna antitumoral para el tratamiento de linfomas B o T en un sujeto, que comprende un polvo de hidroxiapatita y/o de […]
Tratamiento de disfunción eréctil y otras indicaciones, del 1 de Julio de 2020, de STRATEGIC SCIENCE & TECHNOLOGIES, LLC: Una composición para su uso en un método de tratamiento de la disfunción sexual en un sujeto, preferiblemente un sujeto humano, comprendiendo la composición: […]
Macrociclos peptídicos frente a Acinetobacter baumannii, del 17 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto de fórmula (I) **(Ver fórmula)** en la que: X1 es C-L1-R11 o N, X2 es C-L2-R12 o N, X3 es C-L3-R13 o N, X4 es C-L4-R14 o N, con […]