LIGANDOS DE TLR7 PARA EL TRATAMIENTO DE LA HEPATITIS C.
El uso de un ligando de TLR7 para la fabricación de un medicamento para el tratamiento de una infección por el virus de la hepatitis C en un paciente,
en el que el ligando de TLR7 se selecciona entre
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/028236.
Solicitante: ANADYS PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 5871 OBERLIN DRIVE SUITE 200,SAN DIEGO, CALIFORNIA 92121.
Inventor/es: AVERETT,DEVRON,R.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/4745 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61K31/513 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. citosina.
- A61K31/522 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. hipoxantina, guanina, aciclovir.
- A61K31/7076 A61K 31/00 […] › conteniendo purinas, p. ej. adenosina, ácido adenílico.
- A61K31/708 A61K 31/00 […] › teniendo grupos oxo unidos directamente al sistema cíclico de la purina, p. ej. guanosina, ácido guanílico.
Clasificación PCT:
- A61K31/708 A61K 31/00 […] › teniendo grupos oxo unidos directamente al sistema cíclico de la purina, p. ej. guanosina, ácido guanílico.
- A61P31/14 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para virus ARN.
Clasificación antigua:
- A61K31/708 A61K 31/00 […] › teniendo grupos oxo unidos directamente al sistema cíclico de la purina, p. ej. guanosina, ácido guanílico.
- A61P31/14 A61P 31/00 […] › para virus ARN.
Fragmento de la descripción:
Ligandos de TLR7 para el tratamiento de la hepatitis C.
1. Campo de la invención
La presente invención se refiere al uso de un ligando de TLR7 para la fabricación de un medicamento para tratar o prevenir infecciones por el virus de la hepatitis C en mamíferos. Más particularmente, la presente invención se refiere al uso de un ligando de TLR7 para la fabricación de un medicamento para administrar por vía oral una cantidad terapéuticamente eficaz del mismo para el tratamiento o prevención de la infección por el virus de la hepatitis C. La administración oral de estos ligandos inmunomoduladores de TLR7 y profármacos de los mismos a un mamífero proporciona cantidades terapéuticamente eficaces y efectos secundarios indeseables reducidos.
2. Antecedentes de la invención
Puede conseguirse inmunomodulación por moléculas pequeñas por medio de la identificación de compuestos que se unen a y activan Receptores Tipo Toll (TLR). Los TLR desempeñan un papel importante en respuestas inmunes innatas en mamíferos y con frecuencia son la primera línea de defensa contra patógenos tales como bacterias y virus. Los diversos TLR varían en su abundancia en diferentes tipos celulares de mamífero y también varían con respecto a las estructuras moleculares que se unen al TLR y activan rutas de señalización. Estas rutas de señalización conducen a la serie de respuestas asociadas con la inmunidad innata.
Los TLR detectan PAMP (patrones moleculares asociados a patógenos) y estimulan a las células inmunes a través de la ruta de señalización de receptor de interleucina 1 (IL-1R)-TLR dependiente de MyD88, lo cual conduce a la activación del factor de transcripción NF-?B2. En seres humanos se han identificado diez miembros de la familia funcional de TLR (TLR1 a TLR10). Akira S. y col., Nature Immunol., 2, 675-680 (2001). Los TLR2, TLR4 y TLR5 son cruciales para el reconocimiento de peptidoglicano, lipopolisacárido y flagelina. Hayashi, F. y col., Nature, 410, 1099-1103 (2001). El TLR6 se asocia con TLR2 y reconoce lipoproteínas de micoplasma. Ozinsky, A., y col., Proc. Natl. Acad. Sci USA., 97, 13766-13771 (2000). El TLR9 detecta ADN bacteriano que contiene motivos CpG no metilados y el TLR3 activa a las células inmunes en respuesta al ARN bicatenario. Hemmi, H. y col., Nature, 408, 740-745 (2000).
Se han presentado varios compuestos, incluyendo análogos de guanosina, pirimidinas sustituidas e imidazoquinolinas como ligandos para TLR7. Véase, por ejemplo, Hemmi y col., Nature Immunol., 3, 196-200 (2002) (imiquimod y R-848 (resiquimod)); Jurk y col., Nat. Immunol., 3, 499 (2002) (R-848); y Lee y col., Proc. Natl. Acad. Sci USA, 100, 6646-6651 (2003) (en el que los análogos de guanosina loxoribina, 7-tia-8-oxoguanosina (isatoribina) y 7-deazaguanosina, y las imidazoquinolinas imiquimod y R-848 (resiquimod) activan selectivamente TLR7).
Antes de asociarse como posibles ligandos de TLR7, los análogos de guanosina y otros nucleósidos de D y L purina han sido el objeto de una investigación considerable durante las dos últimas décadas. Véase, por ejemplo, Reitz y col., J. Med. Chem., 37, 3561-78 (1994); Michael y col., J. Med. Chem., 36, 3431-36 (1993) (análogos de guanosina inmunomoduladores que tienen sustituyentes en las posiciones 7 y/u 8); Patente Nº 5.821.236 de Krenitsky y col. (que describe 6-alcoxi derivados de derivados de arabinofuranosil purina que son útiles para terapia de tumores); Patente de Estados Unidos Nº 5.041.426 de Robins y col. (se describen ciertos nucleósidos de pirimido[4,5-d]pirimidina como agentes eficaces en el tratamiento contra L1210 en ratones BDF1); Revankar y col., J. Med. Chem., 27, 1489-96 (1984) (nucleósidos y nucleótidos de 3-deazaguanina que demuestran una actividad antiviral de amplio espectro significativa contra ciertos virus de ADN y ARN);
Recientemente, en la bibliografía se han identificado varios compuestos que se sabe que son inmunoestimuladores como ligandos de TLR7, véase, por ejemplo, Heil y col., Eur. J. Immunol., 33(11), 2987-97 (2003), Lore y col., J. Immunol., 171(8), 4320-8 (2003), Nagase y col., J. Immunol., 171(8), 3977-82 (2003), Mohty y col., J. Immunol., 171(7), 3385-93 (2003), Pinhal-Enfield, y col., Am. J. Pathol., 163(2), 711-21 (2003), Doxsee y col, J. Immunol., 171(3), 1156-63 (2003), Bottcher y col., Neurosci. Lett., 344(1), 17-20 (2003), Kaisho y col., Curr. Mol. Med., 3(4), 373-85 (2003), Okada y col., Eur. J. Immunol., 33(4), 1012-9 (2003), Edwards y col., Eur. J. Immunol., 33(4), 827-33 (2003), Akira y col., Immunol. Lett., 85(2), 85-95 (2003), Ito y col., Hum. Immunol., 63(12), 1120-5 (2002), Rothenfusser y col., Hum. Immunol., 63(12), 1111-9 (2002), Yamamoto y col., J. Immunol., 169(12), 6668-72 (2002), Gibson y col., Cell Immunol., 218(1-2), 74-86 (2002), Horng y col., Nature, 420 (6913), 329-33 (2002), Yamamoto y col., Nature, 420(6913), 324-9 (2002), Applequist y col., Int. Immunol., 14(9), 1065-74 (2002), Sato y col., Int. Immunol., 14(7), 783-91 (2002); Jurk y col., Nat. Immunol., 3(6), 499 (2002); Hornung y col., J. Immunol., 168(9), 4531-7 (2002), Hemmi y col., Nat. Immunot., 3(2), 196-200 (2002); Bruno y col., Eur. J. Immunol., 31(11), 3403-12 (2001); Jarrossay y col., Eur. J. Immunol., 31(11), 3388-93 (2001); Miettinen y col., Genes Immun., 2(6), 349-55 (2001), Chuang y col., Eur. Cytokine Netw., 11(3), 372-8 (2000) y Du y col., Eur. Cytokine Netw., 11(3), 362-71 (2000).
Se sabe que estos ligandos de TLR7 estimulan respuestas inmunes in vitro y en especies animales, y esto ha conducido al ensayo de los usos de estos compuestos para varios usos terapéuticos, incluyendo terapias antivirales y para cáncer. Estos compuestos se han caracterizado como análogos o derivados de a) guanosina, b) imidazoquinolina y c) pirimidina. Véase Akira, Current Opinion, 15, 5-11 (2003). Un miembro (imiquimod) de la clase química de la imidazoquinolina se ha considerado eficaz para tratar infecciones genitales tópicas por el virus del papiloma. Un segundo miembro de la clase de imidazoquinolina, resiquimod, se ha ensayado para el tratamiento del VHC, pero este compuesto no mostró efecto anti-VHC a dosis orales toleradas. Pockros y col., Gastroenterology, 124 (Suppl 1), A-766 (2003).
De esta manera, aunque ha habido algún uso limitado de ligandos de TLR7 para el tratamiento de enfermedades inmunológicas e infecciones virales; véanse, por ejemplo, las Patentes de Estados Unidos Nº 5.041.426 y 4.880.784 de Robins y col. (3-ß-D-ribofuranosiltiazolo[4,5-d]piridiminas que demuestran inmunoactividad significativa, incluyendo proliferación de células de bazo murinas y actividad in vivo contra el virus Semliki Forest); Publicación de Solicitud de Patente de Estados Unidos Nº US 2003/0199461 y documento WO 03/045968 de Averett y col. (nucleósidos de (3-ß-D-ribofuranosiltiazolo[4,5-d]pirimidina que demuestran actividad contra infecciones agudas y crónicas de virus de ARN y ADN); hasta la fecha, los ligandos han resultado ineficaces para el tratamiento prevención del virus de la hepatitis C.
También se sabe que la administración oral de muchos análogos de nucleósidos de purina es el objeto de dificultades debidas a una mala absorción, baja solubilidad o degradación en el tracto digestivo como resultado de las condiciones ácidas o alcalinas o de la acción de enzimas, y/o combinaciones de estos fenómenos. De esta manera, sigue existiendo la necesidad de análogos de nucleósidos de purina con mejores disponibilidad y administración oral que se usen para modular aspectos del sistema inmune.
Además, los nucleósidos inmunomoduladores tienen una tolerabilidad oral relativamente mala en comparación con la de la vía intravenosa. Además, el tracto gastrointestinal presenta una barrera de tolerancia particular a agentes inmunológicos gracias a la gran cantidad de tejido inmune asociado con la pared intestinal (es decir, el intestino). Aunque éste es un mecanismo biológico importante para prevenir la invasión del cuerpo por la flora intestinal, el tejido inmune también puede verse afectado preferentemente después de la administración oral de compuestos inmunomoduladores debido a las altas concentraciones locales del compuesto administrado en el intestino. Esto conduce a efectos secundarios indeseables, por ejemplo en el caso de agentes activadores inmunes se observa gastroenteritis y efectos hemorrágicos localizados.
En la bibliografía no es evidente una solución al problema de la administración oral eficaz de agentes inmunomoduladores. Las pruebas disponibles indican que los niveles sistémicos de fármacos administrados en esta clase se han limitado por toxicidades gastrointestinales que...
Reivindicaciones:
1. El uso de un ligando de TLR7 para la fabricación de un medicamento para el tratamiento de una infección por el virus de la hepatitis C en un paciente, en el que el ligando de TLR7 se selecciona entre
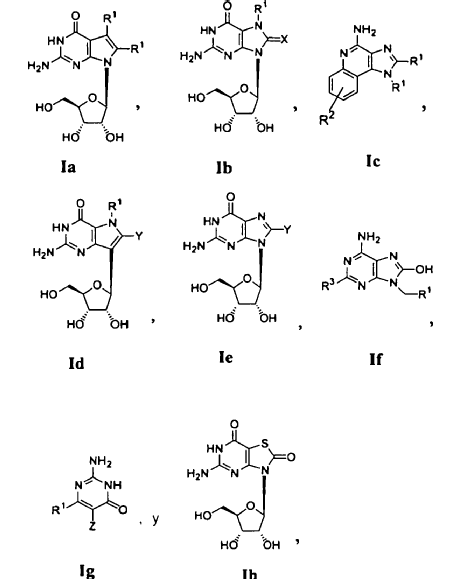
en los que:
o una sal, hidrato o estereoisómero farmacéuticamente aceptable del mismo o una sal o hidrato farmacéuticamente aceptable de dicho estereoisómero.
2. El uso de la reivindicación 1 en el que el ligando de TLR7 se selecciona entre la Fórmula Ia, Ib, Ic, Id, Ie, If, Ig e Ih, en las que R1 es H o un alquilo, alquenilo o alquinilo sustituido o sin sustituir; R2 es H, OH, halo o un alquilo, alquenilo o alquinilo sustituido o sin sustituir o -CH2-O-(alquilo); R3 es H, OH o SH, o un -O-(alquilo), -S-(alquilo), o -NH(alquilo) sustituido o sin sustituir; X es O o S; Y es H, halo, OH, OR4, SH o SR4; y Z es H, halo, OH, OR4, SH o SR4.
3. El uso de la reivindicación 1 en el que el ligando de TLR7 se selecciona entre la Fórmula Ic y If.
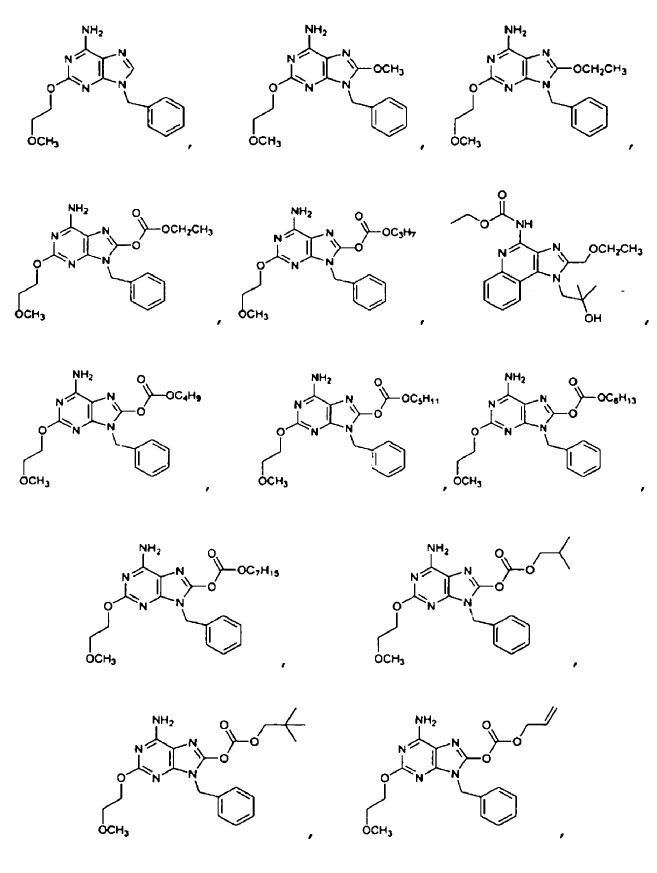
4. El uso de la reivindicación 1 en el que el ligando de TLR7 se selecciona entre
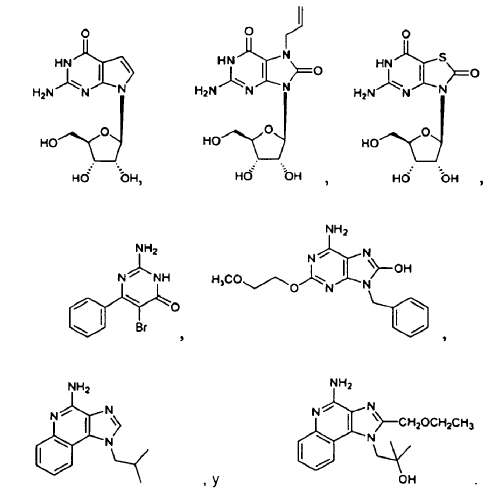
5. El uso de la reivindicación 1 en el que el ligando de TLR7 se administra por vía parenteral, en el que el ligando de TLR7 se administra por vía intravenosa, en el que el ligando de TLR7 se administra por vía oral o en el que el ligando de TLR7 se administra por vía mucosa.
6. Uso de un profármaco de un ligando de TLR7 enmascarado para la fabricación de un medicamento para la administración oral en el tratamiento de una infección por el virus de la hepatitis C en un paciente, en el que la administración oral del profármaco de un ligando de TLR7 enmascarado alcanza una concentración plasmática terapéuticamente eficaz del ligando de TLR7 reduciendo al mismo tiempo los efectos secundarios indeseables asociados con la administración oral de ligandos de TLR7, en el que el profármaco es (a) un resto de amida, carbamato o amidina después de la conversión de un sustituyente amina del ligando de TLR7, (b) un resto éster, carbonato, carbamato, éter, imidato, acetal, aminal o cetal después de la conversión de un sustituyente alcohol del ligando de TLR7, (c) un resto acetal o cetal después de la conversión de un sustituyente ceto del ligando de TLR7, (d) un resto imidato después de la conversión de un carbonilo de un sustituyente amido de TLR7, (e) un resto desoxigenado después de la conversión de un sustituyente oxo de pirimidina o guanosina del ligando de TLR7, o (f) una amina y en el que el profármaco del ligando de TLR7 enmascarado se selecciona entre
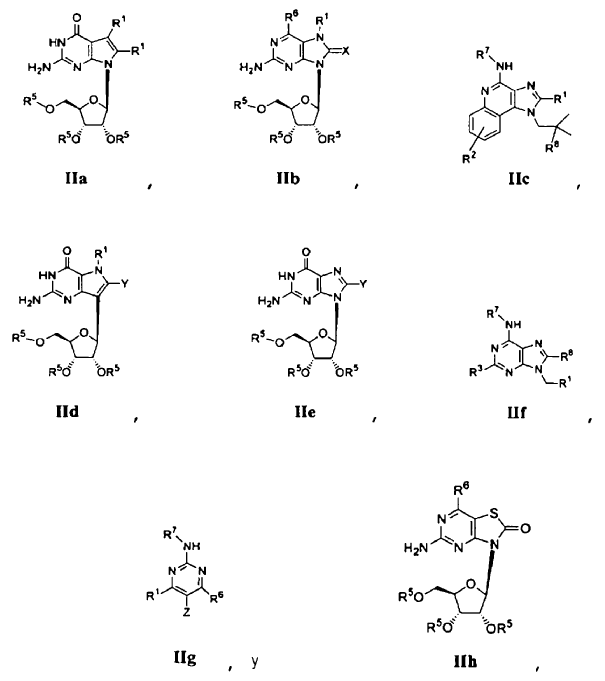
en los que:
o una sal, hidrato o estereoisómero farmacéuticamente aceptable del mismo o una sal o hidrato farmacéuticamente aceptable de dicho estereoisómero.
7. El uso de la reivindicación 6 en el que R1 es H o un alquilo, alquenilo o alquinilo sustituido o sin sustituir; R2 es H, OH, halo o un alquilo, alquenilo o alquinilo sustituido o sin sustituir o -CH2-O-(alquilo); R3 es H, OH o SH, o un -O-(alquilo), -S-(alquilo) o -NH(alquilo) sustituido o sin sustituir; R5 es independientemente H, -C(O)-(alquilo C1-18) o un grupo aminoácido L, D o racémico -C(O)CHNH2R9, en el que R9 es un alquilo sin sustituir; R6 es H o OR10, en el que R10 es independientemente alquilo C1-6, alquenilo C3-7, alquinilo C3-7, -(CR12R13)t(arilo C6-C10), -(CR12R13)t(heterocíclico C4-C10) y -(CR12R13)t>0N (R14)CO2alquilo C1-18, en los que t es un número entero de 0 a 4 a menos que se indique otra cosa, y en los que los restos alquilo, alquenilo, arilo y heterocíclico de los grupos anteriores están opcionalmente sustituidos con 1 a 3 sustituyentes seleccionados independientemente entre halo, ciano, nitro, trifluorometilo, trifluorometoxi, alquilo C1-C6, alquenilo C2-C6, alquinilo C2-C6, hidroxi, alcoxi C1-C6, -CO2-alquilo, -CO2-arilo, -OC(O)alquilo y -OC(O)arilo, y en los que R12 y R13 son independientemente H, alquilo C1-6 o alquenilo C2-6; y R14 es H, -CH3 o -CH2CH3; R7 es independientemente H o un -C(O)(alquilo C1-18) o -C(O)2(alquilo C1-18) sustituido o sin sustituir; R8 es H, -OH, -O-(alquilo), -OCO2(alquilo C1-18) o un grupo aminoácido L, D o racémico -OC(O)CHNH2R1; X es O o S; Y es H, halo, OH, OR4, SH o SR4; y Z es H, halo, OH, OR4, SH o SR4.
8. El uso de la reivindicación 6 en el que el profármaco del ligando de TLR7 enmascarado se selecciona entre IIc y IIf.
9. El uso de la reivindicación 6 en el que el profármaco del ligando de TLR7 enmascarado se selecciona entre
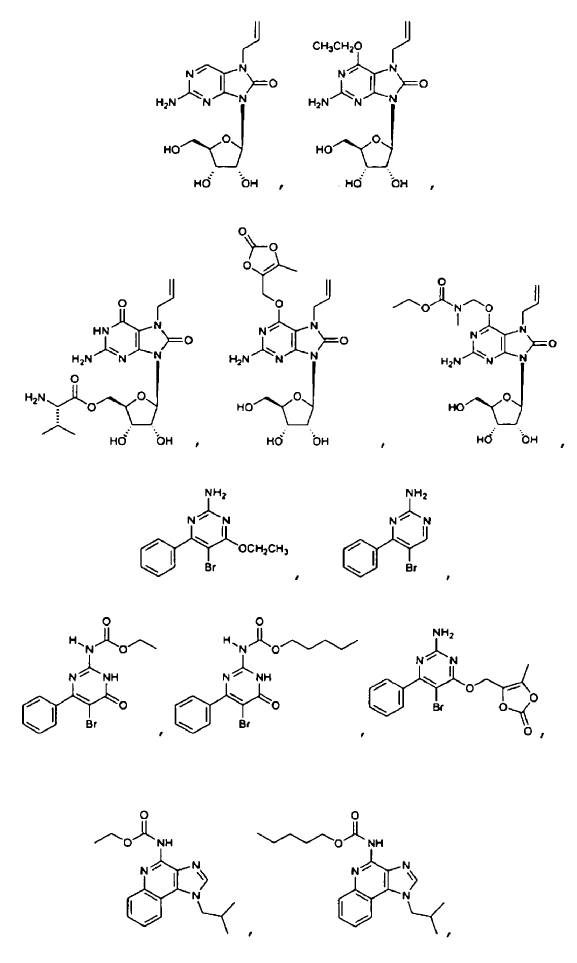
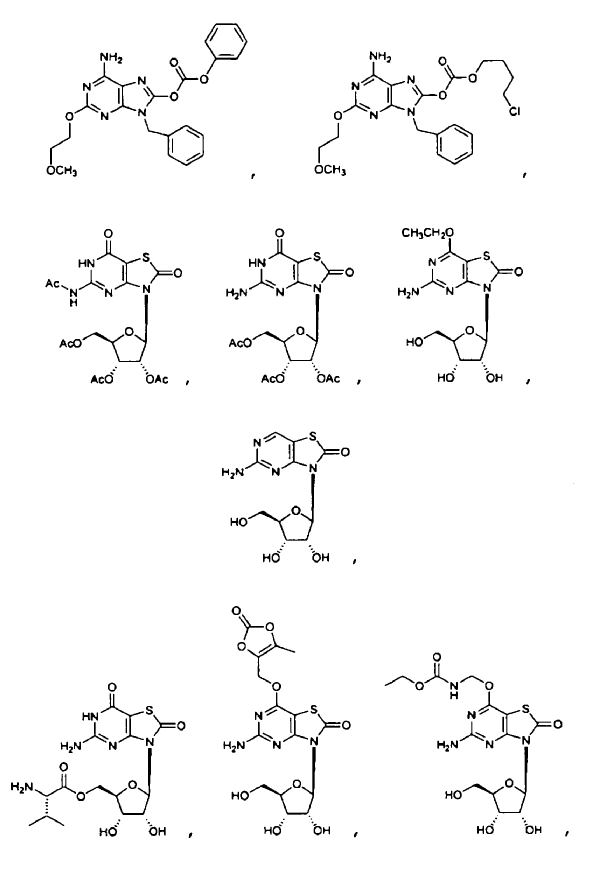
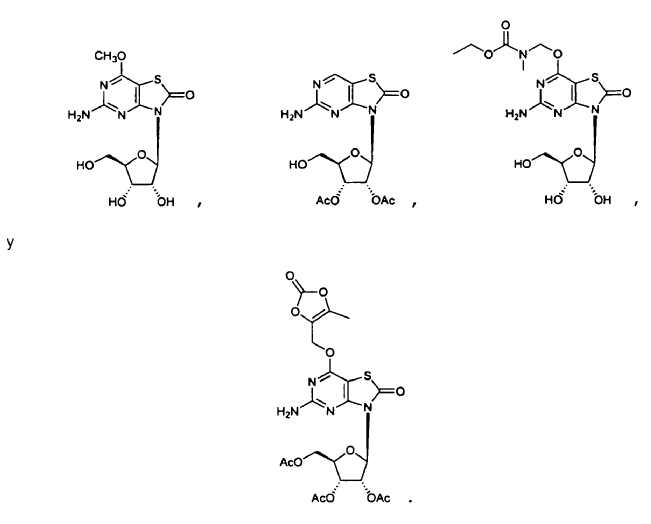
10. El uso de la reivindicación 6, en el que la administración oral del profármaco de ligando de TLR7 enmascarado consigue una concentración en plasma eficaz in vivo del ligando de TLR7 que es del 10% al 500% de la exposición eficaz in vivo obtenida después de la administración oral del ligando de TLR7 solo, o en el que la administración oral del profármaco de ligando de TRL7 enmascarado consigue una concentración en plasma eficaz in vivo del ligando de TRL7 que es del 50% al 200% de la exposición eficaz in vivo obtenida después de la administración oral del ligando de TRL7 solo.
11. El uso de la reivindicación 10, en el que la administración oral del profármaco de ligando de TLR7 enmascarado consigue una concentración en plasma terapéuticamente eficaz del ligando de TRL7 correspondiente sin producir irritación gastrointestinal.
12. El uso de la reivindicación 6, en el que la administración oral del profármaco de ligando de TLR7 enmascarado reduce los efectos secundarios indeseables en un paciente con respecto a los efectos secundarios después de la administración oral del ligando de TRL7 solo, o en el que la administración oral del profármaco de ligando de TLR7 enmascarado reduce los efectos secundarios indeseables en un 50% en un paciente con respecto a los efectos secundarios después de la administración oral del ligando de TRL7 solo.
13. El uso de la reivindicación 6, en el que el efecto secundario es irritación gastrointestinal.
14. El uso de la reivindicación 13, en el que la irritación es hemorragia, en el que la irritación es lesiones o en el que la irritación es emesis.
15. El uso de la reivindicación 1 o la reivindicación 6, en el que el paciente es un ser humano.
16. El uso de la reivindicación 1 o la reivindicación 6 que comprende además administrar un excipiente, soporte o vehículo farmacéuticamente aceptable.
17. El uso de la reivindicación 10, que comprende además administrar un agente terapéutico adicional.
18. El uso de la reivindicación 17, en el que el agente terapéutico adicional es un agente antiviral.
19. El uso de la reivindicación 1 o la reivindicación 6, en el que la dosis terapéutica o profilácticamente eficaz es de 0,001 a 100 mg/kg al día, en el que la dosis terapéutica o profilácticamente eficaz es de aproximadamente 0,1 a 25 mg/kg al día o en el que la dosis terapéutica o profilácticamente eficaz es de aproximadamente 1 a 20 mg/kg al día.
20. El uso de la reivindicación 6, en el que el profármaco de ligando de TRL7 enmascarado se administra por vía parenteral, oral o mucosa.
21. El uso de la reivindicación 20, en el que, en caso de administración parenteral, el profármaco de ligando de TLR7 enmascarado se administra por vía intravenosa.
Patentes similares o relacionadas:
Derivados fosforamidato de nucleósidos como agentes anticancerígenos, del 10 de Junio de 2020, de NuCana plc: Un compuesto de la fórmula (I), o una sal aceptable farmacéuticamente del mismo: **(Ver fórmula)** R1 es arilo; R2 se selecciona […]
 Terapia de desoxinucleósidos para enfermedades causadas por grupos de nucleótidos desequilibrados incluyendo síndromes de agotamiento de ADN mitocondrial, del 29 de Abril de 2020, de THE TRUSTEES OF COLUMBIA UNIVERSITY IN THE CITY OF NEW YORK: La desoxicitidina (dC) para su uso en un metodo de tratamiento de la deficiencia de timidina quinasa 2 (TK2) en un sujeto humano que lo necesita, dicho […]
Terapia de desoxinucleósidos para enfermedades causadas por grupos de nucleótidos desequilibrados incluyendo síndromes de agotamiento de ADN mitocondrial, del 29 de Abril de 2020, de THE TRUSTEES OF COLUMBIA UNIVERSITY IN THE CITY OF NEW YORK: La desoxicitidina (dC) para su uso en un metodo de tratamiento de la deficiencia de timidina quinasa 2 (TK2) en un sujeto humano que lo necesita, dicho […]
Nucleósidos sustituidos en 2',4' como agentes antivirales, del 25 de Marzo de 2020, de Gilead Pharmasset LLC: Un compuesto de la siguiente fórmula: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: (a) R2 es F; (b) R es H, […]
Agentes y métodos para el tratamiento y prevención de queratosis seborreica, del 18 de Marzo de 2020, de THE GENERAL HOSPITAL CORPORATION: Una composición que comprende un inhibidor competitivo del ATP de Akt para su uso en el tratamiento de la queratosis seborreica, en la que el inhibidor competitivo […]
Métodos de tratamiento o prevención de trombosis de stent, del 22 de Enero de 2020, de CHIESI FARMACEUTICI S.P.A.: Un producto de combinación que comprende una composición farmacéutica que comprende cangrelor y una composición farmacéutica que comprende bivalirudina […]
Composiciones que comprenden magnolia, felodendron, teanina y/o proteína de suero, del 25 de Diciembre de 2019, de NUTRAMAX LABORATORIES, INC.: Una composición ansiolítica, que comprende una combinación sinérgica de L-teanina, una proteína de suero, un extracto de magnolia y un extracto […]
Análogos de S-adenosil-L-cisteína como cofactores para metiltransferasas, del 11 de Diciembre de 2019, de KATHOLIEKE UNIVERSITEIT LEUVEN: Un compuesto representado por la fórmula (I) **(Ver fórmula)** en donde R1 es COOH o COO-; X es un anión orgánico o inorgánico que lleva una o más […]
Composiciones orales sólidas a base de sal de S-adenosil metionina y procedimiento para la obtención de las mismas, del 4 de Diciembre de 2019, de GNOSIS S.P.A.: Composición que comprende S-adenosil metionina sulfato paratoluenosulfonato o S-adenosil metionina-1,4- butano disulfonato en asociación con óxido de calcio y opcionalmente […]