Dispositivos, métodos y kits de inmunocromatografía.
Dispositivo para inmunoensayo que comprende:
- una membrana que tiene una zona de captura de proteína Z-AAT definida por un anticuerpo 5 de captura inmovilizado en la misma;
- una zona de aplicación de muestra y una trayectoria de flujo desde la zona de aplicación de muestra a la zona de captura de proteína Z-AAT;
y
- una estructura conjugada situada en la trayectoria de flujo, cuya estructura conjugada comprende un reactivo de detección específico para la proteína Z-AAT, siendo el reactivo de detección móvil o movilizable,
en el que el anticuerpo de captura es:
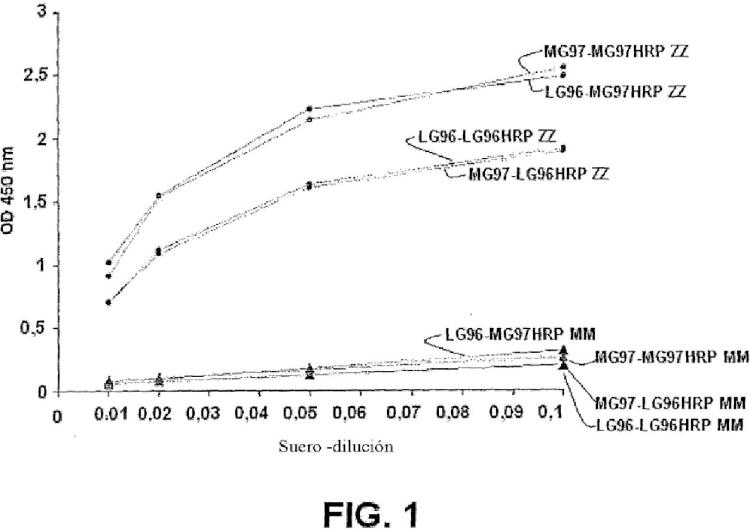
el anticuerpo monoclonal LG96 producido por células de hibridoma depositadas con nº de Acceso DSM ACC3092; o
el anticuerpo monoclonal MG97 producido por células de hibridoma depositadas con nº de Acceso DSM ACC3093; y
en el que el reactivo de detección es un anticuerpo detector seleccionado entre:
anticuerpo monoclonal LG96 producido por células de hibridoma depositadas con nº de Acceso DSM ACC3092; o
bien anticuerpo monoclonal MG97 producido por células de hibridoma depositadas con nº de Acceso DSM ACC3093.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2011/002232.
Solicitante: Grifols Therapeutics Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4101 Research Commons 79 T.W. Alexander Drive Research Triangle Park, NC 27709 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GREBE,MARCO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/38 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra inhibidores de proteasa de estructura peptídica.
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/558 G01N 33/00 […] › utilizando la difusión o la migración del anticuerpo o del antígeno.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2552649_T3.pdf


Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]