INTERMEDIO Y PROCEDIMIENTO PARA PREPARAR 2(SUPERINDICE 1)-DESOXI-2(SUPERINDICE 1),2(SUPERINDICE 1)-DIFLUORO-D-RIBOFURANOSIL NUCLEOSIDOS ENRIQUECIDOS EN EL ANOMERO BETA.
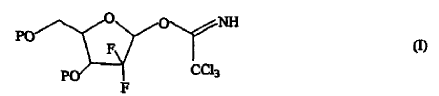
Un compuesto de fórmula (I),
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2005/000322.
Solicitante: FRESENIUS KABI ONCOLOGY LIMITED.
Nacionalidad solicitante: India.
Dirección: B- 310, SOM DATT CHAMBERS - I BHIKAJI CAMA PLACE,NEW DEHLI 110 066.
Inventor/es: MAIKAP,GOLAK CHANDRA, BHATT,DEEPENDRA, PANDA,BIJAN KUMAR.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07H13/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 13/00 Compuestos que contienen radicales sacárido esterificados por ácido carbónico o sus derivados, o por ácidos orgánicos, p. ej. ácidos fosfónicos. › que tienen los radicales carboxilo esterificantes unidos directamente a ciclos carbocíclicos.
- C07H19/073 C07H […] › C07H 19/00 Compuestos que contienen un heterociclo que comparten un heteroátomo del ciclo con un radical sacárido; Nucleósidos; Mononucleótidos; Sus anhidro-derivados. › con un desoxi-2-ribosilo como radical sacárido.
Clasificación PCT:
- C07H13/08 C07H 13/00 […] › que tienen los radicales carboxilo esterificantes unidos directamente a ciclos carbocíclicos.
- C07H19/073 C07H 19/00 […] › con un desoxi-2-ribosilo como radical sacárido.
Fragmento de la descripción:
Intermedio y procedimiento para preparar 21-desoxi-21,21-difluoro-D-ribofuranosil nucleósidos enriquecidos en el anómero ß.
Campo de la invención
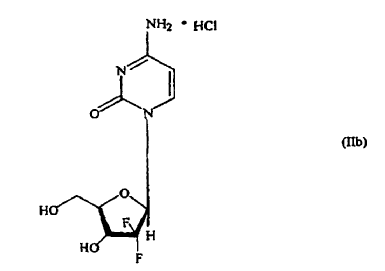
La presente invención se refiere a un nuevo producto intermedio de fórmula (I), a un procedimiento para su preparación y a su uso en la preparación de 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II) enriquecidos en el anómero ß y sus sales fisiológicamente aceptables, de valor terapéutico y comercial. En particular, la presente invención se refiere a un procedimiento selectivo para la fabricación del hidrocloruro de gemcitabina fórmula (IIb) enriquecido en el anómero ß de con una alta pureza.
Antecedentes de la invención
Los 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II),
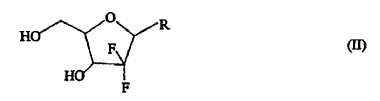
en la que R representa una base seleccionada de un derivado de pirimidina o purina y P representa hidrógeno o un grupo protector de hidroxi, tienen propiedades terapéuticas útiles, y uno de dichos 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de importancia terapéutica y comercial es el hidrocloruro de gemcitabina de fórmula (IIb),
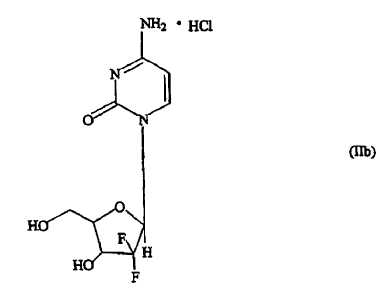
descrito por primera vez por Hertel et al. en la patente de EE.UU. nº 4.526.988; su continuación en parte, patente de EE.UU. nº 4.692.434 y divisional, patente de EE.UU. nº 4.808.614 como un antivírico útil, y más tarde por Grindey et al. en la patente de EE.UU. nº 5.464.826 como un agente antitumoral útil para el tratamiento de neoplasmas susceptibles en mamíferos.
Las patentes de EE.UU. nº 4.526.988, 4.692.434 y 4.808.614 describen un procedimiento para la síntesis de los 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II) incluyendo el hidrocloruro de gemcitabina de fórmula (IIb) que comprende la hidrólisis de un 3-dioxolanil-2,2-difluoro-3-hidroxipropionato de alquilo (1) para dar una lactona (III) que después de protección adecuada de los grupos hidroxilo se reduce para dar la 21-desoxi-21,21-difluororribosa de fórmula (IV). El grupo hidroxi libre del compuesto (IV) así obtenido se convierte en un derivado (2) adecuado, en el que el grupo L actúa como un grupo lábil mejor para la reacción de acoplamiento con la base adecuada para dar, después de eliminar los grupos protectores de hidroxi, los 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II). La química se resume en lo sucesivo:
Incluso aunque las patentes de EE.UU. nº 4.526.988, 4.692.434 y 4.808.614 mencionan que se puede usar cualquier grupo protector a los que están habituados los químicos, sin embargo, se prefiere el uso de grupos protectores de hidroxi de tipo sililo, en especial el grupo terc-butildimetilsililo, puesto que estos son difíciles de escindir en condiciones normales y se pueden eliminar solo por contacto con un ácido hidrohálico. La reducción de la función ceto de la lactona (III) al compuesto hidroxi (IV) se logra usando agentes reductores tales como hidruro de diisobutilaluminio, hidruro de litio y aluminio, etc.
Los grupos lábiles adecuados del compuesto (IV) para reaccionar con la base, son los usados habitualmente en síntesis orgánica, tales como metanosulfonilo, acetato, halógeno, etc.
Sin embargo, el método descrito en las patentes de EE.UU. nº 4.526.988, 4.692.434 y 4.808.614 usa un grupo protector de hidroxi caro como el grupo terc-burildimetilsililo y agentes de reducción tales como hidruro de diisobutilaluminio, hidruro de litio y aluminio, que, además, son peligrosos, requieren un cuidado especial en el manejo, aumentando así el coste y riesgo de fabricación.
Además, la lactona de fórmula (III), por tener un centro quiral se obtiene como una mezcla de enantiómero eritro y treo, de los cuales se prefiere el primero puesto que es el biológicamente más activo y proporciona un hidrato de carbono que tiene la estereoquímica de la ribosa natural. Con mucha frecuencia se necesitan procedimientos cromatográficos tediosos y caros para separar dichos enantiómeros.
Además, se genera un segundo centro quiral cuando se reduce la lactona (III) al compuesto hidroxi (IV), dando una mezcla de anómeros a y ß, de los cuales se prefiere el último, es decir el anómero ß, que es el biológicamente más activo. El método descrito en las patentes de EE.UU. nº 4.526.988, 4.692.434 y 4.808.614 produce 21-desoxi-21,21-difluororibosa de fórmula (IV) como una mezcla de anómeros a y ß en una relación 4:1, y otra vez con mucha frecuencia que requieren técnicas de purificación elaboradas para separar el anómero a no deseado, aumentando más el coste de fabricación de los anómeros ß deseados de los 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II).
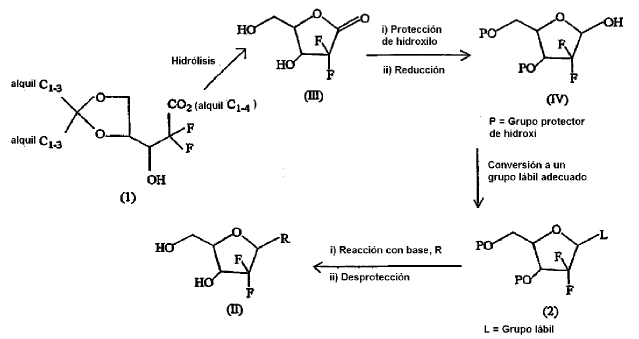
Síntesis de 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos (II) como se describe en los documentos US 4.526.988; US 4.692.434 y US 4.808.614
Se han descrito muchas mejoras para la fabricación de los 21-desoxi-21,21-D-ribofuranosil-difluoronucleósidos de fórmula (II) y sus productos intermedios, que se resumen a continuación:
i) Chou et al. en la patente de EE.UU. nº 4.965.374 describen un método para preparar el enantiómero eritro de un compuesto lactona de fórmula (III), en el que el grupo protector de hidroxi P es benzoilo, con una pureza mayor al 95%, que comprende la disolución de una mezcla de los enantiómeros eritro y treo en cloruro de metileno, enfriamiento de la disolución de -5ºC a + 10ºC y recogida del enantiómero eritro precipitado por filtración como tal u opcionalmente después de adición de hexano.

Separación de enantiómeros eritro y treo de la lactona (III) como se describe en el documento US 4.965.374
ii) Chou et al. en la patente de EE.UU. nº 5.223.608 enseñan un método para obtener el anómero ß del hidrocloruro de gemcitabina de fórmula (IIb) o la sal de hidrobromuro correspondiente con una pureza de aproximadamente 80%, que comprende las etapas de disolver una mezcla 1:1 de los anómeros a y ß en agua a una temperatura de aproximadamente 50ºC a 100ºC, seguido de la adición de acetona a la disolución y recolección de dicho anómero ß precipitado con 80% de pureza después de enfriar la mezcla a aproximadamente -10ºC a 50ºC.
La patente de EE.UU. nº 5.223.608 también cita un método para enriquecer la pureza del anómero ß del hidrocloruro de gemcitabina de fórmula (IIb) o la correspondiente sal de hidrobromuro hasta el 99%, que comprende someter el material de 80% de pureza como se ha obtenido en el método mencionado antes a una purificación repetida usando el mismo método de purificación.
La patente de EE.UU. nº 5.223.608 describe además un método para obtener el hidrocloruro de gemcitabina enriquecido en el anómero ß de fórmula (IIb) o la correspondiente sal de hidrobromuro con una pureza de 99%, que comprende las etapas de disolver una mezcla 1:1 de los anómeros a y ß en agua a una temperatura de aproximadamente 45ºC a 90ºC, seguido de ajuste del pH de la disolución a aproximadamente 7,0 a 9,0 y recoger dicho anómero ß precipitado de 99% de pureza después de enfriar la mezcla de aproximadamente -10ºC a 30ºC. La base así obtenida se somete al mismo método de cristalización en presencia de cloruro de hidrógeno o bromuro de hidrógeno para dar el hidrocloruro de gemcitabina de fórmula (IIb) deseado o la correspondiente sal de hidrobromuro, con una pureza anomérica de aproximadamente 99% del anómero ß.
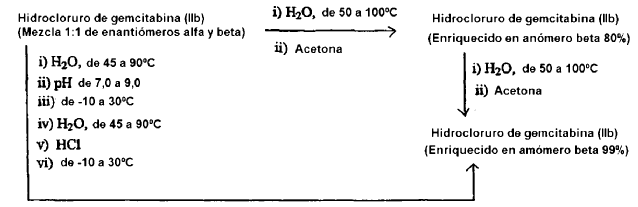
Preparación del hidrocloruro de gemcitabina (IIb) enriquecido en el anómero beta como se describe en el documento US 5.223.608
Sin embargo, los métodos descritos en la patente de...
Reivindicaciones:
1. Un compuesto de fórmula (I),
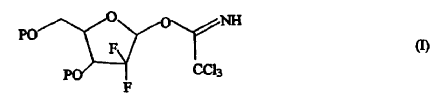
en la que P es hidrógeno o un grupo protector de hidroxi.
2. Un compuesto de fórmula (I) de acuerdo con la reivindicación 1, en la que el grupo protector P se selecciona de uno cualquiera de formilo, 2-cloroacetilo, bencilo, difenilmetilo, trifenilmetilo, 4-nitrobencilo, fenoxicarbonilo, butilo terciario, metoximetilo, tetrahidropiranilo, alilo, tetrahidrotienilo, 2-metoxietoximetilo, metoxiacetilo, fenoxiacetilo, isobutirilo, etoxicarbonilo, benciloxicarbonilo, mesilo, trimetilsililo, isopropildimetilsililo, metildiisopropilsililo, triisopropilsililo o (butil terciario)dimetilsililo.
3. Un procedimiento para preparar un compuesto de fórmula (I) que comprende hacer reaccionar un compuesto lactol de fórmula (IV),
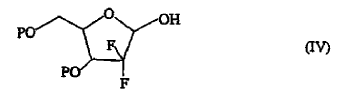
en la que P es como se ha definido en lo que antecede, con tricloroacetonitrilo en un disolvente orgánico inerte y en presencia de una base.
4. Un procedimiento según la reivindicación 3, en el que el disolvente orgánico se selecciona de hidrocarburos halogenados, ésteres de alquilo (C1-4) de ácido acético, éteres e hidrocarburos aromáticos.
5. Un procedimiento según la reivindicación 3 ó 4, en el que el disolvente orgánico inerte se selecciona de diclorometano, 1,2-dicloroetano, acetato de etilo, éter diisopropílico o tolueno.
6. Un procedimiento según una cualquiera de las reivindicaciones 3 a 5, en el que la base se selecciona de dietilamina, trietilamina, diisopropiletilamina, ciclohexilamina, piridina, 2,4-dimetilaminopiridina y N-metilmorfolina.
7. Un procedimiento según una cualquiera de las reivindicaciones 3 a 6, en el que la base se usa en cantidades catalíticas, equimolares o en proporciones molares de 1 a 3 moles por mol de compuesto de fórmula (IV), preferiblemente en cantidades catalíticas.
8. Un procedimiento según una cualquiera de las reivindicaciones 3 y 7, en el que el tricloroacetonitrilo se usa en proporciones equimolares respecto al compuesto lactol de fórmula (IV) o en proporciones molares de 1 a 20 moles por mol de compuesto de fórmula (IV), preferiblemente en proporciones molares de 1,0 a 15 moles por mol de compuesto de fórmula (IV).
9. Un procedimiento según una cualquiera de las reivindicaciones 3 y 9, en el que la reacción se lleva a cabo a una temperatura en el intervalo entre -20ºC y 20ºC.
10. Un procedimiento de glicosilación estereoselectiva para preparar hidrocloruro de gemcitabina de fórmula (IIb) enriquecido en el anómero ß en más de 99%,
que comprende las etapas de:
a) glicosilar un compuesto de fórmula (I),
en la que P es como se ha definido en lo que antecede, con citosina de fórmula (Va) o (Vb)
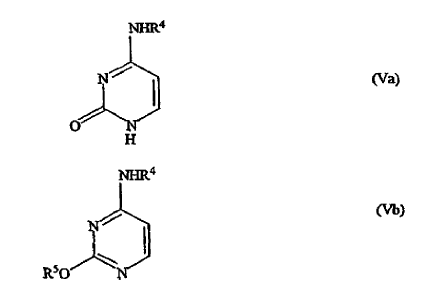
en las que R4 es un grupo protector de nitrógeno y R5 es un grupo protector de hidroxi, en presencia de un disolvente orgánico inerte y opcionalmente en presencia de un catalizador ácido de Lewis para dar la base libre de la gemcitabina protegida de fórmula (IIa),
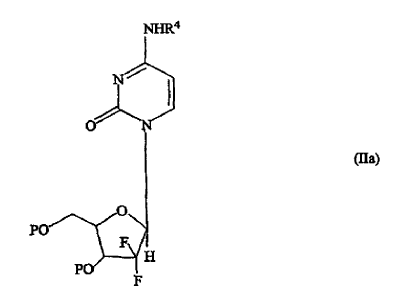
en la que P y R4 son como se han definido en lo que antecede;
b) eliminar dichos grupos protectores por tratamiento de dicho compuesto de fórmula (IIa) con amoniaco acuoso en presencia de un alcohol C1-3 o con resinas de intercambio aniónico intercambiadas con ion hidroxi, para dar la base libre de la gemcitabina de fórmula (IIc) enriquecida en el anómero ß;
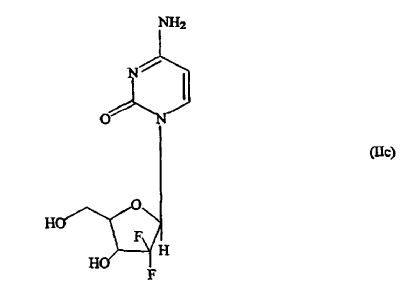
c) poner en contacto la base libre de la gemcitabina de fórmula (IIc) así obtenida con cloruro de hidrógeno en un alcohol C1-3 para dar el hidrocloruro de gemcitabina de fórmula (IIb) enriquecido en el anómero ß con pureza
d) opcionalmente enriquecer más el hidrocloruro de gemcitabina de fórmula (IIb) en el contenido de anómero ß hasta más de 99% por cristalización de una mezcla de un ácido orgánico alifático C2-3 y agua.
11. Un procedimiento según la reivindicación 10, en el que el grupo protector de nitrógeno R4 y el grupo protector de hidroxilo R5 en los compuestos de fórmula (Va) y (Vb) son acetilo o trialquilsililo.
12. Un procedimiento según la reivindicación 10 u 11, en el que el disolvente orgánico inerte se selecciona de acetonitrilo, tolueno, xileno y sus isómeros, clorobenceno, orto-diclorobenceno, diclorometano, 1,1-dicloroetano, 1,2-dicloroetano, 1,1,2-tricloroetano y anisol.
13. Un procedimiento según una cualquiera de las reivindicaciones 10 a 12, en el que el catalizador ácido de Lewis se selecciona de tetracloruro de estaño, trifluorometanosulfonato de trimetilsililo, nonafluorobutilsulfonato de trimetilsililo, perclorato de trimetilsililo, dietileterato de trifluoruro de boro y tetrafluoroborato de trimetilsililo.
14. Un procedimiento según una cualquiera de las reivindicaciones 10 a 13, en el que los compuestos de citosina (Va) y (Vb) se usan en proporciones molares de 1 a 2,0 moles por mol de compuesto de fórmula (I).
15. Un procedimiento según una cualquiera de las reivindicaciones 10 a 14, en el que el alcohol C1-3 se selecciona de metanol, etanol, 1-propanol o 2-propanol.
16. Un procedimiento según una cualquiera de las reivindicaciones 10 a 15, en el que la desprotección de los grupos protectores P, R4 y R5 comprende el tratamiento del compuesto de fórmula (IIa) con amoniaco acuoso, en presencia de un alcohol C1-3 y se lleva a cabo a una temperatura entre temperatura ambiente y aproximadamente 60ºC.
17. Un procedimiento según una cualquiera de las reivindicaciones 10 a 16, en el que la resina de intercambio aniónico es una resina de intercambio aniónico de base fuerte.
18. Un procedimiento según una cualquiera de las reivindicaciones 10 a 17, en el que resina de intercambio aniónico de base fuerte se selecciona de resinas Amberlite tales como FPA40 Cl, FPA90 Cl, FPA91 Cl, FPA97 Cl, FPA98 Cl, IRA400, IRA402 Cl, IRA410 Cl.
19. Un procedimiento según una cualquiera de las reivindicaciones 10 a 13, en el que el ácido orgánico alifático C2-3 es ácido acético o ácido propiónico.
Patentes similares o relacionadas:
2''-Cloro aminopirimidinona y nucleósidos de diona de pirimidina, del 17 de Junio de 2020, de GILEAD SCIENCES, INC.: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: R1 se selecciona de NH y N; la línea discontinua […]
Compuestos y métodos para la síntesis de 5-(triptaminocarboxiamida n-protegida)-2''-desoxiuridina fosforamidita para su incorporación a una secuencia de ácido nucleico, del 11 de Marzo de 2020, de Somalogic, Inc: Un compuesto de fórmula A o fórmula B: **(Ver fórmula)** o una de sus sales; en el que, R1 se selecciona entre terc-butilo, 1,1-dimetil-10 propilo, […]
Profármacos de 5-aza-pirimidina sililada útiles para tratar el cáncer, del 19 de Junio de 2019, de Epigenetics Pharma LLC: Un compuesto sililado que tiene la fórmula (a), definida como sigue: **Fórmula** en la que R1, R2, R7, y R8 se seleccionan de modo independiente de hidrógeno […]
Análogos de N-nucleósido de pirimidina 1-sustituidos para un tratamiento antiviral, del 12 de Junio de 2019, de GILEAD SCIENCES, INC.: Un Compuesto seleccionado de:**Fórmula** o una sal farmacéuticamente aceptable de los mismos.
Sal de 1-(2-desoxi-2-fluoro-4-tio-beta-D-arabinofuranosil)citosina, del 24 de Abril de 2019, de FUJIFILM CORPORATION: Un cristal de metanosulfonato de 1-(2-desoxi-2-fluoro-4-tio-ß-D-arabinofuranosil)citosina.
Nucleósidos o nucleótidos modificados, del 9 de Octubre de 2018, de ILLUMINA CAMBRIDGE LIMITED: Molécula de nucleótido o nucleósido modificada que comprende una base de purina o pirimidina y un resto de azúcar de ribosa o desoxirribosa que tiene un grupo […]
Sondas de fluoróforo atenuadoras oscuras de ácido nucleico estabilizado, del 28 de Junio de 2017, de BIOSEARCH TECHNOLOGIES, INC: Uso de una sonda para la detección de un polimorfismo en secuencias objetivo de ácido nucleico, comprendiendo la sonda un oligómero de ácido […]
Compuestos de bola-anfifílicos y sus usos para aplicaciones biomédicas, del 13 de Abril de 2016, de Université de Bordeaux: Un compuesto de fórmula (I) R1-X-A-X-R2 (I) en el que - X is oxígeno, -NH-C(O)-NH- o -C(O)-NH- - A es una cadena de hidrocarburo C4-C30, lineal o […]