Interacciones proteína-proteína para realización de perfiles farmacológicos.
Un procedimiento para efectuar la retirada de un compuesto de ensayo con propiedades no deseables,
comprendiendo dicho procedimiento el análisis de dicho compuesto de ensayo que tiene propiedades no deseablescontra un panel de ensayos de complementación de fragmentos proteicos a base de células, comprendiendo dichopanel dos o más ensayos de complementación de fragmentos proteicos de alto contenido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/012225.
Solicitante: ODYSSEY THERA, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4550 NORRIS CANYON ROAD, SUITE 140 SAN RAMON, CA 94583 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MICHNICK, STEPHEN, WILLIAM, WATSON, WESTWICK,John K, KEON,Brigitte, MacDONALD,Marnie.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
- C40B30/04 C […] › C40 TECNOLOGIA COMBINATORIA. › C40B QUIMICA COMBINATORIA; BIBLIOTECAS, p. ej. QUIMIOTECAS (bibliotecas combinatorias in silico de ácidos nucleicos, proteínas o péptidos G16B 35/00; química combinatoria in silico G16C 20/60). › C40B 30/00 Procedimientos de selección de bibliotecas. › midiendo la capacidad para unirse específicamente a una molécula diana, p. ej. unión anticuerpo-antígeno, unión receptor-ligando.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
- G06F19/00
- G06F19/12
PDF original: ES-2387841_T3.pdf
Fragmento de la descripción:
Interacciones proteína-proteína para realización de perfiles farmacológicos
Antecedentes de la invención
El documento US 2004/063088 desvela procedimientos para analizar el efecto de un agente biológicamente activo 5 en rutas celulares para establecer conjuntos de datos de biomapas, que comprenden el uso de ELISA basados en células en un panel de combinaciones de ensayo.
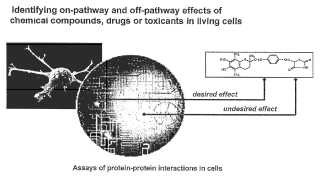
El concepto de fármacos selectivos ha dominado el descubrimiento y desarrollo de nuevos agentes terapéuticos durante el último siglo. Una molécula puede ser un agente terapéutico potencialmente útil si se puede demostrar que efectúa de forma selectiva un cambio en la fisiología celular actuando de una manera deseada en una diana dentro
de la rutas bioquímicas que subyacen a los procesos de interés. Sin embargo, incluso un compuesto químico extremadamente selectivo que se una a una diana terapéutica puede tener efectos completamente inesperados o “fuera de ruta” cuando se pone en contacto con una célula viva. Tale efectos pueden dar como resultado fallos preclínicos y clínicos caros. Para los fines de la presente invención, los inventores definen actividad “fuera de ruta” como cualquier actividad de un compuesto en una ruta distinta de la diana pretendida del compuesto.
La identificación de mecanismos de acción de fármacos y sus actividades fuera de ruta no puede conseguirse con ensayos enzimáticos debido a que no es factible preparar un ensayo para cada una de las decenas de miles de proteínas que representan el medio biológico. Para evaluar el modo de acción de un fármaco dentro de las complejas rutas bioquímicas que componen una célula viva, se necesita un medio para explorar las rutas directamente. Por lo tanto, los inventores buscaron una estrategia general para realización de perfiles
farmacológicos. En particular los inventores buscaron determinar si podrían usarse medidas cuantitativas de interacciones proteína-proteína para realizar los perfiles de la actividad farmacológica a gran escala.
Los antecedentes para la presente invención son como siguen. La unión de agonistas a receptores induce una cascada de acontecimientos intracelulares mediada por otras moléculas de señalización. Conceptualmente tales cascadas de señalización implican la asociación y disociación reguladas de proteínas dentro de complejos
macromoleculares. Además, el ensamblaje y desensamblaje de complejos proteína-proteína se produce de forma dinámica tras la adición de un agonista, antagonista o inhibidor de una ruta. Finalmente, el ensamblaje y desensamblaje de complejos proteína-proteína específicos se produce en localizaciones subcelulares particulares tales como la membrana celular, citoplasma, núcleo, mitocondria u otros compartimentos dentro de la célula.
La mayoría de los perfiles farmacológicos basados en células hasta la fecha se han realizado con micromatrices de
ADN (microplacas génicas o chips génicos) . Las micromatrices de ADN han originado el campo de la toxicogenómica, que implica el uso de poblaciones complejas de ARNm para entender la toxicidad. Las células, o animales completos, se tratan con fármacos; se aísla ARN mensajero de la célula o tejido; y se comparan los patrones de expresión génica del ARNm en ausencia y presencia de un fármaco. Tal realización de perfiles transcripcionales puede revelar diferencias entre compuestos, cuando los compuestos afectan a la actividad
transcripcional en última instancia de una o más rutas. La identificación de rutas específicas que se estimulan o reprimen en respuesta a condiciones o tratamientos específicos es una forma útil de comenzar a desentrañar los mecanismos celulares de enfermedad y respuesta a fármaco. Sin embargo, los cambios en el nivel de moléculas de ARNm individuales no siempre se correlacionarán directamente con el nivel de actividad de la proteína correspondiente en un punto temporal sencillo. Además, muchas proteínas experimentan numerosas modificaciones
post-traduccionales e interacciones proteicas, que pueden afectar a las funciones y actividades de las proteínas dentro de un tejido o célula. Por lo tanto, simplemente identificar todas las especies de ARNm presentes y los niveles a los que están presentes en un momento particular, puede no producir la imagen completa de un fármaco particular. Finalmente, un fármaco diana puede afectar a la transcripción de docenas de genes, haciendo la interpretación de los resultados de experimentos de microplacas génicas una tarea ardua.
45 La regulación de respuestas celulares está mediada por un cierto número “umbral” de interacciones moleculares que con el tiempo alcanzan el núcleo celular e inducen que el aparato génico de la célula sintetice proteínas de nueva expresión en respuesta a los estímulos iniciales. Los ensayos de gen indicador acoplan la actividad biológica de una diana con la expresión de una enzima fácilmente detectada o indicador proteico, permitiendo controlar los acontecimientos celulares asociados con la transducción de señales y expresión génica. Basándose en la fusión de
50 elementos de control transcripcionales con una diversidad de genes indicadores, estos sistemas “indican” los efectos de una cascada de acontecimientos de señalización en la expresión génica dentro de las células. Pueden insertarse repeticiones sintéticas de un elemento de respuesta particular corriente arriba del gen indicador para regular su expresión en respuesta a moléculas de señalización generadas por activación de una ruta específica en una célula viva. Se ha demostrado que tales ensayos son útiles en exploración primaria y secundaria de bibliotecas químicas y
55 candidatos a fármaco por sus efectos biológicos y se han usado paneles de ensayos indicadores de transcripción para realizar el perfil de la actividad farmacológica (Bionaut, Inc.) . Aunque los ensayos indicadores de transcripción tienen la capacidad de proporcionar información sobre la respuesta de una ruta para agentes químicos, tales ensayos solamente miden la consecuencia de la activación o inhibición de la ruta, y no el sitio de acción del compuesto.
Las medidas directas de acontecimientos específicos dentro de la ruta de señalización eliminarían los problemas asociados con la interpretación de los perfiles de transcripción. A diferencia de los ensayos indicadores de transcripción, la información obtenida por control de una interacción proteína-proteína refleja el efecto de un fármaco en una rama particular o nodo de una ruta de señalización celular, no su punto final. Por ejemplo, la estimulación de una ruta por un agonista podría conducir a un aumento de la asociación de una proteína intracelular (tal como una quinasa) con un compañero de unión afín (tal como un sustrato) . La estimulación da como resultado la fosforilación de sustrato por la quinasa. El efecto farmacológico podría por lo tanto ensayarse cuantificando la fosforilación de sustrato o la cantidad o localización del complejo quinasa/sustrato en ausencia y presencia del agonista. En este ejemplo el complejo quinasa/sustrato actúa como un centinela de la actividad de la ruta. Un fármaco que actúe al comienzo de la ruta (tal como un antagonista de receptor) o que actúe en otra diana corriente abajo del receptor podría alterar la cantidad o localización o estado de modificación del complejo quinasa/sustrato dentro de la célula. Por lo tanto, la evaluación del complejo quinasa/sustrato en ausencia o presencia de un compuesto químico revelaría si el compuesto químico actúa o no en esa ruta. Idealmente tales cambios se medirían en células intactas. Es decir, se tratarían células de interés con el compuesto de ensayo durante un periodo de tiempo definido y el centinela de ruta o la interacción se evaluarían en la célula intacta (viva o fijada) .
Los ensayos de alto contenido son particularmente prometedores puesto que son capaces de diferenciar acontecimientos que se producen en el nivel subcelular. Las rutas se organizan con frecuencia en gran medida en el espacio subcelular, con receptores de membrana que reciben señales en la membrana plasmática y transmiten esas señales al núcleo celular, dando como resultado la activación o represión de transcripción génica. Con ensayos de alto contenido, las señales de fluorescencia en la membrana, citosol, núcleo y otros compartimentos subcelulares puede diferenciarse. Tales ensayos... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para efectuar la retirada de un compuesto de ensayo con propiedades no deseables, comprendiendo dicho procedimiento el análisis de dicho compuesto de ensayo que tiene propiedades no deseables contra un panel de ensayos de complementación de fragmentos proteicos a base de células, comprendiendo dicho
panel dos o más ensayos de complementación de fragmentos proteicos de alto contenido.
2. Un procedimiento para efectuar la retirada de un compuesto de ensayo con propiedades no deseables, comprendiendo dicho procedimiento el análisis de dicho compuesto de ensayo que tiene propiedades no deseables contra un panel de ensayos de complementación de fragmentos proteicos, comprendiendo dicho panel ensayos de alto contenido para dos o más interacciones proteína-proteína.
3. El procedimiento de la reivindicación 1 ó 2, en el que el ensayo de complementación de fragmentos proteicos se usa en una célula, fluido biológico o extracto.
4. El procedimiento de la reivindicación 3, en el que la célula es una línea celular, célula en cultivo, componente de un tejido intacto o animal, órgano en cultivo o un organismo vivo no humano.
5. El procedimiento de la reivindicación 3 ó 4, en el que la célula es una célula de mamífero, bacteria, levadura, 15 planta u hongo.
6. El procedimiento de la reivindicación 4, en el que el organismo vivo no humano o animal es Drosophila, pez cebra
o ratón.
7. El procedimiento de cualquiera de las reivindicaciones 1 a 6, en el que el compuesto de ensayo es una molécula
sintética, producto natural, fármaco conocido o potencial, ligando, anticuerpo, péptido, ARN de interferencia pequeño 20 o biblioteca combinatoria.
Patentes similares o relacionadas:
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Sistema y método para medir una concentración de analito corregida usando un sensor electroquímico, del 20 de Mayo de 2020, de CILAG GMBH INTERNATIONAL: Un método para determinar una concentración de un analito en una muestra, el método comprendiendo: introducir una muestra que incluye un analito en una […]
Sistemas, dispositivos y métodos para mejorar la precisión de biosensores usando el tiempo de llenado, del 18 de Marzo de 2020, de LIFESCAN, INC.: Un sistema electroquímico, que comprende: una celda electroquímica que tiene un electrodo inferior y un electrodo superior ; […]
Sistemas, dispositivos y métodos para mejorar la precisión de biosensores usando el tiempo de llenado, del 18 de Marzo de 2020, de LIFESCAN, INC.: Un método para medir una concentración de analito corregida en una muestra de sangre, el método comprendiendo: detectar una presencia de la muestra de […]
Medida de analito ajustada en temperatura para sistemas de biosensor, del 19 de Febrero de 2020, de Ascensia Diabetes Care Holdings AG: Un método para determinar una concentración de analito en una muestra de un fluido biológico, que comprende las siguientes etapas: determinar […]
Métodos analíticos y de diagnóstico que utilizan apirasa de Shigella flexneri, del 19 de Febrero de 2020, de ApiRays Bioscience AB: Método para reducir la cantidad de nucleósido difosfatos y/o nucleósido trifosfatos contaminantes, que comprende las etapas de a. proporcionar […]
Procedimiento de detección y de identificación directa de un microorganismo en una muestra biológica diluida en un caldo de enriquecimiento, del 19 de Febrero de 2020, de BIOMERIEUX: Procedimiento de detección de al menos un microorganismo presente en una muestra colocada en un contenedor cerrado, comprendiendo dicho método esencialmente las etapas siguientes: […]