Inhibidores de proteasa poli-pegilados.
Un compuesto que comprende:
(i) un polipéptido que comprende un dominio de K unitz que se une a e inhibe una proteasa,
en donde eldominio de Kunitz se selecciona del grupo que consiste de:
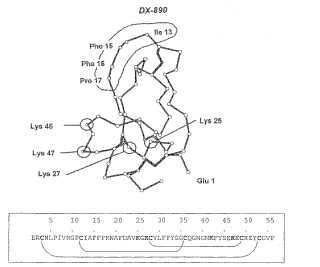
(a) un péptido que comprende la secuencia de aminoácidos de DX-890 que se expone en la sec. connúm. de ident.:23 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cincoaminoácidos de la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. deident.:23;
(b) un péptido que comprende la secuencia de aminoácidos de DX-88 que se expone en la sec. connúm. de ident.:24 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cincoaminoácidos de la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. deident.:24; y
(c) un péptido que comprende la secuencia de aminoácidos de DX-1000 que se expone en la sec. connúm. de ident.:25 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cincoaminoácidos de la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. deident.:25,
en donde el péptido no incluye una amina primaria en ninguna de las regiones bucles de unión deldominio de Kunitz, en donde dichas regiones bucles de unión corresponden a (i) las posiciones deaminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos delinhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2; y
(ii) una pluralidad de porciones de polietilenglicol, en donde el peso molecular promedio de cada porciónde polietilenglicol es menor que 12 kDa, y cada uno de al menos cuatro aminas primarias del polipéptidoestá unida a una porción de polietilenglicol, en donde dichas aminas primarias consisten de una aminaprimaria N-terminal y/o aminas primarias de cadenas laterales de lisina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/028257.
Solicitante: DYAX CORP..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 55 Network Drive Burlington, MA 01803-2756 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LADNER, ROBERT, CHARLES, LEY,ARTHUR,C, SATO,AARON K, STOCHL,MARK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/43 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Enzimas; Proenzimas; Sus derivados.
- A61K47/48
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- C07K14/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C07K14/81 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Inhibidores de proteasa.
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- C12N9/66 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Elastasa.
- C12N9/99 C12N 9/00 […] › Inactivación de enzimas por tratamiento químico.
PDF original: ES-2447423_T3.pdf
Fragmento de la descripción:
Inhibidores de proteasa poli-pegilados Resumen En un aspecto, la invención caracteriza a un compuesto que incluye: a) un polipéptido que incluye un dominio de Kunitz que se une específicamente y/o inhibe una proteasa; y b) una pluralidad de polietilenglicol: porciones que están asociadas físicamente con el polipéptido y que aumentan el peso molecular del compuesto como se define en las reivindicaciones. El término "dominio de Kunitz poly-PEGilado" se refiere en la presente al compuesto antes mencionado.
El compuesto (es decir, el polipéptido más la pluralidad de porciones no proteicas) tiene un peso molecular mayor que 12, 14 o 16 kDa. En una modalidad, cada porción no proteica tiene un peso molecular promedio de entre 3 y 12 kDa, 3 y 10 kDa, 3 y 8 kDa, 4 y 6 kDa, por ejemplo, aproximadamente 4, 5, 6, 7, o 8 kDa.
La proteasa que se une y/o que se inhibe puede ser, por ejemplo, una elastasa (por ejemplo, la elastasa de neutrófilos humana (hNE) ) , una plasmina, una calicreína, u otra proteasa, por ejemplo, una proteasa descrita en la presente. Por ejemplo, la proteasa puede ser una serina proteasa.
Las porciones no proteicas son unidas a cada amina primaria disponible en el dominio de Kunitz, es decir, la amina primaria N-terminal y aminas primarias accesibles de cadenas laterales de lisina en el dominio de Kunitz. Por ejemplo, todas las posibles aminas primarias se conjugan a una de las porciones no proteicas. El dominio de Kunitz puede tener al menos tres o cuatro lisinas. Por ejemplo, el dominio de Kunitz puede tener solamente tres, cuatro, o cinco lisinas. En una modalidad, el polipéptido tiene una amina primaria N-terminal. En otra modalidad, el polipéptido no incluye una amina primaria N-terminal (por ejemplo, el polipéptido se puede modificar químicamente, por ejemplo, con un compuesto no polimérico, en su amina primaria N-terminal de manera que el polipéptido no incluye una amina primaria en esa posición) .
Una porción no proteicas puede unirse a 4 o más de las aminas primarias en el polipéptido. Por ejemplo, todas las lisinas o todas las lisinas que tienen una amina primaria accesible al solvente se unen a una porción no proteica. Preferentemente, el dominio de Kunitz no incluye una lisina dentro de uno de sus bucles de unión, por ejemplo, aproximadamente los residuos correspondientes a los aminoácidos 11-21 de BPTI y 31-42 de BPTI. Las lisinas dentro de dichos bucles de unión pueden reemplazarse, por ejemplo, con residuos de arginina. A menos que se indique de otra manera, cuando se dice que una amina primaria, por ejemplo, la de una lisina particular o en el extremo N terminal, se modifica o tiene una porción no proteica unida a ella, se entiende que la posición de la amina primaria especificada en cada molécula en una preparación no se puede modificar de modo. Las preparaciones no necesitan ser perfectamente homogéneas para estar dentro de la invención. La homogeneidad es deseable en algunas modalidades, pero no tiene que ser absoluta. En modalidades preferidas, al menos 60, 70, 80, 90, 95, 97, 98, 99, o 100% de una amina primaria que se designa como modificada tendrá una porción no proteica unida a ella. Otras modalidades sin embargo, incluyen preparaciones que contienen una mezcla de especies en las que la mayoría de las moléculas, por ejemplo, al menos 60, 70, 80, 90, 95, 97, 98, 99, o 100% son PEGiladas en cuatro o más sitios pero los sitios (y en algunos casos el número de sitios modificados) variará en las moléculas en la preparación. Por ejemplo, algunas moléculas tendrán lisinas A, B, y D modificadas mientras que otras moléculas tendrán el terminal amino y lisinas A, B, C, y D modificadas.
El polímero es polietilenglicol. El polímero puede ramificarse o no ramificarse. Por ejemplo, la porción de polímero tiene un peso molecular (por ejemplo, un peso molecular promedio de las porciones añadidas al compuesto) que es menor que 12, 10, 8, 7, o 6 o al menos 1.5, 2, 2.5, 3, 5, 6, 10 kDa, por ejemplo, aproximadamente 5 kDa. En una modalidad, la suma del peso molecular de las porciones PEG en el compuesto es la menos 15, 20, 25, 30, o 35, y/o menos que 60, 50, 40, 35, 30, 25, o 23 kDa.
En una modalidad, el compuesto tiene la siguiente estructura:
P-X0-[CH2CH2O]a - (CH2) m-X2-R1
en donde P es el polipéptido, a es al menos 4, m está entre 0 y 5, X2 es O N-R1, S, o está ausente, en donde R1 es H, alquilo o arilo, X0 es O, N-R2, S, o está ausente, en donde R2 es H, alquilo o arilo, y R2 es H, C1-C12 alquilo o arilo. Por ejemplo, X2es O, y R1 es CH3. (Se prefiere el uso de mPEG.)
En una modalidad, el polipéptido de dominio de Kunitz es menor que 14, 8, o 7 kDa de peso molecular. En una modalidad, el polipéptido de dominio de Kunitz incluye solamente un dominio de Kunitz. Generalmente, el compuesto incluye solamente un dominio de Kunitz, pero en algunas modalidades, puede incluir más de uno.
El dominio de Kunitz incluye la secuencia de aminoácidos de DX-890, DX-88, o DX-1000 o una secuencia de aminoácidos que difiere en al menos uno, pero menor que seis, cinco, cuatro, tres, dos o diferencias de aminoácidos (por ejemplo, sustituciones, inserciones, o deleciones) de la secuencia de aminoácidos de DX-890, DX-88, o DX1000. Típicamente, el dominio de Kunitz no se produce de forma natural en los seres humanos. El dominio de Kunitz puede incluir una secuencia de aminoácidos que difiere en menos de diez, siete o cuatro aminoácidos de un dominio de Kunitz humano.
En una modalidad, la Ki del compuesto está dentro de un factor de 0.5 a 1.5, 0.8 a 1.2, 0.3 a 3.0, 0.1 a 10.0, o 0.02 a 50.0 de la Ki del polipéptido no modificado para la elastasa. Por ejemplo, la Ki para hNE puede ser menor que 100, 50, 18, 12, 10, o 9 pM.
En una modalidad, el compuesto tiene una vida media circulatoria del componente de mayor duración ("vida media circulatoria de fase más larga") en un modelo de conejo o de ratón que es al menos 1.5, 2, 4, u 8 veces mayor que un compuesto sustancialmente idéntico que no incluye el polímero. El compuesto puede tener una vida media circulatoria de fase más larga en el modelo de conejo o de ratón que tiene una amplitud al menos 1.5, 2, 2.5, o 4 veces mayor que un compuesto sustancialmente idéntico que no incluye la porción no proteica. El compuesto puede tener una vida media circulatoria fase alfa en un modelo de conejo o de ratón que tiene una amplitud al menos 20, 30, 40, o 50% menor que un compuesto sustancialmente idéntico que no incluye la porción no proteica. Por ejemplo, el compuesto tiene una vida media circulatoria de fase más larga con una amplitud al menos 40, 45, 46, 50, 53, 54, 60, o 65%. En una modalidad, el compuesto tiene una vida media circulatoria fase beta en un modelo de conejo o de ratón de al menos 2, 3, 4, 5, 6, o 7 horas. En una modalidad, el compuesto tiene una vida media circulatoria de fase más larga en un humano de 70 kg de al menos 6 horas, 12 horas, 24 horas, 2 días, 5 días, 7 días, o 10 días.
En una modalidad, el compuesto tiene una vida media circulatoria de fase más larga en un modelo de conejo de al menos 4200 minutos, 4700 minutos, o 4980 minutos (o aproximadamente 83 horas) . En una modalidad, el compuesto tiene una vida media circulatoria de fase más larga que es mayor que una molécula de tamaño similar con el mismo dominio de Kunitz, pero solamente una única porción PEG (es decir, una versión mono-PEGilada del mismo dominio de Kunitz) . La vida media de fase más larga puede ser al menos 5, 10, 20, 30, o 50% más larga. En una modalidad, en un ratón, la vida media circulatoria de fase más larga tiene una amplitud mayor que 50, 55, 60, o 65%. La vida media de fase más larga puede ser, por ejemplo, mayor que 550, 600, 700, 750, 900, 1000, 1100 minutos.
En una modalidad, el compuesto tiene una mayor solubilidad (por ejemplo, 1.5, 2, 4, u 8 veces mayor) en una solución acuosa que tiene un pH entre 5 y 8 y una fuerza iónica inferior a la fuerza iónica de NaCl 0, 5 M que el polipéptido que no incluye la porción no proteica.
En una modalidad, el polietilenglicol se une mediante el acoplamiento de monometoxi-propionaldehído PEG o monometoxi-ácido succinimidil propiónico PEG al polipéptido. El compuesto puede formarse mediante acoplamiento de mPEG (CH3- (O-CH2-CH2) n-) a un pH que permite la unión a grupos amino accesibles en las cadenas laterales de lisina y al grupo amino N-terminal, por ejemplo, un pH 6.8 a 8.8, por ejemplo, entre 7.4 y 8.8.
En otro aspecto, la invención caracteriza un compuesto que incluye (1) un polipéptido que incluye la secuencia de aminoácidos de DX-890, DX-88, o DX-1000 o una secuencia de aminoácidos que difiere en al menos uno, pero menor que seis, cinco, cuatro, tres, o dos diferencias de aminoácidos (por ejemplo,... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto que comprende:
(i) un polipéptido que comprende un dominio de Kunitz que se une a e inhibe una proteasa, en donde el dominio de Kunitz se selecciona del grupo que consiste de:
(a) un péptido que comprende la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23;
(b) un péptido que comprende la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24; y
(c) un péptido que comprende la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25,
en donde el péptido no incluye una amina primaria en ninguna de las regiones bucles de unión del dominio de Kunitz, en donde dichas regiones bucles de unión corresponden a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2; y
(ii) una pluralidad de porciones de polietilenglicol, en donde el peso molecular promedio de cada porción de polietilenglicol es menor que 12 kDa, y cada uno de al menos cuatro aminas primarias del polipéptido está unida a una porción de polietilenglicol, en donde dichas aminas primarias consisten de una amina primaria N-terminal y/o aminas primarias de cadenas laterales de lisina.
2. El compuesto de la reivindicación 1,
(a) en donde el peso molecular promedio de cada porción de polietilenglicol es menor que 8 kDa;
(b) en donde cada porción de polietilenglicol tiene un peso molecular entre 3-8 kDa; o
(c) en donde el polipéptido tiene un peso molecular menor que 8 kDa, y el compuesto tiene un peso molecular mayor que 16 kDa.
3. El compuesto de la reivindicación 1,
(a) en donde el polipéptido no incluye una lisina en ninguna de las regiones bucles de unión del dominio de Kunitz;
(b) en donde el polipéptido incluye al menos dos lisinas en la región marco del dominio de Kunitz, en donde dicha región marco no incluye ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2;
(c) en donde el polipéptido comprende tres o cuatro lisinas en la región marco del dominio de Kunitz, en donde dicha región marco no incluye ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2; o
(d) en donde el polipéptido comprende una región marco que es idéntica a la región correspondiente de un dominio de Kunitz humano, en donde dicha región marco se define para no incluir ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2.
4. El compuesto de la reivindicación 1,
(a) en donde el polipéptido comprende la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23, y la proteasa es elastasa;
(b) en donde el polipéptido comprende la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de
cinco aminoácidos de la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24, y la proteasa es calicreína; o
(c) en donde el polipéptido comprende la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25, y la proteasa es plasmina.
5. Una preparación que comprende el compuesto de la reivindicación 1, en donde al menos 80% de los polipéptidos en la preparación
(i) se unen e inhiben la proteasa, en donde los péptidos que se unen específicamente e inhiben la proteasa no incluye una amina primaria en ninguna de las regiones bucles de unión del dominio de Kunitz, en donde dichas regiones bucles de unión corresponden a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2, y
(ii) tienen una porción de polietilenglicol unida a cada una de al menos cuatro aminas primarias, en donde dichas aminas primarias consisten de una amina primaria N-terminal y/o amina primarias de cadenas laterales de lisina.
6. La preparación de la reivindicación 5, en donde el peso molecular promedio de cada una de las porciones de polietilenglicol unidas es menor que 10 kDa, particularmente menor que 8 kDa.
7. La preparación de la reivindicación 5, en donde al menos 95% de los polipéptidos del dominio de Kunitz en la preparación tienen una porción de polietilenglicol unida a cada una de las al menos cuatro amina primarias.
8. La preparación de la reivindicación 5,
(a) en donde los péptidos que se unen específicamente e inhiben la proteasa no incluyen una lisina en las regiones bucles de unión del dominio de Kunitz;
(b) en donde los péptidos que se unen específicamente e inhiben la proteasa incluyen al menos dos lisinas en la región marco del dominio de Kunitz, en donde dicha región marco no incluye ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2;
(c) en donde los péptidos que se unen específicamente e inhiben la proteasa incluyen tres lisinas en la región marco del dominio de Kunitz, en donde dicha región marco no incluye ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2;
(d) en donde los péptidos que se unen específicamente e inhiben el polipéptido proteasa incluyen cuatro lisinas en la región marco del dominio de Kunitz, en donde dicha región marco se define para no incluir ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y
(ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2; o
(e) en donde los péptidos que se unen específicamente e inhiben la proteasa comprenden una región marco que es idéntica a la región correspondiente de un dominio de Kunitz humano, en donde dicha región marco se define para no incluir ninguna de las regiones bucles de unión que corresponde a (i) las posiciones de aminoácidos 11 a 21, y (ii) las posiciones de aminoácidos 31 a 42 de la secuencia de aminoácidos del inhibidor de tripsina pancreática bovina (BPTI) que se expone en la sec. con núm. de ident.:2.
9. La preparación de la reivindicación 5,
(a) en donde el polipéptido comprende la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23, y la proteasa es elastasa;
(b) en donde el polipéptido comprende la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24, y la proteasa es calicreína; o
(c) en donde el polipéptido comprende la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25, o una secuencia de aminoácidos que difiere en al menos uno, pero no más de
cinco aminoácidos de la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25, y la proteasa es plasmina.
10. La preparación de la reivindicación 5, en donde los polipéptidos del dominio de Kunitz comprenden la secuencia de aminoácidos de DX-890 y en donde al menos 80% de los polipéptidos que contienen DX-890 en la preparación tienen una porción de polietilenglicol unida a cada una de los cuatro residuos de lisina y al N-terminal del polipéptido.
11. La preparación de la reivindicación 5, en donde los polipéptidos comprenden la secuencia de aminoácidos de DX-88 y en donde al menos 80% de los polipéptidos del dominio de Kunitz que contienen DX-88 en la preparación tienen una porción de polietilenglicol unida a cada uno de los tres residuos de lisina y al Nterminal del polipéptido.
12. La preparación de la reivindicación 5, en donde los polipéptidos de dominio de Kunitz comprenden la secuencia de aminoácidos de DX-1000 y en donde al menos 80% de los polipéptidos del dominio de Kunitz que contienen DX-1000 en la preparación tienen una porción de polietilenglicol unida a cada uno de los tres residuos de lisina y al N-terminal del polipéptido.
13. Un método para proporcionar un dominio de Kunitz pegilado que se une e inhibe una proteasa, el método comprende:
- proporcionar un polipéptido que comprende una secuencia de aminoácido seleccionada de:
a) la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-890 que se expone en la sec. con núm. de ident.:23;
(b) la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-88 que se expone en la sec. con núm. de ident.:24; y
(c) la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25 o una secuencia de aminoácidos que difiere en al menos uno, pero no más de cinco aminoácidos de la secuencia de aminoácidos de DX-1000 que se expone en la sec. con núm. de ident.:25; y
- contactar el polipéptido con polietilenglicol activado, de peso molecular promedio menor que 12 kDa, bajo condiciones en las que cada una de al menos cuatro aminas primarias del polipéptido se une a una porción de polietilenglicol, en donde dichas aminas primarias consisten de una amina primaria N-terminal y/o aminas primarias de cadenas laterales de lisina.
14. El método de la reivindicación 13, en donde el dominio de Kunitz tiene al menos tres grupos de amina primaria en la región marco del dominio de Kunitz.
15. El método de la reivindicación 14,
(a) en donde el marco comprende al menos tres lisinas, particularmente en donde la amina primaria de cada lisina del polipéptido se une a la porción de polietilenglicol;
(b) en donde el rendimiento es mayor que 40%; o
(c) en donde las condiciones para contactar son un pH mayor que 7.5.
16. El método de la reivindicación 14,
(a) en donde las condiciones son tales que al menos 70% de las moléculas son pegiladas en cada una de las cuatro aminas primarias;
(b) en donde las condiciones son tales que al menos 85% de las moléculas son pegiladas en cada una de las cuatro aminas primarias;
(c) en donde las condiciones son tales que al menos 70% de las moléculas pegiladas tienen el mismo número de porciones PEG unidas, las porciones se unen en las mismas posiciones; o
(d) en donde las condiciones son tales que al menos 85% de las moléculas pegiladas tienen el mismo número de porciones PEG unidas, las porciones se unen en las mismas posiciones.
17. El método de la reivindicación 14, que además comprende formular el polipéptido pegilado como una composición farmacéutica.
18. El compuesto de la reivindicación 1 para usar en el tratamiento de un trastorno caracterizado porque actividad excesiva o indeseada de una proteasa, en donde el compuesto se administra a un sujeto que tiene el trastorno o se sospecha que tiene el trastorno, en donde el polipéptido del compuesto inhibe la proteasa.
19. El compuesto para usar de la reivindicación 18,
(a) en donde la proteasa es elastasa y el polipéptido comprende la secuencia de aminoácidos de DX-890
o una secuencia que difiere en al menos uno, pero menos de seis alteraciones de aminoácidos de DX890, particularmente en donde el trastorno es fibrosis quística, COPD, o un trastorno inflamatorio; 10 (b) en donde la proteasa es calicreína y el polipéptido comprende la secuencia de aminoácidos de DX-88
o una secuencia que difiere en al menos uno, pero menos de seis alteraciones de aminoácidos de DX-88, particularmente en donde el trastorno es hemofilia, sangrado post-operatorio, sangrado peri-operatorio, o angioedema hereditario; o (c) en donde la proteasa es plasmina y el polipéptido comprende la secuencia de aminoácidos de DX15 1000 o una secuencia que difiere en al menos uno, pero menos de seis alteraciones de aminoácidos de DX-1000, particularmente en donde el trastorno es fibrinolisis o fibrinogenolisis, sangrado excesivo asociado con trombolíticos, sangrado post-operatorio, sangrado peri-operatorio, y androgénesis inapropida
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Péptidos de unión beta amiloide y sus usos para el tratamiento y el diagnóstico de la demencia de Alzheimer, del 17 de Junio de 2020, de Priavoid GmbH: Péptido que contiene al menos una secuencia de aminoácidos que se une a especies beta amiloides y en el que la carga negativa del grupo carboxilo presente […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones y métodos utilizando andamios de lisofosfatidilcolina, del 6 de Mayo de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Un método para seleccionar uno o más compuestos o ácidos grasos para determinar el transporte mediado por lisofosfatidilcolina (LPC) del uno o más compuestos o ácidos […]
Péptidos antimicrobianos y composiciones de los mismos, del 29 de Abril de 2020, de REVANCE THERAPEUTICS, INC: Composición farmacéutica o cosmética que comprende un péptido, en donde dicho péptido consiste en la secuencia de aminoácidos SEQ ID NO: 3 correspondiente […]
COMPOSICIÓN PARA LA ESTIMULACIÓN DEL SISTEMA INMUNE EN PECES QUE CONTIENE PÉPTIDOS RECOMBINANTES, PÉPTIDOS RECOMBINANTES INMUNOESTIMULANTES Y SECUENCIAS NUCLEOTÍDICAS QUE LOS CODIFICAN, del 23 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presente invención se refiere a una composición, una micropartícula y una formulación alimenticia que comprende péptidos recombinantes que estimulan el sistema inmune […]
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]