Inactivación de un patógeno en una muestra mediante un tratamiento con formalina y luz UV.
Un método para inactivar un virus contenido en una muestra, que comprende las etapas de:
(i) tratar la muestra con una concentración eficaz de formalina y
(ii) someter la muestra a una dosis eficaz de luz UV en un aparato de flujo continuo,
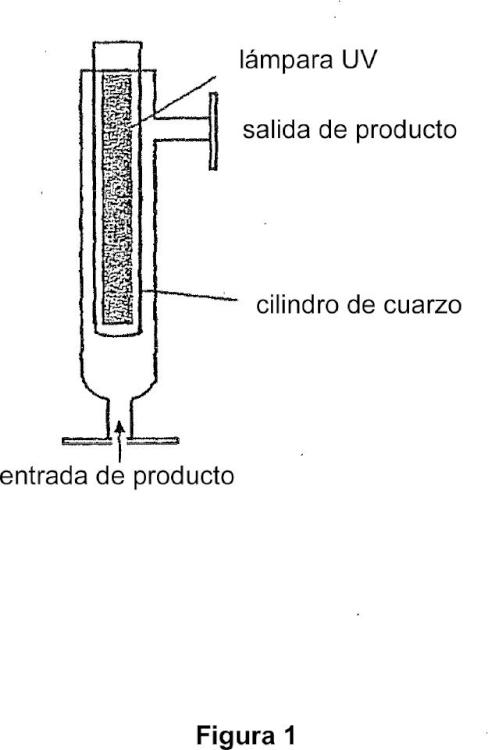
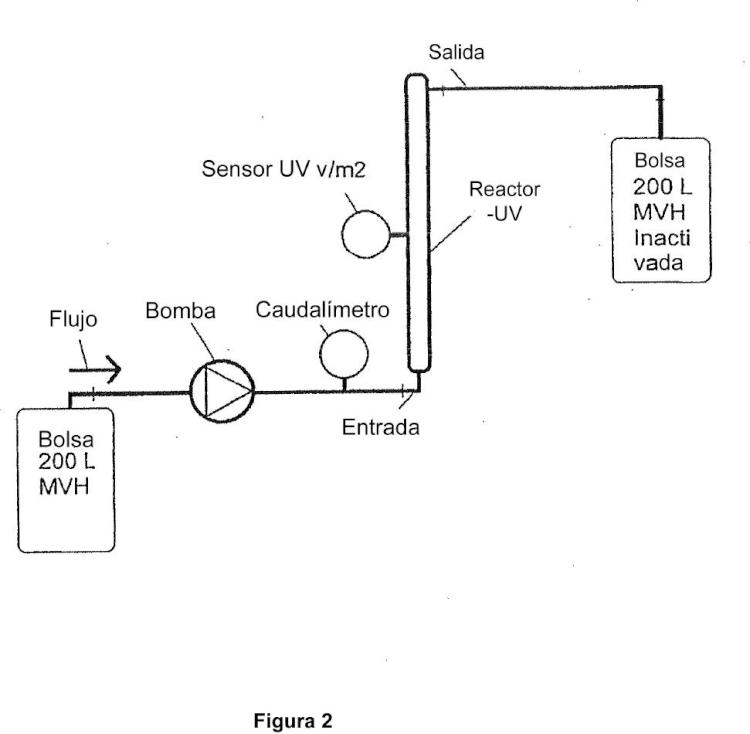
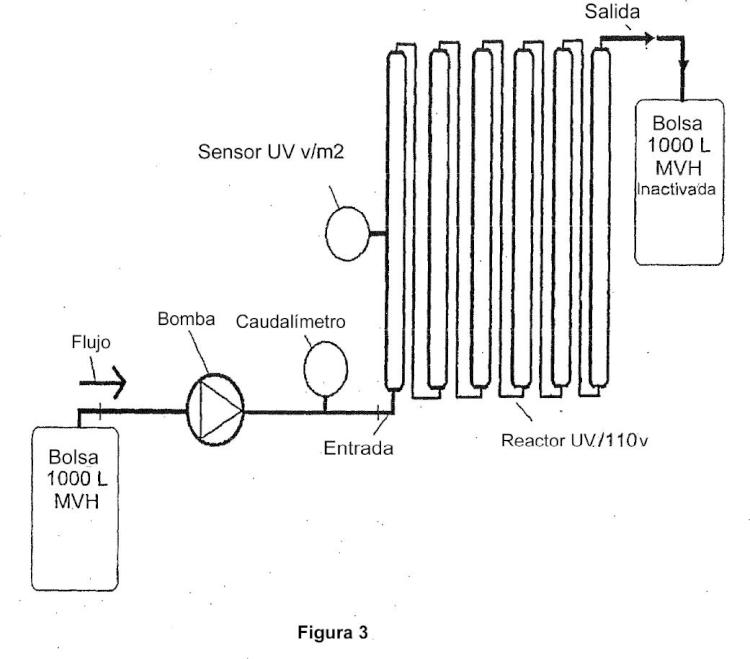
en el que el aparato de flujo continuo comprende (1) una lámpara UV y (2) una cámara de capa delgada, teniendo la capa delgada de la cámara de capa delgada un espesor no mayor que 1 cm y en el que la muestra se hace pasar a través de la cámara de capa delgada del aparato de una manera cíclica o en serie, repitiendo 2 a 10 veces, en el que la etapa (i) se realiza previamente a la etapa (ii) o viceversa y en el que el caudal de la muestra a través del aparato es de 50 litros por hora a 1.000 litros por hora.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/005691.
Solicitante: Nanotherapeutics, Inc.
Inventor/es: REITER, MANFRED, MUNDT, WOLFGANG, BARRETT, NOEL, KISTNER, OTFRIED, DR..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L2/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › Procedimientos o aparatos para desinfectar o esterilizar materiales u objetos distintos a los productos alimenticios y a las lentes de contacto; Sus accesorios (pulverizadores de desinfectantes A61M; esterilización de envases o del contenido del envase asociado a su contenedor B65B 55/00; tratamiento del agua, agua residual o de alcantarilla C02F; desinfección del papel D21H 21/36; dispositivos de desinfección para retretes E03D; artículos que incluyen accesorios para la desinfección, ver las subclases apropiadas para estos artículos, p. ej. H04R 1/12).
- A61L2/10 A61L […] › A61L 2/00 Procedimientos o aparatos para desinfectar o esterilizar materiales u objetos distintos a los productos alimenticios y a las lentes de contacto; Sus accesorios (pulverizadores de desinfectantes A61M; esterilización de envases o del contenido del envase asociado a su contenedor B65B 55/00; tratamiento del agua, agua residual o de alcantarilla C02F; desinfección del papel D21H 21/36; dispositivos de desinfección para retretes E03D; artículos que incluyen accesorios para la desinfección, ver las subclases apropiadas para estos artículos, p. ej. H04R 1/12). › Ultravioleta.
- A61M1/36 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 1/00 Dispositivos de succión o de bombeo de uso médico; Dispositivos para extraer, tratar o transportar los líquidos del cuerpo; Sistemas de drenaje (catéteres A61M 25/00; conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; dispositivos para tomar muestras sanguíneas A61B 5/15; instrumentos para retirar la saliva para dentistas A61C 17/06; filtros para implantar en los vasos sanguíneos A61F 2/01). › Otros tratamientos de la sangre en una derivación del sistema circulatorio natural, p. ej. adaptación de la temperatura, irradiación.
- C11D7/26 QUIMICA; METALURGIA. › C11 ACEITES, GRASAS, MATERIAS GRASAS O CERAS ANIMALES O VEGETALES; SUS ACIDOS GRASOS; DETERGENTES; VELAS. › C11D COMPOSICIONES DETERGENTES; UTILIZACION DE UNA SOLA SUSTANCIA COMO DETERGENTE; JABON O SU FABRICACION; JABONES DE RESINA; RECUPERACION DE LA GLICERINA. › C11D 7/00 Composiciones de detergentes basadas esencialmente en compuestos no tensioactivos. › que contienen oxígeno.
PDF original: ES-2553457_T3.pdf
Patentes similares o relacionadas:
Composición que comprende un extracto y 1,3-propanediol de origen biológico como disolvente no irritante, del 29 de Abril de 2020, de DuPont Tate & Lyle Bio Products Company, LLC: Una composición que comprende 1,3-propanodiol y un producto de extracción, en donde el 1,3-propanodiol se deriva biológicamente, tiene un nivel […]
Composición acuosa que contiene metal oligodinámico, del 29 de Abril de 2020, de UNILEVER NV: Composición acuosa que tiene una viscosidad de desde 1 hasta 100 cP a 20ºC, comprendiendo dicha composición: (i) un metal oligodinámico o iones del mismo; (ii) […]
Detergente lavaobjetos a baja temperatura libre de sustancias cáusticas para reducir la acumulación de incrustaciones, del 4 de Marzo de 2020, de Ecolab USA Inc: Una composición detergente libre de sustancias cáusticas que comprende: de 0,1-15 % en peso de un aminocarboxilato; de 0,1-15 % en peso de un polímero […]
Composición detergente que comprende un derivado catiónico de un polisacárido, del 1 de Enero de 2020, de Coöperatie Koninklijke Cosun U.A: Composicion detergente para lavavajillas automatico que comprende al menos un derivado cationico de un polisacarido, donde dicho derivado cationico de un polisacarido […]
Composiciones tipo azeótropo que comprenden 1-cloro-3,3,3,-trifluoropropeno, del 4 de Diciembre de 2019, de HONEYWELL INTERNATIONAL INC.: El uso de una composición que comprende una mezcla tipo azeótropo binaria que consiste esencialmente en 1- cloro-3,3,3-trifluoropropeno y un alcohol C1-C3 […]
Detergente de lavado de vajilla de baja temperatura exento de fósforo para reducir la acumulación de incrustaciones, del 2 de Octubre de 2019, de Ecolab USA Inc: Una composición de detergente exenta de fósforo que comprende: una cantidad del 2 % al 15 %, en peso, de un aminocarboxilato, en donde el aminocarboxilato es […]
Uso de azúcares en una matriz de estabilización y composiciones sólidas, del 25 de Septiembre de 2019, de Ecolab USA Inc: Una matriz de solidificación que comprende: (a) del 0,1 al 20 % en peso de un azúcar seleccionado del grupo que consiste en un monosacárido, un […]
Agente de limpieza, del 7 de Agosto de 2019, de HENKEL AG & CO. KGAA: Agente de limpieza en particular un agente para el lavado de la vajilla, preferentemente agente para el lavado de la vajilla a máquina previamente […]