IMPLANTES SUBCUTANEOS QUE LIBERAN UN PRINCIPIO ACTIVO DURANTE UN PERIODO DE TIEMPO PROLONGADO.
Implantes subcutáneos obtenidos mediante extrusión, que contienen:
(1) micropartículas que contienen un ingrediente activo dispersado en una matriz de PLGA, encontrándose la totalidad de dichas micropartículas (1) dispersadas en una matriz de PLGA (3) que presenta una temperatura de transición vítrea inferior a la del PLGA contenido en (1)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/057969.
Solicitante: MEDIOLANUM PHARMACEUTICALS LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: 7TH FLOOR, HUME HOUSE BALLSBRIDGE,DUBLIN 4.
Inventor/es: MARION, PIERRE, MAURIAC, PATRICE.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K9/00M5D
- A61K9/16H6D4
- A61K9/16P4
Clasificación PCT:
- A61K9/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
Fragmento de la descripción:
Implantes subcutáneos que liberan un principio activo durante un periodo de tiempo prolongado.
Campo de la invención
La presente invención se refiere a:
Estado de la técnica
La ventaja de utilizar implantes que contienen fármacos de liberación controlada es bien conocida en el estado de la técnica. Muchos ingredientes activos resultan rápidamente metabolizados y eliminados por el organismo humano o de mamífero, resultando necesaria, por lo tanto, la administración frecuente del fármaco con el fin de mantener una concentración terapéutica adecuada.
Un ejemplo de implantes de liberación controlada se encuentra representado por los implantes subcutáneos.
Entre los numerosos implantes ya conocidos, los implantes subcutáneos descritos en la patente WO nº 00/33809 representan una mejora neta en comparación con los implantes subcutáneos anteriores que contienen como principio activo un polipéptido dispersado en una matriz de ácido poliláctico-glicólico en el aspecto de que son capaces de liberar el principio activo anteriormente indicado en 6 meses. Los implantes subcutáneos descritos en dicha patente anterior difieren también en que presentan un perfil de liberación esencialmente trifásico y no bifásico: liberación por difusión pura, liberación por hinchado controlado por difusión y liberación por degradación del polímero.
Por lo tanto, esta progresión permite la prolongación de los tiempos de liberación. De hecho, al introducir estos implantes en un medio acuoso, el agua se difunde a través de la matriz polimérica, alcanzando las partículas peptídicas más próximas a la superficie, y posteriormente a las zonas internas del implante.
El implante sigue sin resultar sustancialmente modificado durante aproximadamente 6 semanas, y durante este periodo libera aproximadamente 30% del péptido.
La duración de esta etapa de difusión pura se encuentra determinada esencialmente por el nivel de heterogeneidad de las dimensiones del péptido, y la tasa se encuentra determinada esencialmente por el contenido de partículas en la matriz de PLGA.
Debido a que el principio activo presenta una diversidad de dimensiones, queda una cantidad suficiente de péptido tras la primera etapa de disolución y puede liberarse en las etapas sucesivas mencionadas, es decir las etapas de liberación por difusión e hinchado, o de liberación por desintegración del polímero.
Dichos implantes, aunque representan una ventaja considerable, adolecen de la desventaja siguiente.
Debido a que se caracterizan porque presentan un perfil de tres liberaciones, sucede que, tras la primera etapa de liberación de fármaco y antes de que se inicie la segunda etapa de liberación, se observa un tiempo de retardo que dura en algunos casos muchos días, durante el cual el fármaco es liberado a nivel reducido o no es liberado en absoluto.
En algunos casos y para algunos protocolos terapéuticos, esta interrupción de la liberación de fármaco debe evitarse y puede resultar necesario un perfil de liberación más lineal.
Por lo tanto, se percibe la necesidad de superar dicha desventaja.
Descripción resumida de la invención
Ahora, el presente solicitante ha encontrado implantes subcutáneos que resuelven los problemas anteriormente indicados.
Dichos implantes para la administración subcutánea, que se obtuvieron mediante extrusión, contenían micropartículas que comprendían ingredientes activos dispersados en PLGA y micropartículas consistentes del mismo ingrediente activo, encontrándose la totalidad de dichas micropartículas dispersadas en una matriz de PLGA, presentando una temperatura de transición vítrea inferior a la del PLGA contenido en las micropartículas anteriormente indicadas.
Un objetivo adicional de la presente invención se refiere a implantes subcutáneos que contienen las micropartículas de PLGA anteriormente indicadas en las que se dispersa el principio activo y opcionalmente micropartículas que consisten de un ingrediente activo diferente, de la misma categoría terapéutica que el contenido en las partículas de PLGA.
De hecho, el solicitante ha encontrado que, mediante la utilización de dichos implantes subcutáneos, que son un objetivo adicional de la presente invención, la cantidad de fármaco liberado a partir de las micropartículas de PLGA es muy similar a la liberada por un implante subcutáneo convencional que contiene dos veces el peso del mismo ingrediente activo.
Además, con los implantes subcutáneos de la invención resulta posible proteger la cantidad de agente activo que se liberará al final del procedimiento de disolución. Durante la etapa inicial de la liberación, se libera principalmente el ingrediente activo que se encuentra dispersado en el PLGA que forma la matriz del implante, mientras que el ingrediente activo contenido en las partículas de PLGA se encuentra más protegido frente al agua y a la acidez del PLGA exterior y se libera más tarde.
Descripción de las figuras
La figura 1 representa una vista esquemática de una sección a lo largo del eje I-I de los implantes subcutáneos según la presente invención.
La figura 2 muestra el perfil de liberación de ingrediente activo (% de la cantidad total liberada en la ordenada frente al tiempo en las abscisas de los implantes subcutáneos 2.1 y 2.2 preparados tal como se ha descrito en el Ejemplo 2).
La figura 3 muestra el perfil de liberación de péptido total (% de la cantidad liberada en la ordenada frente al tiempo en las abscisas de los implantes subcutáneos), la liberación de avorelina y de leuprorelina del implante subcutáneo 2.3 preparado tal como se ha descrito en el Ejemplo 2.
La figura 4 muestra la liberación de avorelina (% de la cantidad total liberada en la ordenada frente al tiempo en las abscisas de los implantes subcutáneos del implante subcutáneo convencional 2.1 en comparación con la liberación de avorelina del implante subcutáneo 2.3 de la invención tal como se preparó en el Ejemplo 2).
La figura 5 muestra la liberación de acetato de medroxi progesterona (MPA) (% de la cantidad liberada en la ordenada frente al tiempo en las abscisas de los implantes subcutáneos) a partir del implante subcutáneo convencional 3.1 y del implante subcutáneo 3.3 de la invención.
La figura 6 muestra el perfil de liberación de acetato de medroxi progesterona (MPA) (% de la cantidad total liberada en la ordenada frente al tiempo en las abscisas de los implantes subcutáneos) del implante subcutáneo convencional 3.1 y del implante subcutáneo 3.4 de la invención.
La fig. 7 muestra el perfil de liberación de citrato de fentanilo (% de la cantidad de fármaco liberada en la ordenada frente al tiempo en las abscisas) a partir de los implantes convencionales 4.1 y de los implantes subcutáneos 4.2.
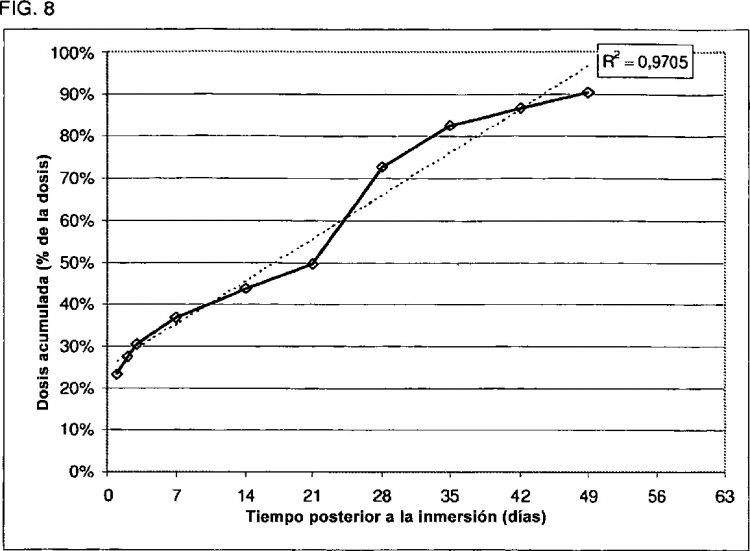
La fig. 8 muestra la liberación de citrato de fentanilo (% de la cantidad de fármaco liberada en la ordenada frente al tiempo en las abscisas) a partir del único implante de la invención 4.2.
Descripción detallada de la invención
Preferentemente, en los implantes subcutáneos de la invención, las micropartículas que contienen el ingrediente activo dispersado en PLGA se obtienen mediante un procedimiento que comprende las etapas siguientes:
Reivindicaciones:
1. Implantes subcutáneos obtenidos mediante extrusión, que contienen: (1) micropartículas que contienen un ingrediente activo dispersado en una matriz de PLGA, encontrándose la totalidad de dichas micropartículas (1) dispersadas en una matriz de PLGA (3) que presenta una temperatura de transición vítrea inferior a la del PLGA contenido en (1).
2. Implantes subcutáneos según la reivindicación 1, en los que las micropartículas: (1) se obtienen mediante molido o esferonización de un PLGA extrusionado que, contiene dispersado en el mismo, dicho ingrediente activo.
3. Implantes subcutáneos según la reivindicación 2, en los que dichas micropartículas (1) se preparan mediante un procedimiento que comprende las etapas siguientes:
4. Implantes subcutáneos según la reivindicación 3, en los que, en la etapa (d), el producto extrusionado se muele hasta obtener micropartículas que presentan un tamaño, determinado mediante tamizado, comprendido en la fracción [50; 250 µm].
5. Implantes subcutáneos según cualquiera de las reivindicaciones 1 a 4, que también contienen, además de las micropartículas (1), las micropartículas (2), que consisten del mismo ingrediente activo contenido en (1), o las micropartículas (2'), que consisten de un ingrediente activo diferente.
6. Implantes subcutáneos según la reivindicación 5, en los que las micropartículas (2') están constituidas de un ingrediente activo de la misma categoría terapéutica que la del ingrediente activo contenido en (1).
7. Implantes subcutáneos según la reivindicación 5 ó 6, en los que el ingrediente activo contenido en (1) y las micropartículas (2) o (2') se seleccionan de entre el grupo que consiste de un péptido, un ingrediente activo capaz de incrementar la densidad ósea, un principio activo analgésico-narcótico, y una hormona esteroidea destinada a tratamientos hormonales durante la menopausia y a la anticoncepción.
8. Implantes subcutáneos según la reivindicación 7, en los que el péptido se selecciona de entre el grupo que consiste de avorelina, triptorelina, goserelina y leuprorelina.
9. Implantes subcutáneos según la reivindicación 7, en los que el ingrediente activo capaz de incrementar la densidad ósea se selecciona de entre: ácidos bisfosfónicos farmacéuticamente aceptables y sales farmacéuticamente aceptables de los mismos, vitamina D o análogos de la misma y hormonas sexuales.
10. Implantes subcutáneos según la reivindicación 9, en los que dichas sales de ácido bifosfónico se seleccionan de entre etidronato disódico, alendronato sódico y pamidronato disódico.
11. Implantes subcutáneos según la reivindicación 9, en los que dichas hormonas sexuales se seleccionan de entre el grupo de los estrógenos y las progestinas androgénicas.
12. Implantes subcutáneos según la reivindicación 11, en los que dichos estrógenos se seleccionan de entre la clase que consiste de estradiol, valerato de estradiol, cipionato de estradiol, estrona, sulfato de estrona o estrógenos de tipo no esteroideo.
13. Implantes subcutáneos según la reivindicación 11, en los que dichas progestinas androgénicas se seleccionan de entre la clase que consiste de noretindrona, noretinodrel, norgestrel, desogestrel y norgestimato.
14. Implantes subcutáneos según la reivindicación 7, en los que el ingrediente activo que presenta actividad narcótica-analgésica se selecciona de entre el grupo que consiste de morfina y morfinanos, y agonistas de receptores µ.
15. Implantes subcutáneos según la reivindicación 14, en los que dichos agonistas de receptor µ son fenilpiperidinas seleccionadas de entre el grupo que consiste de: meperidina, fentanilo y sales farmacéuticamente aceptables relacionadas y congéneres de fentanilo.
16. Implantes subcutáneos según cualquiera de las reivindicaciones 11 a 15, en los que el ingrediente activo contenido en (1) o las micropartículas (2) o (2') presentan una distribución de tamaños de partícula homogénea o heterogénea.
17. Implantes subcutáneos según la reivindicación 16, en los que el ingrediente activo presenta una distribución de tamaños de partícula heterogénea.
18. Implantes subcutáneos según la reivindicación 17, en los que la distribución de tamaños de partícula heterogénea se encuentra comprendida entre 1 y 63 µm o entre 1 y 100 µm.
19. Implantes subcutáneos según cualquiera de las reivindicaciones 1 a 18, en los que el PLGA contenido en (1) presenta un peso molecular medio comprendido entre 50.000 Da y 150.000 Da, y una proporción molar de ácido láctico/ácido glicólico comprendida entre 50/50 y 75/25.
20. Implantes subcutáneos según cualquiera de las reivindicaciones 1 a 19, en los que el PLGA (3) presenta un peso molecular medio comprendido entre 10.000 Da y 40.000 Da, y una proporción molar de ácido láctico/ácido glicólico comprendida entre 50/50 y 60/40.
21. Procedimiento para la preparación del implante subcutáneo según cualquiera de las reivindicaciones 1 a 19, que comprende las etapas siguientes:
Patentes similares o relacionadas:
FORMULACIONES DE LIBERACIÓN PROLONGADA DE ILOPERIDONA Y POLÍMERO EN FORMA DE ESTRELLA, del 10 de Mayo de 2011, de NOVARTIS AG: Una formulación de liberación prolongada que comprende iloperidona y un polímero biodegradable, biocompatible que es un polímero de poli(d,l-lactida-co-glicolida) […]
COMPOSICIONES POLIHIDROXIALCANOATO QUE TIENEN TASAS DE DEGRADACIÓN CONTROLADAS, del 7 de Abril de 2011, de METABOLIX, INC.: Un stent que comprende un copolímero poli(4-hidroxibutirato) o un copolímero poli(butirato-cohidroalcanoato) del mismo, donde el hidroxialcanota […]
 COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE ANASTROZOL, del 10 de Marzo de 2011, de ASTRAZENECA AB: Una formulación de liberación prolongada, que comprende; (i) un polímero de polilactida o copolímero de poli(lactida-co-glicolida) que tiene un peso molecular medio de […]
COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE ANASTROZOL, del 10 de Marzo de 2011, de ASTRAZENECA AB: Una formulación de liberación prolongada, que comprende; (i) un polímero de polilactida o copolímero de poli(lactida-co-glicolida) que tiene un peso molecular medio de […]
 PROCEDIMIENTO PARA LA PREPARACIÓN DE PARTÍCULAS A PARTIR DE UNA EMULSIÓN EN CO2 SUPERCRÍTICO O LÍQUIDO, del 26 de Enero de 2011, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Procedimiento para la preparación de partículas que comprende las etapas que consisten en: i) preparar una emulsión que contiene: - como fase continua, CO2 líquido o supercrítico, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE PARTÍCULAS A PARTIR DE UNA EMULSIÓN EN CO2 SUPERCRÍTICO O LÍQUIDO, del 26 de Enero de 2011, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Procedimiento para la preparación de partículas que comprende las etapas que consisten en: i) preparar una emulsión que contiene: - como fase continua, CO2 líquido o supercrítico, […]
PREPARACION DE LIBERACION SOSTENIDA DE UN COMPUESTO MACROLIDO COMO TACROLIMUS, del 27 de Julio de 2010, de FUJISAWA PHARMACEUTICAL CO., LTD.: Formulación de liberación sostenida de un compuesto macrólido, en la que el tiempo (T63,2%) requerido para que se disuelva el 63,2% de la cantidad máxima […]
MICROPARTICULAS QUE COMPRENDEN ANALOGOS DE SOMATOSTATINA, del 14 de Mayo de 2010, de NOVARTIS AG NOVARTIS PHARMA GMBH: Micropartículas que comprenden ciclo[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] en forma libre, en forma de sal o en forma protegida, embebido en una matriz de […]
 COMPOSICION FARMACEUTICA DE MICROESFERAS PARA PREVENIR LA AMPUTACION DE PIE DIABETICO, del 14 de Diciembre de 2009, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA: Una composición farmacéutica que contiene microesferas cargadas con Factor de Crecimiento Epidérmico para ser administrada por viaparenteral […]
COMPOSICION FARMACEUTICA DE MICROESFERAS PARA PREVENIR LA AMPUTACION DE PIE DIABETICO, del 14 de Diciembre de 2009, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA: Una composición farmacéutica que contiene microesferas cargadas con Factor de Crecimiento Epidérmico para ser administrada por viaparenteral […]
AGENTES PARA EL TRATAMIENTO DE LA RETINOPATÍA GLAUCOMATOSA Y DE LA NEUROPATÍA ÓPTICA, del 30 de Diciembre de 2011, de NOVARTIS AG: Composición para el tratamiento de la retinopatía glaucomatosa o de la neuropatía óptica en un sujeto en la que la composición proporciona una concentración […]