Glicoproteínas mutantes.
Un mutante de FSH, caracterizado porque se ha introducido un sitio de N-glicosilación en la subunidad alfa deFSH mediante la mutación F17T,
en el que el mutante de FSH comprende la secuencia de aminoácidos SEQ IDNO:3.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/033770.
Solicitante: MERCK SERONO SA.
Nacionalidad solicitante: Suiza.
Dirección: CENTRE INDUSTRIEL 1267 COINSINS, VAUD SUIZA.
Inventor/es: JIANG,XULIANG, BRONDYK,WILLIAM,H, CAMPBELL,ROBERT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/24 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona folículo-estimulante [FSH]; Gonadotropinas coriónicas, p. ej.: HCG; Hormona luteinizante [LH]; Hormona estimulante de la tiroides [TSH].
- C07K14/59 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormona estimulante del folículo (FSH); Gonadotropinas coriónicas, p. ej. HCG; Hormona luteinizante (LH); Hormona estimulante del tiroides (TSH).
- C12N15/16 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hormonas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
PDF original: ES-2389835_T3.pdf
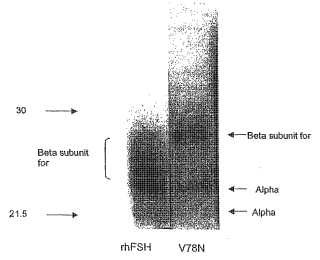
Fragmento de la descripción:
Glicoproteínas mutantes.
Campo de la invención
La invención se refiere al campo de las gonadotropinas, y en particular a su uso en el tratamiento de trastornos 5 reproductivos.
Antecedentes de la invención
Las gonadotropinas son un grupo de glicoproteínas heterodímeras que incluyen hormona estimuladora del folículo (FSH) , hormona luteinizante (LH) y gonadotropina coriónica (CG) . Estas hormonas regulan la función gonadal en el macho y en la hembra. Cada una de estas hormonas está compuesta por dos subunidades unidas de modo
covalente: una subunidad alfa, que es común a FSH, LH y hCG, y una subunidad beta, que es única para cada una de ellas, y que confiere especificidad biológica a cada hormona.
En todas las gonadotropinas, cada subunidad tiene cadenas laterales de oligosacáridos unidas (unidas por N) a asparagina. En la subunidad alfa común de las hormonas humanas, estas están unidas en las posiciones 52 y 78. En ambas FSH y CG humanas, dos cadenas laterales de oligosacáridos unidas por N se unen a la subunidad beta,
en las posiciones 7 y 24 en FSH, y en las posiciones 13 y 30 en hCG. En LH humana, un oligosacárido se une en la posición 30 de la subunidad beta. La hCG tiene adicionalmente cuatro cadenas laterales de oligosacárido unidas (unidas por O) a serina, presente en la porción terminal de carboxilo (CTP) .
Las gonadotropinas desempeñan papeles cruciales en el ciclo reproductivo, y su uso es esencial para las técnicas de reproducción asistida (ART) , tales como fertilización in vitro (IVF) , IVF en conjunción con inyección
intracitoplásmica de esperma (IVF/ICSA) y transferencia de embrión (ET) , así como para inducción de ovulación (OI) en pacientes anovuladoras que se someten a fertilización in vivo ya sea de modo natural o a través de inseminación intrauterina (IUI) .
Típicamente, la ART se lleva a cabo usando hiperestimulación ovárica controlada (COH) para aumentar el número de gametos femeninos. Los regímenes estándar para COH incluyen una fase de regulación a la baja en la que se 25 suprimen las gonadotropinas endógenas mediante administración de una gonadotropina que libera hormona agonista (GnRH) seguida por una fase estimuladora en la que se induce desarrollo folicular (foliculogénesis) mediante administración diaria de FSH, habitualmente 150-225 UI/día aproximadamente. Como alternativa, se inicia la estimulación después de la menstruación espontánea o inducida al tiempo que se previene que ocurra un incremento repentino de LH por enfermedad planificada mediante administración de un antagonista de GnRH (que
se inicia típicamente alrededor del sexto día de la fase estimuladora) . Cuando hay al menos 3 folículos >16 mm (uno de 18 mm) , se administra un bolus único de hCG (5-10.000 UI) para imitar el incremento repentino natural de LH e inducir la ovulación. La recuperación de oocito se planifica para 36-38 horas después de la inyección de hCG.
Típicamente, la OI se lleva a cabo con administración diaria de FSH a una dosis de aproximadamente 75-150 UI/día. Se puede usar regulación a la baja con agonistas de GnRH o antagonistas, aunque menos frecuentemente que en la
indicación de ART. Se administra hCG para imitar el incremento repentino de LH previo a la fertilización in vivo que se consigue bien por relación sexual natural o por IUI.
Los regímenes típicos anteriormente descritos para ART y OI requieren inyecciones diarias de gonadotropinas durante un período prolongado, esto es durante una media de 10 días, y hasta 21 días en algunas pacientes. El desarrollo de preparaciones de FSH de mayor eficacia permitiría que la dosis diaria de FSH se disminuyera, y/o
permitiría el acortamiento del período de tratamiento (esto es menos inyecciones) , y/o permitiría que las inyecciones se administraran menos frecuentemente. Esto haría que los regímenes de ART y OI fueran más cómodos y llevaderos para la paciente.
Además, la ART que usa fertilización in vitro está plagada de posibles contratiempos. Por ejemplo, no todos los folículos producirán oocito viable, no todos los oocitos viables se fertilizarán con éxito, y algunos embriones puede
45 que no sean viables. Aun más, una vez que se seleccionan embriones viables, puede que la transferencia al útero y la implantación no tengan éxito. A fin de maximizar las oportunidades de un nacimiento vivo es por tanto deseable estimular el crecimiento y la maduración de varios folículos, para garantizar la recogida de múltiples oocitos.
En contraposición, en la indicación de OI el objetivo es obtener no más de tres y preferiblemente un folículo dominante (para evitar embarazos múltiples) .
50 Algunas pacientes que se someten a ART y OI presentan un número reducido de folículos que crecen cuando se tratan con preparaciones de FSH convencionales. Esto es un factor limitante del éxito al someterse a ART, porque limita el número de embriones disponibles para la transferencia y/o la crioconservación. También puede ser un factor limitante del éxito en pacientes que se someten a IUI, en la que es importante obtener más de un folículo. Pacientes que presentan este tipo de respuesta incluyen pacientes por encima de aproximadamente 33-35 años de edad,
55 pacientes con elevada línea de base de FSH, elevada línea de base de estradiol o reducida línea de base de
inhibina b.
En el macho, la espermatogénesis depende de la estimulación de las células de Sertoli por la FSH. La deficiencia de FSH da como resultado la oligospermia, y por tanto la infertilidad. El tratamiento de la infertilidad del macho con preparaciones convencionales de FSH requiere inyecciones de FSH tres veces a la semana durante hasta 18 meses.
En el documento WO 01/58493 (Maxygen) se describen moléculas de FSH modificadas, que tienen sitios de glicosilación adicionales. Se prueba un ejemplo de moléculas de FSH modificadas y se informa que tienen bioactividad reducida y un período de semidescomposición in vivo aumentado. El documento WO 01/58493 describe una variante de FSH con una mutación F17N en la subunidad alfa. Esta mutación introduce un tripéptido de consenso Asn17-Phe18-Ser19, en el que Asn17 está glicosilada.
El desarrollo de preparaciones de FSH con capacidad potenciada para estimular foliculogénesis, es una necesidad permanente. También existe necesidad de nuevas preparaciones de FSH para tratar a pacientes con baja respuesta a FSH. También son deseables preparaciones de FSH de período de semidescomposición más largo, que permitan protocolos más cortos de tratamiento y/o dosis acumulativas menores y/o dosificación menos frecuente, para ART, OI e infertilidad masculina.
Resumen de la invención:
Los inventores han diseñado nuevos mutantes de FSH con glicosilación aumentada y más largos períodos de semidescomposición para uso en tratamiento de trastornos reproductivos en pacientes humanos. El uso de una preparación mutante de FSH de la invención permite el uso de dosis acumulativas más bajas de FSH para conseguir un resultado clínico igual o mejor.
Por consiguiente, la invención proporciona una FSH mutante que muestra actividad de FSH, teniendo la FSH mutante al menos un sitio de glicosilación adicional, en comparación con FSH de tipo nativo, sitio de glicosilación que tiene un glicano. La invención proporciona además moléculas de ácido nucleico que codifican la FSH mutante. También se incluye en la invención un vector que contiene alguno de los ácidos nucleicos de la presente invención.
La presente invención también se dirige a células hospedadoras recombinantes que expresan una FSH mutante de la invención, en particular una célula hospedadora transformada con un vector que comprende una molécula de ácido nucleico de FSH que codifica la FSH mutante. En un aspecto adicional, la invención proporciona una composición que incluye una FSH mutante y un vehículo o excipiente farmacéuticamente aceptable.
Todavía más, la invención proporciona un procedimiento para producir una FSH mutante. El procedimiento incluye proporcionar una célula que contiene un ácido nucleico de FSH mutante, por ejemplo, un vector que incluye un ácido nucleico de mutante de FSH, y cultivar la célula en condiciones suficientes para que exprese el mutante de FSH.... [Seguir leyendo]
Reivindicaciones:
1. Un mutante de FSH, caracterizado porque se ha introducido un sitio de N-glicosilación en la subunidad alfa de FSH mediante la mutación F17T, en el que el mutante de FSH comprende la secuencia de aminoácidos SEQ ID NO:3.
2. Una composición que comprende un mutante de FSH según la reivindicación 1 y al menos un vehículo o excipiente farmacéuticamente aceptable.
3. El uso de un mutante de FSH según la reivindicación 1 para la fabricación de una medicina para tratamiento de la infertilidad de un mamífero estimulando la foliculogénesis, o induciendo hiperestimulación ovárica.
4. Un mutante de FSH según la reivindicación 1 para uso en el tratamiento de la infertilidad de un mamífero 10 estimulando la foliculogénesis, o induciendo hiperestimulación ovárica.
5. Una secuencia de nucleótidos que codifica un mutante de FSH de la reivindicación 1.
6. Un vector de expresión que comprende una secuencia de nucleótidos según la reivindicación 5.
7. Una célula hospedadora que comprende un vector según la reivindicación 6.
8. Una célula hospedadora de la reivindicación 7 que es eucariota.
9. Una célula hospedadora de la reivindicación 7 que es de mamífero.
10. Un procedimiento para producir un mutante de FSH, que comprende someter a una célula hospedadora según cualquiera de las reivindicaciones 7 a 9 a cultivo en condiciones que conducen a la expresión de dichos mutantes.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]