GLICOPEPTIDOS INMUNOGENOS, CRIBADO, PREPARACION Y APLICACIONES.
Glicopéptido inmunógeno de 15 a 39 aminoácidos procedentes de M.
tuberculosis, con excepción del glicopéptido de secuencia SEQ ID NO:1, dicho glicopéptido comprende un epítope T glicosilado de 14 a 25 aminoácidos, entre los cuales al menos un aminoácido neutro está unido a una di- o a una trimannosa y al menos el 15% de entre dichos aminoácidos son prolinas, estando una de las prolinas situada en posición -1 a -4, respecto de la posición de dicho aminoácido neutro, y dicho glicopéptido es:
- presentado mediante una molécula de clase II del CMH,
- reconocido específicamente por linfocitos T CD4+ inducidos por inmunización con la glicoproteína nativa de la cual procede, pero no es reconocido por los linfocitos T CD4+ inducidos por inmunización con un péptido no glicosilado de igual secuencia y
- capaz de inducir una proliferación de dichos linfocitos T CD4+ por los cuales es reconocido y la secreción de citoquinas por dichos linfocitos
Tipo: Resumen de patente/invención. Número de Solicitud: W0104100FR.
Solicitante: INSTITUT PASTEUR.
Nacionalidad solicitante: Francia.
Dirección: 28 RUE DU DOCTEUR ROUX,F-75724 PARIS.
Inventor/es: MARCHAL, GILLES, PESCHER, PASCALE, ROMAIN, FELIX.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/35 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Mycobacteriaceae (F).
- C07K9/00 C07K […] › Péptidos de hasta 20 aminoácidos, que contienen radicales sacáridos y una secuencia totalmente determinada; Sus derivados.
Clasificación PCT:
- A61K39/04 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- C07H5/02 C07 […] › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 5/00 Compuestos que contienen radicales sacárido en los que heteroenlaces al oxígeno han sido reemplazados por el mismo número de heteroenlaces a halógeno, nitrógeno, azufre, selenio o teluro. › a halógeno.
- C07K14/35 C07K 14/00 […] › de Mycobacteriaceae (F).
- C07K9/00 C07K […] › Péptidos de hasta 20 aminoácidos, que contienen radicales sacáridos y una secuencia totalmente determinada; Sus derivados.
Clasificación antigua:
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- C07H5/02 C07H 5/00 […] › a halógeno.
- C07K14/35 C07K 14/00 […] › de Mycobacteriaceae (F).
- C07K9/00 C07K […] › Péptidos de hasta 20 aminoácidos, que contienen radicales sacáridos y una secuencia totalmente determinada; Sus derivados.
Fragmento de la descripción:
Glicopéptidos inmunógenos, cribado, preparación y aplicaciones.
La presente invención se refiere a glicopéptidos inmunógenos procedentes de Mycobacterium tuberculosis (M. tuberculosis) útiles para la vacunación y el diagnóstico de infecciones debidas a este microorganismo patógeno, así como a sus procedimientos de selección y de preparación.
La infección por M. tuberculosis es una de las infecciones más graves en medicina humana. En efecto, del 5 al 10% de las personas infectadas por M. tuberculosis que tienen una respuesta inmunitaria normal desarrollan una enfermedad grave (tuberculosis); esta frecuencia es aun más elevada en las personas que tienen un déficit de su respuesta inmunitaria (infección por el VIH, tratamiento por inmunodepresores, etc...)
Los medios aplicados para prevenir y tratar esta infección comprenden por una parte la identificación que permite el seguimiento y el tratamiento de la infección y por otra parte la vacunación.
Diagnóstico
Entre las diferentes técnicas actualmente disponibles, se pueden citar:
- - la obtención de cultivos puros de M. tuberculosis, que es el medio más riguroso para realizar el diagnóstico de certitud de la tuberculosis. Es una técnica medianamente sensible que permite el diagnóstico para las 2/3 de los casos de tuberculosis pulmonar. Los resultados no están disponibles más que después de un plazo mínimo de 3-4 semanas, a veces solamente después de 2 meses de cultivo. El uso de técnicas de cultivo que emplean precursores marcados permite acortar estos plazos que siguen siendo sin embargo importantes. Esta puesta en evidencia de M. tuberculosis por cultivo necesita una toma de muestra que contiene bacilos, a veces difícil de obtener incluso para la tuberculosis pulmonar donde aproximadamente el 1/3 no recibe confirmación biológica. A veces este examen necesita una intervención médica especializada (punción lumbar del líquido cefalorraquídeo o biopsia ganglionar) para formas extrapulmonares de la enfermedad.
- - las técnicas microbiológicas basadas en la genética molecular (PCR) se enfrentan a la misma necesidad de obtener una toma de muestra que contiene bacterias. Por otra parte, debido al hecho de la presencia en la toma de muestra de inhibidores de la reacción PCR cuyo origen es imposible controlar, estas técnicas a veces no se pueden utilizar. Su validación en la práctica corriente no se ha obtenido.
- - Actualmente no existe serodiagnóstico que posea una sensibilidad y una especificidad compatibles con un uso diagnóstico.
- - la reacción a la tuberculina muestra que un sujeto se ha sensibilizado, se ha infectado por M. tuberculosis o se ha vacunado por BCG. La tuberculina es en efecto una mezcla de antígenos de M. tuberculosis y por lo tanto es incapaz de realizar el diagnóstico entre una infección por M. tuberculosis y la vacunación por el BCG debido a reacciones cruzadas muy numerosas entre los antígenos de la vacuna y M. tuberculosis. Por otra parte, esta reacción a la tuberculina no permite distinguir una tuberculosis, enfermedad activa, de una infección por M. tuberculosis.
Vacuna
La vacunación por el BCG permite controlar la infección primaria (multiplicación inicial de M. tuberculosis) pero sobre todo la diseminación secundaria de estos bacilos. Contribuye verdaderamente a reducir la incidencia de las infecciones latentes contra las cuales ningún tratamiento eficaz está actualmente disponible. El BCG se ha utilizado para vacunar más de tres mil millones de individuos contra la tuberculosis, sin efectos secundarios particulares. Con ocasión de la vacunación por el BCG hay una multiplicación local de estos bacilos de virulencia atenuada. Se induce una inmunidad celular. Se traduce por una hipersensibilidad de tipo retardada (HSR) dirigida contra las proteínas, antígenos, de micobaterias, es la reacción a la tuberculina, y por una mayor resistencia a la infección por M. tuberculosis. Estas dos respuestas inmunitarias (sensibilización de tipo HSR y mayor resistencia) tienen como soportes linfocitos T que reaccionan con antígenos de micobacterias.
El BCG protege bien contra las formas agudas de la infección (meningitis tuberculosa del niño, por ejemplo). Su eficacia es más variable en los adultos). La existencia de una reactividad cruzada entre el BCG y otras micobacterias no pertenece al complejo tuberculosis así como la ausencia, en el genoma de BCG, de algunos antígenos inmunógenos de Mycobacterium tuberculosis o un perfil de expresión diferente de estos antígenos en el transcurso de la infección podría explicar la eficacia variable del BCG.
Además, el BCG es una cepa viva de virulencia atenuada. Posee por lo tanto un poder patógeno residual que prohíbe el uso en los individuos inmunodeprimidos, especialmente en los sujetos reconocidos por estar infectados por el virus de inmunodeficiencia humana (VIH).
Para combatir más eficazmente esta infección, sería juicioso disponer de herramientas diagnósticas y de vacunas, especialmente de una vacuna "subunidad", y por lo tanto sin riesgo, a base de antígenos protectores del microorganismo patógeno responsable de esta infección.
Se han hecho en este sentido un cierto número de estudios para encontrar la o las moléculas de este microorganismo patógeno, susceptible(s) de inducir una fuerte respuestas inmunitaria protectora. De este modo, J. Hess et al. (C.R. Acad. Sci. Paris, 1999, 322: 953-958) se han centrado en las propiedades que deberían tener antígenos aptos para ser utilizados como vacuna contra la tuberculosis. En esta revista, subrayan la importancia de usar una combinación de antígenos previamente seleccionados en vez de un único antígeno. Recomiendan especialmente seleccionar estos antígenos sobre la base de criterios tales como la presencia de zonas altamente conservadas entre las diferentes cepas, las diferencias en el perfil de expresión de los genes de zonas altamente conservadas entre las diferentes cepas, las diferencias en el perfil de expresiones de los genes de las cepas virulentas y de las cepas atenuadas, la reactividad respecto de las células efectoras de la respuesta inmunitaria (linfocitos B, T, CD4+, T, CD8+), la capacidad de estos antígenos a ligarse a una mayoría de las moléculas HLA del complejo mayor de histocompatibilidad (CMH).
Algunos de estos antígenos están presentes en forma de antígenos secretados: MPT59 (30kDa), 85A (32 kDa), MPT64 (23 kDa), hsp71 (71 kfa), MPT51 (24 kDa), MPT63 (16kDa) y ESAT-6 (6 kDa). (Andersen, Infect. Immun, 1994, 62, 2536-2544; Horwitz et al., PNAS, 1995, 92, 1530-1534). Estos antígenos de M. tuberculosis ya se han propuesto como potenciales candidatos de una composición de vacuna ya que son reconocidos preferentemente por linfocitos T CD4+ (Andersen, et al. anteriormente citada; Hortwitz et al. anteriormente citado).
Igualmente se ha propuesto aislar, a partir de los antígenos de M. tuberculosis, péptidos que contienen epítopes capaces de ser presentados por una molécula de clase II del CMH y de ser reconocidos por los linfocitos T CD4+ específicos; tales epítopes han sido sin embargo reseñados para dos proteínas: ESAT-6 (Olsen et al., Eur. j. Immunol., 2000, 30, 1724-1732) y MPT-39 (Mustafa et al., Inf. Immunol., 2000, 68, 2933-3940).
Se han hecho diversas observaciones por los Inventores (Romains et al., Inf Immun. 1993, 61 742-750; Romain et al., Proc. Natl. Acad. Sci. EE.UU. 1993, 90: 5322-5326):
- - solo las bacterias vivas son susceptibles de inducir una inmunidad protectora, induciendo también las bacterias matadas una respuesta inmunitaria, pero sin protección;
- - existe en el medio de cultivo proteínas liberadas por bacterias en el transcurso de su crecimiento y susceptibles de ser reconocidas por el sistema inmunitario de animales vacunados con bacterias vivas, proteínas que no son lo si o son son muy poco reconocidas después de la inmunización por bacterias matadas.
Gracias a este doble criterio, se han purificado dos proteínas nuevas. Una proteína secretada por M. tuberculosis, denominada Apa, o MPT-32 o complejo antigénico de 45/47 kDa, es el producto del gen Rv 1860 (Laqueryrie et al. Infect. Immun. 1995, 63: 4003-4010). La segunda molécula es un péptido interno de una serina...
Reivindicaciones:
1. Glicopéptido inmunógeno de 15 a 39 aminoácidos procedentes de M. tuberculosis, con excepción del glicopéptido de secuencia SEQ ID NO:1, dicho glicopéptido comprende un epítope T glicosilado de 14 a 25 aminoácidos, entre los cuales al menos un aminoácido neutro está unido a una di- o a una trimannosa y al menos el 15% de entre dichos aminoácidos son prolinas, estando una de las prolinas situada en posición -1 a -4, respecto de la posición de dicho aminoácido neutro, y dicho glicopéptido es:
- - presentado mediante una molécula de clase II del CMH,
- - reconocido específicamente por linfocitos T CD4+ inducidos por inmunización con la glicoproteína nativa de la cual procede, pero no es reconocido por los linfocitos T CD4+ inducidos por inmunización con un péptido no glicosilado de igual secuencia y
- - capaz de inducir una proliferación de dichos linfocitos T CD4+ por los cuales es reconocido y la secreción de citoquinas por dichos linfocitos.
2. Glicopéptido inmunógeno según la reivindicación 1, caracterizado porque dicho aminoácido neutro se selecciona en el grupo constituido por la serina y la treonina.
3. Glicopéptido inmunógeno según la reivindicación 1 o la reivindicación 2, caracterizado porque contiene de 1 a 7 residuos treonina, ligados a una di- o una trimannosa.
4. Glicopéptido inmunógeno según cualquiera de las reivindicaciones 1 a 3, caracterizado porque la di- o trimanosa comprende un enlace a-(1,2).
5. Glicopéptido inmunógeno según cualquiera de las reivindicaciones 1 a 4, caracterizado porque procede de la proteína Apa o de la proteína Rv1796.
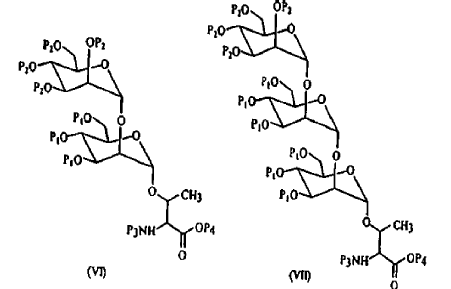
6. Glicopéptido inmunógeno según cualquiera de las reivindicaciones 1 a 5, caracterizado porque se selecciona en el grupo constituido por
- - un glicopéptido de 39 aminoácidos cuya secuencia (SEQ ID NO:1) es la que se extiende de las posiciones 1 a 39 de la secuencia de la proteína Apa y en la cual al menos uno de los residuos treonina en posición 10, 18 y 27 de la SEQ I NO:1 está ligado a una di- o trimannosa por un enlace glicosídico,
- - un glicopéptido de 26 aminoácidos cuya secuencia (SEQ ID NO:2) es la que se extiende de las posiciones 261 a 2869 de la secuencia de la proteína Apa (secuencia C-terminal) y en la cual al menos el residuo treonina en posición 17 de la SEQ I NO:2 está ligado a una di- o trimannosa por un enlace glicosídico, y
- - un glicopéptido de 35 aminoácidos cuya secuencia (SEQ ID NO:3) es la que se extiende de las posiciones 169 a 203 de la secuencia de la proteína Rv 1796 y en la cual al menos uno de los residuos treonina en posición 4, 5, 7, 13, 15, 23 y 25 de la SEQ I NO:3 está ligado a una di- o trimannosa por un enlace glicosídico.
7. Glicopéptido inmunógeno procedente de M. tuberculosis, caracterizado porque está constituido por el epítope T glicosilado de 14 a 25 aminoácidos tal como se define en cualquiera de las reivindicaciones 1 a 5.
8. Procedimiento de síntesis de un glicopéptido según cualquiera de las reivindicaciones 1 a 7, caracterizado porque comprende las siguientes etapas:
- - preparación, en solución, de aminoácidos neutros glicosilados, unidos a una di- o a una trimannosa por un enlace glicosídico,
- - síntesis, sobre soporte sólido, del gligopéptido procedente de una glicoproteína de M. tuberculosis con la ayuda de los aminoácidos necesarios para la obtención de la secuencia peptídica de dicho glicopéptido y de los aminoácidos neutros glicosilados, obtenidos anteriormente, y
- - corte del glicopéptido del soporte sólido.
9. Procedimiento según la reivindicación 8, caracterizado porque dicho aminoácido neutro se selecciona en el grupo constituido por la serina y la treorina.
10. Procedimiento según la reivindicación 9, caracterizado porque dichos glicopéptidos presentan las siguientes secuencias (T representa una treorina O-glicosilada, funcionalizada por 2 o 3 residuos mannosa y Ac representa una función acetato):
SEQ ID NO:1:
H2N-DPEPAPPVPTTAASPPSTAAAPPAPATPVAPPPPAAANT-CONH2
SEQ ID NO:2:
AcNH-PAPAPAPAGEVAPTPTTPTPQRTLPA-COOH
SEQ ID NO:3:
AcNH-TIPTTETPPPPQTVTLSPVPPQTVTVIPAPPPEEG-CONH2,
dicho procedimiento comprende las siguientes etapas:
11. Procedimiento según la reivindicación 10, caracterizado porque las treoninas funcionalizadas por residuos mannosa se preparan por las siguientes etapas:.
- a2) preparación de derivados de mannosa de fórmulas (I) y (II):
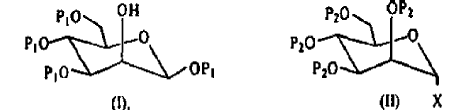
- b2) reacción del derivado de fórmula (I) con el derivado de fórmula (II), y a continuación activación del compuesto obtenido, que conduce a la obtención de un derivado activado que comprende dos residuos mannosa y que responde a la fórmula (III):
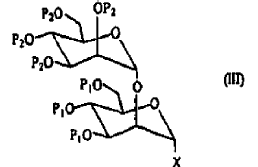
- c2) eventualmente, reacción del compuesto de fórmula (III) con un derivado de mannosa de fórmula (I) tal como se define en a2), y a continuación activación del compuesto obtenido, que conduce a la obtención de un derivado activado que comprende tres residuos mannosa y que responde a la fórmula (IV):
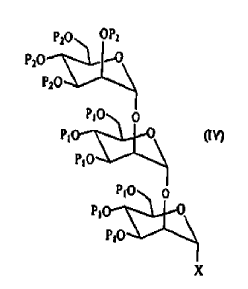
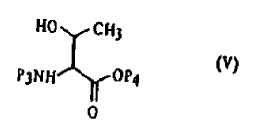
- d2) condensación del compuesto de fórmula (III) o del compuesto de fórmula (IV) con una treonina convenientemente protegida de fórmula (V):
12. Procedimiento de selección y de cribado de glicopéptidos inmunógenos a partir de la secuencia peptídica de glicoproteínas de M. tuberculosis, caracterizado porque comprende al menos las siguientes etapas:
- a3) búsqueda y selección en la secuencia peptídica de dichas glicoproteínas de al menos una secuencia de 14 a 25 aminoácidos, que contiene al menos un aminoácido neutro unido a una di- o una trimannosa y al menos el 15% de prolina, estando una de las prolinas situada en posición -1 a -4, respecto de la posición de dicho aminoácido;
- b3) preparación del/de los glicopéptido(s) seleccionado(s) en la etapa a3) según el procedimiento de las reivindicaciones 8 a 11, y
- c3) selección de los glicopéptidos cuya actividad antigénica es al menos 10 veces superior, preferiblemente al menos 30 veces superior a la de un péptido testigo de igual secuencia.
13. Procedimiento según la reivindicación 12, caracterizado porque previamente a la etapa a3), comprende una etapa de preselección de al menos una glicoproteína antigénica.
14. Procedimiento según la reivindicación 12, caracterizado porque dicho aminoácido neutro se selecciona en el grupo constituido por la serina y la treonina.
15. Procedimiento según la reivindicación 12, caracterizado porque en la etapa c3), la actividad antigénica de dicho glicopéptido se evalúa por medición de la actividad de los linfocitos T CD4+ de animales inmunizados por Mycobacterium bovis BCG o por una fracción antigénica de M. tuberculosis.
16. Glicopéptido tal como se define en cualquiera de las reivindicaciones 1 a 7, caracterizado porque es susceptible de obtenerse por el procedimiento de selección y de cribado según cualquiera de las reivindicaciones 12 a 15 o el procedimiento de síntesis según cualquiera de las reivindicaciones 8 a 11.
17. Composición inmunógena apta para inducir una inmunidad humoral y/o celular, caracterizada porque comprende al menos un glicopéptido según cualquiera de las reivindicaciones 1 a 7 o 16 o un glicopéptido de secuencia SEQ ID NO:11, asociado a al menos un vehículo farmacéuticamente aceptable.
18. Composición de vacuna apta para inducir una inmunidad humoral y/o celular, caracterizada porque comprende al menos un glicopéptido según cualquiera de las reivindicaciones 1 a 7 o 16 o un glicopéptido de secuencia SEQ ID NO:11, asociado a al menos un vehículo farmacéuticamente aceptable y eventualmente a al menos un coadyuvante
19. Composición inmunógena o de vacuna según la reivindicación 17 o la reivindicación 18, caracterizada porque dicho glicopéptido se asocia a una proteína o un fragmento de proteína que comprende al menos un epítope B, un epítope T de tipo CD4+ o un epítope T de tipo CD8+.
20. Anticuerpo, caracterizado porque se dirige específicamente contra uno o varios de los glicopéptidos según cualquiera de las reivindicaciones 1 a 7 o 16.
21. Reactivo de diagnóstico, caracterizado porque comprende un glicopéptido según cualquiera de las reivindicaciones 1 a 7 o 16, un glicopéptido de secuencia SEQ ID NO:11 o un anticuerpo según la reivindicación.
22. Procedimiento de detección de la tuberculosis, caracterizado porque comprende la puesta en contacto de una muestra biológica de un paciente susceptible de estar por de Mycobacterium tuberculosis, con un reactivo de diagnóstico, según la reivindicación 21 y la detección de la formación de un complejo anticuerpos-microorganismo presente en la muestra biológica o glicopéptido(s)-anticuerpos presentes en la muestra.
23. Procedimiento de detección de la tuberculosis, caracterizado porque comprende la detección, in vitro, de linfocitos T CD4+ que reconocen un glicopéptido según cualquiera de las reivindicaciones 1 a 7 o 16, por cualquier técnica apropiada.
24. Procedimiento según la reivindicación 23, caracterizado porque dicha técnica de detección se selecciona en el grupo constituido por los ensayos de proliferación de linfocitos T y de dosificaciones inmunoenzimáticas de citoquinas específicas de linfocitos T CD4+.
Patentes similares o relacionadas:
Nanoporos MSP y procedimientos relacionados, del 8 de Enero de 2020, de UNIVERSITY OF WASHINGTON: Porina de Mycobacterium Smegmatis (Msp) que tiene un vestíbulo y una zona de constricción que definen un túnel, en la que la Msp comprende una MspA mutante, […]
Péptidos novedosos, del 27 de Noviembre de 2019, de Immune Regulation Limited: Una molécula de péptido aislado o recombinante que consiste en una secuencia de aminoácido seleccionada del grupo: (i) DGSVVVNKVSELPAGH; (ii) GLNVNTLSYGDLAAD; […]
Composiciones y métodos para inmunoterapia, del 12 de Junio de 2019, de Memorial Sloan Kettering Cancer Center: Célula inmunosensible que comprende: (a) un receptor de antígeno quimérico (CAR) que se une a un primer antígeno y que tras su unión a dicho […]
Procedimiento novedoso y composiciones, del 12 de Junio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Uno o más primeros polipéptidos inmunógenos para su uso en un procedimiento de generación de una respuesta inmunológica frente a Mycobacterium spp., en los […]
Vacuna TB contra la tuberculosis para impedir la reactivación, del 28 de Mayo de 2019, de STATENS SERUM INSTITUT: Vacuna para la utilización en el bloqueo de la reactivación de la tuberculosis en individuos con infección latente por M. tuberculosis, que comprende […]
Proteína Rv2386c de la tuberculosis, composiciones y usos de las mismas, del 9 de Octubre de 2018, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Un polipéptido aislado que comprende: (i) una secuencia proteica de Rv2386c; (ii) una variante de una secuencia proteica de Rv2386c que tiene al menos el 90% de identidad […]
Péptidos y lipopéptidos antigénicos sintéticos derivados de mycobacterium avium subsp. paratuberculosis, del 21 de Marzo de 2018, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE: El uso de un péptido sintético 5P que tiene la siguiente fórmula: DPhe-NMeVal-Ile-Phe-Ala-OMe (SEC ID Nº: 1), en donde DPhe designa D-fenilalanina, […]
Prevención y tratamiento de la infección por Mycobacterium, del 4 de Octubre de 2017, de THE UNIVERSITY OF SYDNEY: Una proteína recombinante o sintética que incluye: - una primera región que tiene una secuencia codificada por un gen que codifica un […]