GAMMA-BUTIROBETAÍNA HIDROXILASA ORIGINADA A PARTIR DE NEUROSPORA CRASSA.
Uso de un transformante que comprende un vector recombinante que comprende un gen que se selecciona del grupo que consiste en un polinucleótido representado por SEQ ID NO 1 y un polinucleótido que codifica para gamma-butirobetaína hidroxilasa representado por SEQ ID NO 2,
para preparar L-carnitina, que comprende la hidroxilación de la gamma-butirobetaína
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2005/000532.
Solicitante: CJ CHEILJEDANG CORPORATION.
Nacionalidad solicitante: República de Corea.
Dirección: 500 NAMDAEMUNRO 5-GA JUNG-GU, SEOUL 100-749 REPUBLICA DE COREA.
Inventor/es: KANG, WHAN KOO, CHUNG,SUNG-OH, LEE,Bheong-Uk, JU,Jae Yeong, KOH,Eun Sung, PARK,Sung-Sik, PAKR,Young Hoon.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Febrero de 2005.
Clasificación Internacional de Patentes:
- C12N9/02L
- C12P13/00A
Clasificación PCT:
- C12N1/21 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/53 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Oxidorreductasas (1).
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N9/02 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Oxidorreductasas (1.), p. ej. luciferasa.
- C12P13/00 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de compuestos orgánicos que contienen nitrógeno.
Clasificación antigua:
- C12N15/54 C12N 15/00 […] › Transferasas (2).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2362488_T3.pdf
Fragmento de la descripción:
Campo técnico
La presente invención se refiere al uso de un transformante que comprende un vector recombinante que comprende un polinucleótido, que codifica para -butirobetaína hidroxilasa, para preparar L-carnitina mediante la hidroxilación de -butirobetaína usando la -butirobetaína hidroxilasa codificada por el polinucleótido.
Antecedentes de la técnica
La L-carnitina (3-hidroxi-4-trimetilamino-butirato), que también se conoce como vitamina BT, es un análogo de vitamina natural que es muy importante en el metabolismo humano. Se aisló originalmente L-carnitina de tejido muscular bovino en 1905 por dos científicos rusos, Gulewitsch y Krimberg, y su estructura química se identificó en 1932. La L-carnitina se encuentra en casi todas las células del organismo y transporta ácidos grasos de cadena larga libres y activados a través de la membrana interna de la mitocondria. Debido a que la membrana mitocondrial interna es una barrera impenetrable para los ésteres de acil-CoA, los ácidos grasos de cadena larga libres, activados con ésteres de acil-CoA en el citoplasma, pasan a través de la membrana cuando se esterifican con L-carnitina. Cuando está presente L-carnitina en niveles bajos en los músculos esqueléticos, hígado, corazón y riñones, los ácidos grasos de cadena larga libres son difíciles de utilizar como fuente de energía. Este metabolismo anómalo de la carnitina provoca diversas enfermedades, incluyendo retraso del crecimiento, miocardiopatía y debilidad muscular. Cuando no se sintetiza L-carnitina en cantidades adecuadas en el organismo, la carnitina debe absorberse de los alimentos para evitar síntomas de deficiencia de carnitina. Especialmente en lactantes que no pueden biosintesizar L-carnitina, la L-carnitina es un nutriente esencial.
La L-carnitina se usa como componente activo en preparaciones farmacéuticas. Se requiere complementación exógena de L-carnitina para tratar la deficiencia de carnitina y otras enfermedades, especialmente enfermedades cardíacas. Recientemente, este uso terapéutico de la L-carnitina se ha hecho cada vez más importante (R. A. Frenkel y J. D. Mc Garry, “Carnitine biosyntheis, metabolism and functions”, Academic Press, 1980).
Se ha identificado que la L-carnitina desempeña muchos papeles importantes en el organismo. Sin embargo, los métodos convencionales incluyendo la extracción biológica no son adecuados para la producción en masa de L-carnitina. Un método que puede facilitar la obtención de L-carnitina es utilizar DL-carnitina incluyendo isómeros ópticos. Este método provoca efectos secundarios en el organismo debido a que contiene D-carnitina (Curr. Ther. Res. 28, 195-198, 1980). En muchos casos, la D-carnitina compite con la L-carnitina en el organismo e interrumpe la beta-oxidación mitocondrial de ácidos grasos de cadena larga libres. En pacientes que tienen una función renal notablemente reducida, este metabolismo alterado de ácidos grasos de cadena larga conduce a una inhibición más grave.
Se han realizado muchos esfuerzos para obtener L-carnitina ópticamente pura, que incluyen un método químico de resolución óptica (patente estadounidense n.o 5.166.426), un método biológico que usa microorganismos
o enzimas (patente estadounidense n.o 5.187.093) y un método de producción de L-carnitina usando un compuesto quiral como compuesto de partida (patente estadounidense n.o 6.420.599 B2).
Entre los diversos métodos para obtener L-carnitina, un método biológico que usa microorganismos o enzimas emplea una enzima biológica, gamma-butirobetaína hidroxilasa, para producir L-carnitina ópticamente activa. Se aisló esta enzima en ratones y seres humanos (Rebouche y Engel, J Biol Chem 255:8700-8705, 1980), y se identificó su secuencia de nucleótidos. Los organismos superiores incluyendo los mamíferos utilizan un residuo de aminoácido de proteínas, lisina, como precursor para la biosíntesis de L-carnitina, mientras que Neurospora crassa produce L-carnitina ópticamente pura a partir de lisina libre (Fraenkel, Biol Bull, 104:359-371, 1953). El mecanismo de la biosíntesis de L-carnitina es en resumen tal como sigue. La síntesis de carnitina comienza con la metilación de la lisina mediante S-adenosilmetionina que actúa como donador de metilo, dando como resultado la formación de -N-trimetil-lisina. La trimetil-lisina se transforma enzimáticamente en -hidroxi-trimetil-lisina. A partir de la -hidroxi-trimetil-lisina sintetizada, se forma el trimetilaminobutilaldehído, y se convierte entonces en butirobetaína.
Galagan et al. enseñan la secuencia completa del genoma de Neurospora crassa incluyendo una secuencia que codifica para una proteína no caracterizada supuesta, que tiene una secuencia representada por SEQ ID NO.2. Sin embargo, no se enseña que esta proteína tenga alguna actividad -butirobetaína hidroxilasa (-BBH) (Galagan J.
E. et al., Nature, 422:859-868, 2003).
La patente estadounidense 4.371.618 A da a conocer que puede producirse L-carnitina usando los productos de liberación de Neurospora crassa y que las esporas de Neurospora crassa comprenden gammabutirobetaína hidroxilasa.
Una secuencia de nucleótidos que codifica para -butirobetaína hidroxilasa, derivada de Neurospora crassa y que produce L-carnitina usando -butirobetaína, producida a través del mecanismo anteriormente mencionado, como precursor, no ha se ha identificado antes de la presente invención.
Descripción de la invención
Basándose en estos antecedentes, los presentes inventores identificaron un gen que codifica para butirobetaína hidroxilasa derivada de Neurospora crassa, y produjeron con éxito L-carnitina a partir de butirobetaína mediante un método biológico empleando -butirobetaína hidroxilasa expresada usando el gen.
Breve descripción de los dibujos
Los anteriores y otros objetos, características y otras ventajas de la presente invención se entenderán más claramente a partir de la siguiente descripción detallada tomada en conjunto con los dibujos adjuntos, en los que:
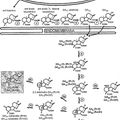
La figura 1 muestra los resultados de SDS-PAGE (electroforesis en gel de poliacrilamida) de sobrenadantes de centrífuga de lisados celulares de Escherichia coli (E. coli) BL21 que no contiene el gen de -butirobetaína hidroxilasa (-BBH) y E. coli BL21 que contiene el gen de -BBH e inducido por IPTG (isopropil--Dtiogalactopiranósido);
La figura 2 muestra los resultados de una electroforesis en gel de agarosa al 0,8% de un gen de ADNc de BBH clonado en pT7-7;
La figura 3 es una alineación de secuencias múltiple en el que se alinea una secuencia de aminoácidos de -BBH de Neurospora crassa frente a la del ser humano, rata y -BBH derivada de Pseudomonas;
La figura 4 es una presentación esquemática de un plásmido pT7-BBH2; y
La figura 5 es un diagrama esquemático de un procedimiento de producción de L-carnitina a partir de butirobetaína.
Mejor modo de llevar a cabo la invención
En un aspecto, la presente invención se proporciona el uso de un transformante según la reivindicación 1.
Con el fin de obtener un gen que codifique para -butirobetaína hidroxilasa derivada del hongo filamentoso Neurospora crassa, los presentes inventores compararon en primer lugar genes heterogéneos que codifican para butirobetaína hidroxilasa para encontrar regiones conservadas. Se realizó una búsqueda de homología entre las regiones conservadas y las secuencias génicas completas de N. crassa, registradas en la base de datos de genes. A partir de genes que tienen secuencias parcialmente similares, se seleccionó un gen candidato que mostraba actividad -butirobetaína hidroxilasa. Con el fin de clonar el gen candidato, se sintetizaron cebadores específicos para el gen. Se preparó una biblioteca de ADNc de Neurospora crassa y se examinó para detectar el gen diana usando los cebadores sintetizados. Se insertó el clon de ADNc así obtenido en un vector apropiado. Se transformó el vector recombinante resultante en Escherichia coli, y se encontró que la clonación del gen fue exitosa mediante experimentos usando el transformante. Se indujo la expresión de la proteína del gen portado por el vector recombinante mediante tratamiento con IPTG y se analizo mediante SDS-PAGE.... [Seguir leyendo]
Reivindicaciones:
1. Uso de un transformante que comprende un vector recombinante que comprende un gen que se selecciona del grupo que consiste en un polinucleótido representado por SEQ ID NO 1 y un polinucleótido que codifica para gamma-butirobetaína hidroxilasa representado por SEQ ID NO 2, para preparar L-carnitina, que comprende la hidroxilación de la gamma-butirobetaína.
2. Uso de un transformante según la reivindicación 1, en el que el transformante es Escherichia coli.
3. Uso de un transformante según la reivindicación 2, en el que el transformante es Escherichia coli KCCM10557.
Patentes similares o relacionadas:
 UN METODO PARA AUMENTAR EL PESO DE SEMILLAS, del 10 de Diciembre de 2010, de ROTHAMSTED RESEARCH LIMITED: Un método para incrementar el peso de semillas, comprendiendo el método modificar genéticamente una célula vegetal para incrementar el contenido […]
UN METODO PARA AUMENTAR EL PESO DE SEMILLAS, del 10 de Diciembre de 2010, de ROTHAMSTED RESEARCH LIMITED: Un método para incrementar el peso de semillas, comprendiendo el método modificar genéticamente una célula vegetal para incrementar el contenido […]
VECTORES LENTIVIRICOS PARA EL TRATAMIENTO DE LAS ENFERMEDADES NEURODEGENERATIVAS, del 2 de Diciembre de 2010, de OXFORD BIOMEDICA (UK) LIMITED: Genoma de vector lentivírico que comprende tres o más secuencias de nucleótidos de interés ligadas funcionalmente por dos o más sitios internos […]
FAD4, FAD5, FAD5-2 Y FAD6, MIEMBROS DE LA FAMILIA DE DESATURASAS DE ACIDOS GRASOS Y USOS DE LOS MISMOS, del 23 de Julio de 2010, de BIORIGINAL FOOD & SCIENCE CORP.: Una molécula aislada de ácido nucleico seleccionada del grupo que consiste de: (a) una molécula de ácido nucleico que comprende la secuencia de nucleótidos […]
IDENTIFICACION DE GENES DE LA 3-CETOESTEROIDE 9-ALFA-HIDROXILASA Y MICROORGANISMOS BLOQUEADOS DE LA ACTIVIDAD 3-CETOESTEROIDE 9-ALFA-HIDROXILASA, del 5 de Julio de 2010, de N. V. ORGANON: Un método para construir una cepa genéticamente modificada de un microorganismo que degrada esteroides que carece de la capacidad de degradar el […]
PROCEDIMIENTO PARA QUE LAS PLANTAS VUELVAN A SER TOLERANTES A HERBICIDAS INHIBIDORES DE HPPD POR CIRCUNVALACION DE LA VIA METABOLICA DE HPPD, del 29 de Diciembre de 2009, de AVENTIS CROPSCIENCE S.A.: Procedimiento para volver a plantas tolerantes a un herbicida inhibidor de la ácido hidroxifenilpirúvico dioxigenasa (HPPD), caracterizado porque se […]
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.