FTALEÍNAS DE PUREZA ELEVADA Y SU PROCEDIMIENTO DE PREPARACIÓN.
Procedimiento de preparación de ftaleínas, liberadas de sus impurezas residuales,
que presentan la fórmula general (I): en la que R1, R2, R3, R4, R5 que son idénticos o diferentes entre sí, se seleccionan de entre el grupo constituido por los radicales o los grupos siguientes: hidrógeno, hidroxilo, halógeno, acetilo, amino, fosfato, nitro, sulfonato, carboxi, alquilcarboxi de 2 a 30 átomos de carbono, alquilo que tiene de 1 a 30 átomos de carbono, cicloalquilo que tiene de 3 a 12 átomos de carbono, alquiloxi que tiene de 1 a 30 átomos de carbono, halogenoalquilo que tiene de 1 a 30 átomos de carbono, hidroxialquilo que tiene de 1 a 30 átomos de carbono, alquiléster que tiene de 2 a 40 átomos de carbono, nitroalquilo que tiene de 1 a 30 átomos de carbono, carboxialquilo que tiene de 2 a 30 átomos de carbono, aminoalquilo que tiene de 1 a 30 átomos de carbono, sulfoalquilo que tiene de 1 a 30 átomos de carbono, arilo, ariloxi, aril-alquilo, halogenoarilo, ariléster, succinimidiléster, isotiocianato, maleimida, yodoacetamida, halogenoacetamida, clorosulfónico, las bases púricas o pirimídicas, las osas, preferentemente las hexosas o las pentosas, los oligósidos y los poliósidos, los polipéptidos, las proteínas y los fosfolípidos, R3 y R5 no representan cada uno el hidrógeno cuando R1 representa un grupo -CH2-CH2-COOH, R2 representa un grupo hidroxi y R4 representa un grupo -COOH, caracterizado porque se condensa un derivado del anhídrido ftálico de fórmula (II) con un compuesto fenólico o naftólico de fórmula (III) en las que R1, R2, R3, R4, R5 tienen los mismos significados que anteriormente, siendo la condensación realizada en un disolvente constituido por un éster de ácido orgánico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2003/003205.
Solicitante: PATENT PHARMA.
Nacionalidad solicitante: Francia.
Dirección: 2 BIS, RUE DUPONT DE L'EURE 75020 PARIS FRANCIA.
Inventor/es: SCHERNINSKI, FRANCOIS, TRAN-GUYON,Joanne.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Octubre de 2003.
Clasificación Internacional de Patentes:
- C07D493/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 493/00 Compuestos heterocíclicos que contienen átomos de oxígeno como únicos heteroátomos del ciclo en el sistema condensado. › Sistemas espiro-condensados.
Clasificación PCT:
- A61K49/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones para examen in vivo.
- C07D493/10 C07D 493/00 […] › Sistemas espiro-condensados.
- G01B21/00 FISICA. › G01 METROLOGIA; ENSAYOS. › G01B MEDIDA DE LA LONGITUD, ESPESOR O DIMENSIONES LINEALES ANALOGAS; MEDIDA DE ANGULOS; MEDIDA DE AREAS; MEDIDA DE IRREGULARIDADES DE SUPERFICIES O CONTORNOS. › Disposiciones de medida o sus detalles en caso de no adaptarse a los tipos particulares de medios de medida de los otros grupos de esta subclase.
Clasificación antigua:
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- C07D493/10 C07D 493/00 […] › Sistemas espiro-condensados.
- G01B21/64
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358207_T3.pdf



Fragmento de la descripción:
La presente invención se refiere a unas ftaleínas de pureza elevada y a su procedimiento de preparación. Se refiere más particularmente a la fluoresceína de pureza elevada.
En la presente descripción, mediante la expresión “ftaleína de pureza elevada” se entiende una ftaleína que contiene como máximo 1% en peso, preferentemente como máximo 0,5% en peso de impurezas.
Las ftaleínas son unas moléculas que presentan el motivo xanteno siguiente:
**(Ver fórmula)**
Estos productos son útiles como colorantes en diversas industrias, en particular la industria textil, la industria papelera, la imprenta, la reprografía, la industria alimentaria, la industria cosmética y la industria farmacéutica. Las ftaleínas son, actualmente, objeto de una importante recuperación de interés en el campo de la salud, para su utilización diagnóstica, en particular en el marco de la formación de imágenes médicas y en el campo de las biotecnologías para el marcado de las moléculas biológicas (ácidos nucleicos, proteínas, lipoproteínas, lípidos membranarios) y el seguimiento de la actividad bioquímica intracelular o extracelular de las moléculas biológicas.
Por ejemplo, la fluoresceína es una ftaleína utilizada habitualmente en oftalmología para la realización de angiografías en fluorescencia de la retina. El interés diagnóstico de la angiografía fluoresceínica ha aumentado actualmente por la aparición de nuevos medicamentos que permiten el tratamiento de las patologías vasculares de la retina y de la coroide, y la disponibilidad de una nueva generación de retinógrafos que permiten la formación de una imagen digitalizada en fluorescencia con más prestaciones y resolutiva que los antiguos sistemas de adquisición sobre emulsiones fotográficas.
Paralelamente, las exigencias de calidad y de seguridad de las nuevas normas farmacéuticas internacionales (ICH: International Commission of Harmonisation, ICH Q Topic Q3A 1999) han aumentado considerablemente. Ocurre lo mismo en lo que se refiere a las aplicaciones de las ftaleínas en el campo de las biotecnologías que necesitan unos agentes reactivos de calidad cada vez más elevada. Para responder a las exigencias actuales, el nivel de pureza de las ftaleínas utilizadas en el campo farmacéutico o en el de las biotecnologías debe ser necesariamente muy elevado. A título de ejemplo, en la publicación «Effective differences in the formulation of intravenous fluorescein and related side effects», Am. J. Ophtalmol. 78,2: 217-221, 1974, L. Yannuzzi ha mostrado que existe una correlación entre la pureza de las ftaleínas, en particular la de la fluoresceína, y la tolerancia de estas sustancias cuando se administran por vía inyectable en el ser humano.
Unas ftaleínas presentan la fórmula general (I):
**(Ver fórmula)**
en la que R1, R2, R3, R4, R5 que son idénticos o diferentes entre sí, se seleccionan de entre el grupo constituido por los radicales o los grupos siguientes: hidrógeno, hidroxilo, halógeno, acetilo, amino, fosfato, nitro, sulfonato, carboxi, alquilcarboxi de 2 a 30 átomos de carbono, alquilo que tiene de 1 a 30 átomos de carbono, cicloalquilo que tiene de 3 a 12 átomos de carbono, alquiloxi que tiene de 1 a 30 átomos de carbono, halogenoalquilo que tiene de 1 a 30 átomos de carbono, hidroxialquilo que tiene de 1 a 30 átomos de carbono, alquiléster que tiene de 2 a 40 átomos de carbono, nitroalquilo que tiene de 1 a 30 átomos de carbono, carboxialquilo que tiene de 2 a 30 átomos de carbono, aminoalquilo que tiene de 1 a 30 átomos de carbono, sulfoalquilo que tiene de 1 a 30 átomos de carbono, arilo, ariloxi, aril-alquilo, halogenoarilo, ariléster, succinimidiléster, isotiocianato, maleimida, yodoacetamida, halogenoacetamida, clorosulfónico, las bases púricas o pirimídicas, las osas, preferentemente las hexosas o las pentosas, los oligósidos y los poliósidos, los polipéptidos, las proteínas y los fosfolípidos,
R3 y R5 no representan cada uno el hidrógeno cuando R1 representa un grupo -CH2-CH2-COOH, R2 representa un grupo hidroxi y R4 representa un grupo -COOH,
no conteniendo estas ftaleínas más de 1% en peso, preferentemente no más de 0,5% en peso y más preferentemente todavía no más de 0,2% en peso de impurezas residuales.
Una ftaleína particularmente interesante, en particular para unas aplicaciones oftálmicas es la fluoresceína que presenta una pureza de este tipo.
Es conocido preparar las ftaleínas de fórmula (I) mediante la condensación de un derivado del anhídrido ftálico y de un derivado fenólico que tiene una posición libre en orto de un grupo hidroxilo (véase en particular el documento US-A-5.637.733, y Shawn C. Burdette et al., J. Am. Chem. Soc., vol. 123, 2001, páginas 7831-41).
Esta condensación se realiza mediante calentamiento a la temperatura de fusión de una mezcla del anhídrido ftálico y del derivado fenólico, en las proporciones deseadas.
Esta condensación se puede realizar eventualmente en un disolvente de dilución. Puede ser conducida asimismo en presencia de un catalizador.
En ausencia de disolvente, durante el calentamiento, el medio de reacción se espesa rápidamente y tiene tendencia a fraguar en masa. En el seno del medio de reacción, se forman entonces unas zonas en las que la temperatura es demasiado elevada y unas zonas en las que la temperatura no es lo suficientemente elevada.
En las zonas en las que la temperatura es demasiado elevada, los agentes reactivos y/o el producto de reacción se degradan y en las zonas en las que la temperatura no es lo suficientemente elevada, la reacción no es completa. El producto obtenido es de calidad mediocre puesto que comprende unos sub-productos muy difíciles de eliminar.
Con el fin de mejorar este procedimiento conocido, se ha propuesto la adición de un disolvente inerte o la utilización de un catalizador.
Asimismo, la patente US nº 1.931.049 describe la adición al medio de reacción de un disolvente inerte constituido por un hidrocarburo bencénico o alifático, más particularmente el ortodiclorobenceno. Sin embargo, la reacción de condensación es entonces incompleta, y se forman unos productos intermedios difíciles de eliminar después. Se desprende de lo anterior que el procedimiento descrito en la patente US nº 1.931.049 no permite la obtención de una ftaleína de pureza elevada según la definición de la presente solicitud. Por otro lado, los hidrocarburos alifáticos superiores no son miscibles con el medio de reacción; por consiguiente, no aportan ninguna mejora en el plano de la transferencia térmica y obstaculizan la eliminación del agua formada, lo cual ralentiza la reacción, que tiene lugar exclusivamente en medio hidrófobo.
Haciendo referencia a los catalizadores propuestos para mejorar el rendimiento de la reacción, se trata del ácido sulfúrico concentrado, del cloruro de zinc anhidro y del cloruro de estaño.
En la patente alemana DE 360691, se ha propuesto utilizar como catalizador un ácido sulfónico aromático, tal como el ácido benceno-sulfónico, solo o asociado a uno de los tres catalizadores citados anteriormente.
Sin embargo, se observa que la adición de estos catalizadores provoca un fraguado en masa rápido del producto de la reacción con un aprisionamiento de las impurezas que ya no pueden ser eliminadas del producto buscado.
Con el fin de eliminar los sub-productos formados y las impurezas, se han puesto a punto unos procedimientos de aislamiento y de purificación pero no han permitido mejorar sustancialmente la calidad de las ftaleínas.
Un procedimiento utilizado habitualmente consiste en alcalinizar la ftaleína en medio acuoso para disolverla y después acidificarla para permitir su precipitación. Estas dos etapas se renuevan sucesivamente para intentar eliminar las impurezas. Sin embargo, este método no permite una mejora notable de la pureza del producto puesto que si las impurezas se disuelven con la ftaleína durante la etapa de alcanilización, éstas se precipitan de nuevo al mismo tiempo que la ftaleína durante la etapa de acidificación. Además, este método de purificación adolece del inconveniente de producir una cantidad importante de sales que son difíciles y costosas de eliminar después. Dicho procedimiento de purificación se describe en particular en el documento DD136498.
La patente US nº 1.965.842 describe la purificación de las ftaleínas, derivadas del hidroxibenceno,... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de preparación de ftaleínas, liberadas de sus impurezas residuales, que presentan la fórmula general (I):
**(Ver fórmula)**
en la que R1, R2, R3, R4, R5 que son idénticos o diferentes entre sí, se seleccionan de entre el grupo constituido por los radicales o los grupos siguientes: 10 hidrógeno, hidroxilo, halógeno, acetilo, amino, fosfato, nitro, sulfonato, carboxi, alquilcarboxi de 2 a 30 átomos de carbono, alquilo que tiene de 1 a 30 átomos de carbono, cicloalquilo que tiene de 3 a 12 átomos de carbono, alquiloxi que tiene de 1 a 30 átomos de carbono, halogenoalquilo que tiene de 1 a 30 átomos de carbono, hidroxialquilo que tiene de 1 a 30 átomos de carbono, alquiléster que tiene de 2 a 40 átomos de carbono, 15 nitroalquilo que tiene de 1 a 30 átomos de carbono, carboxialquilo que tiene de 2 a 30 átomos de carbono, aminoalquilo que tiene de 1 a 30 átomos de carbono, sulfoalquilo que tiene de 1 a 30 átomos de carbono, arilo, ariloxi, aril-alquilo, halogenoarilo, ariléster, succinimidiléster, isotiocianato, maleimida, yodoacetamida, halogenoacetamida, clorosulfónico, las bases púricas o pirimídicas, las osas, preferentemente las hexosas o las
20 pentosas, los oligósidos y los poliósidos, los polipéptidos, las proteínas y los fosfolípidos,
R3 y R5 no representan cada uno el hidrógeno cuando R1 representa un grupo -CH2-CH2-COOH, R2 representa un grupo hidroxi y R4 representa un grupo -COOH,
25 caracterizado porque se condensa un derivado del anhídrido ftálico de fórmula (II) con un compuesto fenólico o naftólico de fórmula (III)
**(Ver fórmula)**
en las que R1, R2, R3, R4, R5 tienen los mismos significados que anteriormente,
siendo la condensación realizada en un disolvente constituido por un éster de ácido orgánico.
2. Procedimiento según la reivindicación 1, en el que el compuesto de fórmula
(III) se selecciona de entre el grupo constituido por el resorcinol, el orcinol, el naftol, el pirogalol, el alquilaminofenol y el arilaminofenol.
3. Procedimiento según una de las reivindicaciones 1 y 2, en el que el disolvente es un éster de ácido orgánico de fórmula (IV)
R6-COOR7 (IV)
en la que R6 se selecciona de entre el grupo constituido por los radicales o los grupos siguientes: hidrógeno, alquilo que tiene de 1 a 30 átomos de carbono, cicloalquilo que tiene de 3 a 12 átomos de carbono, halogenoalquilo que tiene de 1 a 30 átomos de carbono, hidroxialquilo que tiene de 1 a 30 átomos de carbono, nitroalquilo que tiene de 1 a 30 átomos de carbono, arilo, ariloxi, alquilarilo, arilalquilo, arilalquilo sustituido, halogenoarilo, ariléster, alquiléster que tiene de 2 a 40 átomos de carbono, alquiloxi que tiene de 1 a 30 átomos de carbono, representando R7 un grupo alquilo que tiene de 1 a 30 átomos de carbono, cicloalquilo que tiene de 3 a 12 átomos de carbono, halogenoalquilo que tiene de 1 a 30 átomos de carbono, hidroxialquilo que tiene de 1 a 30 átomos de carbono, nitroalquilo que tiene de 1 a 30 átomos de carbono, arilo, ariloxi, alquilarilo, arilalquilo, aril-alquilo sustituido, halogenoarilo, ariléster, alquiléster que tiene de 2 a 40 átomos de carbono, y alquiloxi que tiene de 1 a 30 átomos de carbono.
4. Procedimiento según una de las reivindicaciones 1 a 3, caracterizado porque el éster de ácido orgánico se selecciona de entre el grupo constituido por el benzoato, el heptanoato, el octanoato, el laurato, el miristato o el palmitato de metilo, de etilo, de propilo
o de butilo, y sus mezclas.
5. Procedimiento según una de las reivindicaciones 1 a 4, caracterizado porque la reacción de condensación se lleva a cabo entre 150ºC y 250ºC, eventualmente bajo presión.
6. Procedimiento según una de las reivindicaciones 1 a 5, caracterizado porque se lleva a cabo en presencia de un catalizador seleccionado de entre el grupo constituido en particular por los ácidos de Lewis, tales como ZnCl2 o AlCl3, los ácidos de Brönsted tales como H2SO4, el ácido polifosfórico, preferentemente un hidrogenosulfato alcalino y más preferentemente el hidrogenosulfato de potasio (KHSO4) o el hidrogenosulfato de sodio (NaHSO4).
7. Procedimiento de acidificación del producto resultante de la condensación de un derivado del anhídrido ftálico de fórmula (II) con un compuesto fenólico o naftólico de fórmula (III), siendo las fórmulas (II) y (III) las de la reivindicación 1, caracterizado porque se lleva a cabo en un medio orgánico anhidro, mediante la adición de un ácido fuerte o de uno de sus precursores seleccionado de entre el grupo constituido por el ácido sulfúrico, el ácido clorhídrico, el ácido bromhídrico, el ácido fluorhídrico, el ácido yodhídrico, el ácido polifosfórico, el pirofosfato (P2O5), y sus mezclas, siendo la acidificación llevada a cabo
hasta la conversión de los cristales de ftaleína que resultan de la condensación, en cristales de ftaleína de estructura diferente.
8. Procedimiento según la reivindicación 7, caracterizado porque el producto de condensación es el producto obtenido mediante el procedimiento según cualquiera de las reivindicaciones 1 a 6.
9. Procedimiento según la reivindicación 7 u 8, caracterizado porque comprende una etapa de lavado del producto obtenido después de la acidificación, siendo dicha etapa de lavado efectuada con la ayuda de una disolución de lavado seleccionada de entre el grupo constituido por el agua, los alcoholes, las cetonas, los éteres y los disolventes halogenados, puros o en mezcla hasta la reconversión de los cristales en la estructura que tenía antes de la reacción de acidificación.
10. Procedimiento de preparación de una fluoresceína que presenta una pureza tal que su contenido de cada uno de los sub-productos de la reacción es inferior o igual a 0,2% y preferentemente inferior o igual a 0,1%, siendo la suma de los contenidos de cada uno de estos sub-productos inferior o igual a 0,5%, comprendiendo dicho procedimiento las etapas sucesivas siguientes:
- condensar el anhídrido ftálico con el resorcinol, en un disolvente constituido por un éster de ácido orgánico alifático o aromático, preferentemente el benzoato o el palmitato de etilo o de metilo, en presencia de un catalizador seleccionado de entre el grupo constituido en particular por los ácidos de Lewis o los ácidos de Brönsted, y preferentemente un hidrogenosulfato alcalino,
- poner en suspensión los cristales de color rojo obtenidos en la etapa anterior en un disolvente anhidro seleccionado de entre el grupo constituido por los alcoholes tales como el etanol absoluto, las cetonas tales como la acetona, los éteres, los disolventes halogenados, o sus mezclas,
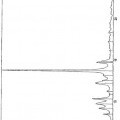
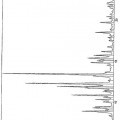
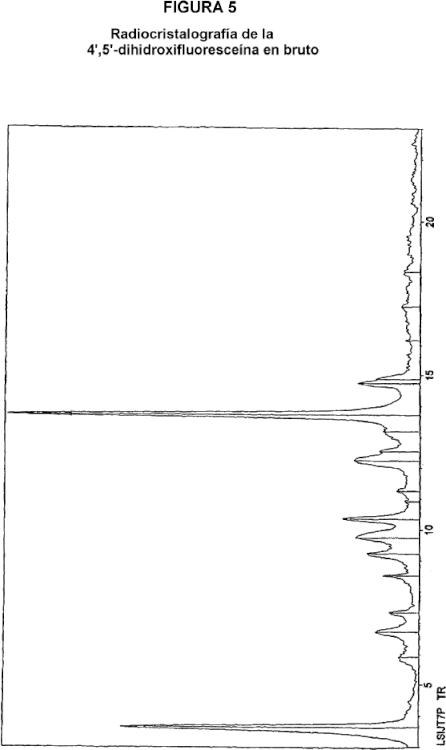
- acidificar la suspensión obtenida mediante la adición de un ácido fuerte o de uno de sus precursores seleccionado de entre el grupo constituido por el ácido sulfúrico, el ácido clorhídrico, el ácido bromhídrico, el ácido fluorhídrico, el ácido yodhídrico, el ácido polifosfórico, el pirofosfato (P2O5), y sus mezclas, hasta la conversión de los cristales de color rojo en cristales de color amarillo que presentan el espectro de radiocristalografía de la figura 2,
- lavar los cristales así obtenidos con la ayuda de una disolución de lavado seleccionada de entre el grupo constituido por el agua, los alcoholes, las cetonas, los éteres y los disolventes halogenados, puros o en mezcla, continuando este lavado hasta la reconversión de los cristales de color amarillo en cristales de color rojo.
11. Procedimiento según una de las reivindicaciones 7 a 10, caracterizado porque la acidificación se lleva a cabo mediante burbujeo de ácido clorhídrico gaseoso en la
suspensión de ftaleína o mediante la acción sobre esta ftaleína de ácido clorhídrico en disolución en el disolvente orgánico anhidro, preferentemente un alcohol, una cetona, un éter, un disolvente halogenado utilizados de forma aislada o en mezcla, más preferentemente todavía, el isopropanol, el etanol absoluto o la acetona, puros o en mezcla.
12. Procedimiento según una de las reivindicaciones 1 a 11, caracterizado porque el catalizador utilizado para la reacción de condensación está constituido por el hidrogenosulfato de un metal alcalino, preferentemente hidrogenosulfato de potasio o de sodio.
13. Cristales de fluoresceína de color amarillo que presentan el espectro de radiocristalografía cuyos picos están identificados a continuación: Theta (grados) Distancias (Å) % de intensidades Número de golpes 3,3500 13,1813 8,55 56 4,0050 11,0283 47,18 309 4,8550 9,1010 12,98 85 5,2650 8,3940 9,01 59 5,4500 8,1099 11,45 75 5,7900 7,6352 52,98 347 6,3000 7,0193 16,95 111 6,7700 6,5340 17,86 117 7,4900 5,9090 17,56 115 8,0300 5,5140 69,77 457 8,4250 5,2572 33,13 217 8,7800 5,0462 8,40 55 9,1550 4,8411 15,88 104 9,3400 4,7461 42,44 278 9,6550 4,5926 34,66 227 9,8800 4,4891 24,43 160 10,1950 4,3518 57,71 378 10,5800 4,1951 58,02 380 10,7350 4,1352 38,17 250 11,1650 3,9779 28,85 189 11,4800 3,8701 30,23 198 11,7200 3,7919 59,85 392 12,1100 3,6716 26,41 173 12,3950 3,5884 58,47 383 12,6400 3,5200 100,00 655 12,9450 3,4384 30,84 202 13,1550 3,3845 56,64 371 13,8350 3,2211 14,66 96 14,0550 3,1717 24,12 158 14,3550 3,1068 36,34 238 14,6700 3,0415 42,90 281 15,1300 2,9511 42,90 281 15,7500 2,8377 18,47 121
Theta (grados) Distancias (Å) % de intensidades Número de golpes 15,9400 2,8047 18,17 119 16,2500 2,7526 15,42 101 16,7550 2,6719 17,71 116 16,8500 2,6573 19,39 127 17,2250 2,6011 18,17 119 17,7300 2,5293 15,73 103 18,4200 2,4377 10,23 67 18,5750 2,4180 10,23 67 19,2650 2,3345 15,88 104 19,5800 2,2984 10,84 71 19,8000 2,2739 11,91 78 20,1150 2,2397 13,28 87 20,6500 2,1841 14,81 97 21,1500 2,1348 11,30 74 21,2750 2,1228 10,08 66 21,8100 2,0732 7,94 52 22,2500 2,0342 9,16 60 22,6250 2,0022 9,62 63 22,9100 1,9786 9,01 59
Longitud de onda: 1,54051 Å
14. Cristales de fluoresceína susceptibles de ser obtenidos mediante un procedimiento según cualquiera de las reivindicaciones 7 a 11.
15. Utilización de los cristales de fluoresceína según la reivindicación 14 en unas aplicaciones farmacéuticas en diagnóstico en particular en formación de imágenes médicas o en el campo de las aplicaciones en biotecnología.
Patentes similares o relacionadas:
Compuesto intermedio de moduladores de transportadores de casete de unión a ATP, del 18 de Marzo de 2020, de VERTEX PHARMACEUTICALS INCORPORATED: Un compuesto de la fórmula: **(Ver fórmula)** ácido 1-(2,2-difluoro-benzo[1,3]dioxol-5-il)-ciclopropanocarboxílico o una sal farmacéuticamente aceptable del […]
Compuestos de quinolina sustituidos selectivamente, del 4 de Diciembre de 2019, de EISAI R&D MANAGEMENT CO., LTD: Un compuesto de fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** o un estereoisómero del mismo o una mezcla de estereoisómeros […]
Derivados de benzodioxol como inhibidores de la fosfodiesterasa, del 17 de Abril de 2019, de LEO PHARMA A/S: Un compuesto que es 2-(3,5-Dicloro-1-óxido-piridin-4-il)-1-{9-difluorometoxi-espiro[2H-1,5- benzodioxepin-3(4H),3'-oxetano]-6-il}etanona, o un hidrato […]
Compuestos farmacológicamente activos, del 14 de Febrero de 2019, de THE UNIVERSITY OF LIVERPOOL: (4-(hidroxi)-3,5-diisopropilfenil)(morfolino)metanona,**Fórmula** o una sal o solvato farmacéuticamente aceptable del mismo.
Cetoenoles espirocíclicos sustituidos con bifenilo, del 9 de Octubre de 2018, de BAYER CROPSCIENCE AG: Compuestos de fórmula (I)**Fórmula** en la que W representa hidrógeno o metilo, X representa cloro o metilo, Y representa […]
Derivados de manosa para tratar las infecciones bacterianas, del 18 de Abril de 2018, de VERTEX PHARMACEUTICALS INCORPORATED: Compuesto de fórmula I**Fórmula** o sal farmacéuticamente aceptable del mismo, en el que cada M y M2 es independientemente**Fórmula** en el que: Y1 […]
Procedimiento para la oxidación asimétrica de compuestos orgánicos con peróxidos en presencia de un catalizador ácido quiral, del 7 de Marzo de 2018, de STUDIENGESELLSCHAFT KOHLE MBH: Procedimiento para la oxidación asimétrica libre de metales de un compuesto orgánico nucleofílico mediante adición electrofílica de un compuesto […]
Diagnóstico para cáncer, del 20 de Diciembre de 2017, de The University of Tokyo: Un agente para su uso en un método de diagnóstico "in vivo" de cáncer que comprende un compuesto representado por la siguiente fórmula general […]