Fragmento Fc de inmunoglobulina modificado por un polímero no peptídico y composición farmacéutica que contiene el mismo.
Un complejo que comprende un fragmento Fc de inmunoglobulina modificado por PEG,
un enlazador nopeptídico, y un fármaco polipeptídico, en donde dicho fragmento Fc de inmunoglobulina modificado por PEGestá covalentemente unido al fármaco polipeptídico a través del enlazador no peptídico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2005/001233.
Solicitante: Hanmi Science Co., Ltd. .
Nacionalidad solicitante: República de Corea.
Dirección: 550 Dongtangiheung-ro, Dongtan-myeon, Hwaseong-si Gyeonggi-do 445-813 REPUBLICA DE COREA.
Inventor/es: LEE, GWAN, SUN, KWON, SE CHANG, BAE, SUNG MIN, KIM, YOUNG MIN, KIM,DAE-JIN, LIM,CHANG-KI, SONG,DAE HAE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
PDF original: ES-2427257_T3.pdf
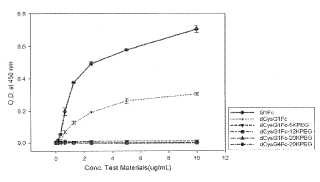
Fragmento de la descripción:
Fragmento Fc de inmunoglobulina modificado por un polímero no peptídico y composición farmacéutica que contiene el mismo.
Campo técnico
La presente invención se refiere a un complejo en el que un fragmento Fc modificado por un polímero no peptídico se conjuga a un fármaco a través de un enlazador y una composición farmacéutica que contiene tal complejo.
Antecedentes técnicos En el pasado, un gran número de farmacólogos y químicos hicieron esfuerzos para alterar y/o modificar químicamente la actividad in vivo de moléculas naturales fisiológicamente activas. Estos esfuerzos asociados con sustancias fisiológicamente activas se enfocaron principalmente en aumentar la actividad in vivo específica, prolongar la actividad in vivo, reducir la toxicidad, eliminar o reducir los efectos secundarios, o modificar actividades fisiológicas específicas. Cuando una sustancia fisiológicamente activa se modifica químicamente, pierde algo o la mayor parte de sus actividades fisiológicas en muchos casos. Sin embargo, en algunos casos, la modificación podría producir un aumento o cambio en la actividad fisiológica. A este respecto, muchos estudios se han enfocado en la modificación química capaz de alcanzar la actividad fisiológica deseada, y la mayoría de los estudios han implicado unir covalentemente una sustancia fisiológicamente activa (fármaco) a un vehículo fisiológicamente aceptable.
Para estabilizar proteínas y prevenir la degradación enzimática y depuración por el riñón, convencionalmente se usó un polímero que tiene alta solubilidad, tal como polietilenglicol (de aquí en adelante denominado simplemente como “PEG”) para modificar químicamente la superficie de un fármaco proteínico. Puesto que PEG se une de una manera no específica a una región específica o varias regiones de una proteína diana, tiene los efectos de aumentar la solubilidad de la proteína, estabilizar la proteína y prevenir la hidrólisis de la proteína, y no tiene efectos secundarios específicos (Sada et al., J. Fermentation Bioengineering 71: 137-139, 1991) . Sin embargo, a pesar de la capacidad de aumentar la estabilidad de las proteínas, este acoplamiento de PEG tiene problemas de reducir mucho los títulos de las proteínas fisiológicamente activas y reducir el rendimiento debido a la reactividad del PEG con proteínas que disminuye al aumentar el peso molecular del PEG.
Recientemente, se han sugerido conjugados de polímero-fármaco proteínico. Por ejemplo, como se describe en la patente en EE UU No. 5.738.846, se puede preparar un conjugado mediante unión de un fármaco proteínico idéntico a ambos extremos de PEG para mejorar la actividad del fármaco proteínico. Además, como se describe en la publicación de patente internacional No. WO 92/16221, se pueden unir dos fármacos proteínicos diferentes a ambos extremos de PEG para proporcionar un conjugado que tiene dos actividades diferentes. Sin embargo, estos métodos no son eficaces en el sostenimiento de la actividad de fármacos proteínicos.
Kinstler y col, describieron que una proteína de fusión preparada acoplando el factor estimulante de colonias de granulocitos (G-CSF) a albúmina humana tiene estabilidad mejorada (Kinstler et al., Pharmaceutical Research 12 (12) : 1883-1888, 1995) . Sin embargo, en esta publicación, puesto que el fármaco modificado, que tiene una estructura G-CSF-PEG-albúmina, mostró solo un aumento de aproximadamente cuatro veces en el tiempo de residencia en el cuerpo y un ligero aumento en la vida media en suero comparado con la administración única del G-CSF nativo, no se ha industrializado como una formulación eficaz de acción prolongada para fármacos proteínicos.
Un método alternativo para mejorar la estabilidad in vivo de proteínas fisiológicamente activas incluye unir un gen de proteína fisiológicamente activa a un gen que codifica una proteína que tiene una alta estabilidad en suero mediante recombinación genética y cultivar una célula animal transfectada con el gen recombinante para producir una proteína de fusión. Por ejemplo, se puede preparar una proteína de fusión conjugando albúmina, que se sabe que es la más eficaz en aumentar la estabilidad de proteínas, o su fragmento a una proteína fisiológicamente activa de interés mediante recombinación genética (publicación de patente internacional No. WO 93/15199 y WO 95/15200, publicación de patente europea No. 413.622) . Una proteína de fusión de interferón alfa y albúmina, desarrollada por la Human Genome Science Company y comercializada bajo el nombre comercial ‘Albuferon™’, tiene una vida media aumentada desde 5 horas hasta 93 horas en monos, pero es problemática en términos de tener un actividad in vivo muy disminuida menos del 5% comparada con el interferón alfa sin modificar (Osborn et al., J. Phar. Exp. Ther. 303 (2) : 540-548, 2002) .
Se aplicaron tecnologías de ADN recombinante para fusionar un fármaco proteínico a un fragmento Fc de inmunoglobulina. Por ejemplo, interferón (publicación de patente coreana accesible al público No. 2003-9464) , y el receptor de interleuquina-4, receptor de interleuquina-7 o receptor de eritropoyetina (EPO) (registro de patente coreana No. 249572) se expresaron previamente en mamíferos en una forma fusionada a un fragmento Fc de inmunoglobulina. La publicación de patente internacional No. WO 01/03737 describe una proteína de fusión que comprende una citoquina o un factor de crecimiento unido a un fragmento Fc de inmunoglobulina a través de una unión peptídica. Además, la patente en EE UU No. 5.116.964 divulga proteínas fusionadas al extremo amino o carboxilo terminal de un fragmento Fc de inmunoglobulina por recombinación genética. La patente en EE UU No.
5.349.053 divulga una proteína de fusión que comprende IL-2 fusionada a un fragmento Fc de inmunoglobulina a través de un enlazador peptídico. Otros ejemplos de proteínas de fusión de Fc preparadas por recombinación genética incluyen una proteína de fusión de interferón beta o su derivado y un fragmento Fc de inmunoglobulina (publicación de patente internacional No. WO 0/23472) , y una proteína de fusión del receptor de IL-5 y un fragmento Fc de inmunoglobulina (patente en EE UU No. 5.712.121) , una proteína de fusión de interferón alfa y la región Fc de la inmunoglobulina G4 (patente en EE UU No. 5.723.125) , y una proteína de fusión de la proteína CD4 y la región Fc de la inmunoglobulina G2 (patente en EE UU No. 6.451.313) .
Sin embargo, estas proteínas de fusión de Fc, en las que se une un polipéptido/proteína al extremo N-o C-terminal de un fragmento Fc a través de enlace peptídico, son problemáticas, como sigue. La producción recombinante de una proteína de fusión de Fc se puede alcanzar solo mediante expresión de una molécula de ácido nucleico que codifica la proteína de fusión de Fc en una única forma de polipéptido/proteína en una única célula huésped. Por tanto, puesto que la proteína de fusión entera está glicosilada o aglicosilada por este sistema, es imposible la fusión entre proteínas glicosiladas y aglicosiladas. Además, estas proteínas de fusión de Fc median funciones efectoras por la región Fc. A través de las funciones efectoras de la región Fc, fijan complementos o se unen a células que expresan FcR, lo que produce la lisis de células específicas, e induce la producción y secreción de varias citoquinas que inducen inflamación, lo que produce inflamación no deseada (Patente en EE UU No. 6.656.728; Zheng et al., J. Immunology, 1999, 163:4041-4048; Huang et al., Immunology letters, 2002, 81:49-58) . Además, la fusión crea una nueva secuencia de aminoácidos, no presente en seres humanos, en una región de unión entre la región Fc y el compañero proteínico, que podría potencialmente inducir respuestas inmunitarias en seres humanos.
Se han hecho muchos esfuerzos para preparar una inmunoglobulina o fragmento de inmunoglobulina que retenga una vida media en suero larga pero que sea deficiente en funciones efectoras. Cole y col., describieron que, cuando los residuos de aminoácidos de la región CH2 en las posiciones 234, 235 y 237, que se sabe que desempeñan un papel importante en la unión a receptores de Fc, se sustituyen con alanina para producir un derivado de Fc que tiene una afinidad de unión reducida a los receptores de Fc, la actividad ADCC se inhibe (Cole et al., J. Immunol. 159: 3613-3621, 1997) . Además, la patente en EE UU No. 5.605.690 divulga una proteína de fusión TNFR-Fc de IgG1 que se prepara por recombinación genética usando un fragmento Fc de IgG1 que tiene alteraciones de aminoácidos en la región de unión al complemento o región de unión al receptor de Fc de inmunoglobulina. Sin embargo,... [Seguir leyendo]
Reivindicaciones:
1. Un complejo que comprende un fragmento Fc de inmunoglobulina modificado por PEG, un enlazador no peptídico, y un fármaco polipeptídico, en donde dicho fragmento Fc de inmunoglobulina modificado por PEG 5 está covalentemente unido al fármaco polipeptídico a través del enlazador no peptídico.
2. Un complejo como se expone en la reivindicación 1, en donde el fragmento Fc es un fragmento Fc derivado de IgG, IgA, IgD, IgE, IgM o una combinación o híbrido de los mismos.
4. El complejo como se expone en la reivindicación 3, en donde el fragmento Fc es un fragmento Fc de IgG4.
6. El complejo como se expone en la reivindicación 1, en donde el enlazador es un polímero no peptídico.
7. El complejo como se expone en la reivindicación 6, en donde el polímero no peptídico se selecciona del grupo
que consiste en polietilenglicol, polipropilenglicol, co-poli (etilen/propilen) glicol, polioxietileno, poliuretano, polifosfaceno, polisacáridos, dextrano, alcohol polivinílico, polivinilpirrolidonas, polivinil-etil-éter, poliacrilamida, poliacrilato, policianoacrilatos, polímeros lipídicos, quitinas, ácido hialurónico, heparina y combinaciones de los mismos.
a citoquinas, factor activador de macrófagos, péptido de macrófagos, factor de células B, factor de células T, proteína A, inhibidor de alergia, glicoproteínas de necrosis celular, inmunotoxina, linfotoxina, factor de necrosis tumoral, supresores tumorales, factor de crecimiento de metástasis, alfa-1 antitripsina, albúmina, alfalactalbúmina, apolipoproteína-E, eritropoyetina, eritropoyetina altamente glicosilada, angiopoyetinas, hemoglobina, trombina, péptido activador del receptor de trombina, trombomodulina, factor VII, factor VIIa,
factor VIII, factor IX, factor XIII, factor activador de plasminógeno, péptido de unión a fibrina, uroquinasa, estreptoquinasa, hirudina, proteína C, proteína C reactiva, inhibidor de renina, inhibidor de colagenasa, superóxido dismutasa, leptina, factor de crecimiento derivado de plaquetas, factor de crecimiento epitelial, factor de crecimiento epidérmico, angiostatina, angiotensina, factor de crecimiento óseo, proteína estimuladora ósea, calcitonina, insulina, atriopeptina, factor inductor de cartílago, elcatonina, factor activador
de tejido conjuntivo, inhibidor de la ruta del factor tisular, hormona foliculoestimulante, hormona luteinizante, hormona liberadora de la hormona luteinizante, factores de crecimiento nerviosos, hormona paratiroidea, relaxina, secretina, somatomedina, factor de crecimiento de tipo insulínico, hormona corticosuprarrenal, glucagón, colecistocinina, polipéptido pancreático, péptido liberador de gastrina, factor liberador de corticotropina, hormona estimuladora tiroidea, autotaxina, lactoferrina, miostatina, receptores, antagonistas de 50 receptores, antígenos de superficie celular, anticuerpos monoclonales, anticuerpos policlonales, y fragmentos de anticuerpos.
10. El complejo como se expone en la reivindicación 9, en donde el polipéptido fisiológicamente activo se selecciona del grupo que consiste en hormona del crecimiento humana, factores estimuladores de colonias, 55 interferón-alfa y eritropoyetina.
11. Una composición farmacéutica que comprende el complejo de la reivindicación 1 y un soporte farmacéuticamente aceptable.
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]