Formulaciones y métodos para tratar la amiloidosis.
Una composición farmacéutica que comprende ácido 1,3-propanodisulfónico o una de sus sales farmacéuticamente aceptables para su uso en un método para tratar o prevenir una enfermedad relacionada con la proteína amiloide en un sujeto,
en donde el ácido 1,3-propanodisulfónico o una de sus sales farmacéuticamente aceptables se administra a una dosificación de aproximadamente 1200 mg dos veces al día para un índice de aclaramiento de la creatinina de >80 ml/min, una dosificación de aproximadamente 800 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 30 y 80 ml/min o una dosificación de aproximadamente 400 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 20 y 30 ml/min.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/002540.
Solicitante: KIACTA SÀRL.
Inventor/es: GARCEAU,DENIS, HAUCK,WENDY, BRIAND,RICHARD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/185 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos; Sus anhídridos, cloruros o sales, p. ej. ácidos de azufre, ácidos imídicos, hidrazónicos o hidroxímicos (ácidos hidroxámicos A61K 31/16; peroxiácidos A61K 31/327).
PDF original: ES-2534553_T3.pdf
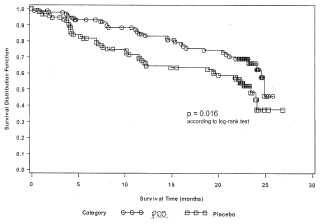
Fragmento de la descripción:
Formulaciones y métodos para tratar la amiloidosis Antecedente de la invención La amiloidosis es el término genérico de numerosas enfermedades relacionadas con la deposición extracelular de proteínas fibrilares insolubles (amiloide) en órganos específicos, que conduce eventualmente al fracaso de los órganos implicados. R.H. Falk et al., The Systemic Amyloidosis, 337 N ENGL J MED 898-909 (1997) , P.N. Hawkins, Amyloidosis, 9 BLOOD REV 135-42 (1995) , J.D. Sipe, Amyloidosis, 31 CR REV CLIN LAB SCI 325-54 (1994) ; A.S. Cohen, Amyloidosis, 40 (2) BULL RHEUM DISEASES 1-12 (1991) . Los depósitos de amiloide pueden quedar limitados a un órgano (amiloidosis localizada) o pueden estar más ampliamente distribuidos (amiloidosis sistémica) . Las amiloidosis sistémicas se clasifican generalmente en cuatro tipos según la naturaleza de los depósitos fibrilares: (i.) amiloidosis idiopática o primaria (amiloidosis AL) ; (ii.) amiloidosis secundaria reactiva o amiloide A (AA) ; (iii.) polineuropatía amiloidótica familiar; y (iv.) y amiloidosis asociada a diálisis. Aunque diferentes en su incidencia, todos los depósitos amiloides tienen propiedades morfológicas comunes, se tiñen con colorantes específicos (por ejemplo, rojo Congo) , y tienen un aspecto birrefrigente característico a la luz polarizada tras la tinción. Comparten también características ultraestructurales comunes y difracción de rayos X y espectros infrarrojos comunes.
Se cree que la amiloidosis AA está relacionada con la proteína amiloide (AA) formada a partir del precursor sérico amiloide A (SAA) , una proteína en fase aguda y secretada por hepatocitos en respuesta a la inflamación. La amiloidosis AA está asociada con afecciones inflamatorias crónicas (por ejemplo, artritis reumatoide, espondilitis anquilosante, enfermedad inflamatoria del intestino, etc.) , infecciones (por ejemplo, tuberculosis, osteomielitis etc.) , y fiebres hereditarias, por ejemplo, fiebre del Mediterráneo familiar (R.H. Falk et al., 337 N ENGL J MED 898-909 (1997) ,
A.S. Cohen, 40 (2) BULL RHEUM DISEASES 1-12 (1991) , G. Grateau, 12 CURRENT OPINION IN RHEUMATOL 61-64 (2000) ) . La artritis reumatoide es la causa principal de amiloidosis AA en Europa Occidental y Norteamérica (M. Skinner Amyloidosis, CURRENT THERAPY IN ALLERGY, IMMUNOLOGY, AND RHEUMATOLOGY 235-40 (Mosby-Year Book Inc., 1996) , M.A. Gertz, Secondar y amyloidosis, 232 J INT MED 517-18 (1992) ) .
La amiloidosis AA afecta principalmente los órganos parenquimatosos, tales como, riñón, bazo, hígado, y glándulas adrenales. La característica clínica más común de la amiloidosis AA es la disfunción renal manifestada como proteinuria de tipo nefrótico o insuficiencia renal en el momento del diagnóstico. La insuficiencia renal en la última etapa es la causa de muerte en el 40-60 % de los casos (M. Skinner Amyloidosis, CURRENT THERAPY IN ALLERGY, IMMUNOLOGY, AND RHEUMATOLOGY 235-40 (Mosby-Year Book Inc., 1996) , M.A. Gertz, 232 J INT MED 517-18 (1992) , M.A. Gertz y R.A. Kyle, 70 MEDICINE 246-256 (1991) ) . Es también frecuente la implicación gastrointestinal y se manifiesta normalmente como diarrea crónica, pérdida de peso corporal y mala absorción. Puede producirse también el agrandamiento del hígado y el bazo en algunos sujetos. Es rara la implicación cardiaca y se produce posteriormente en la enfermedad. El tiempo de supervivencia medio a partir del diagnóstico varía de 2 a 8 años dependiendo del estadío de la enfermedad en el momento del diagnóstico (M.A. Gertz y R.A. Kyle, 70 MEDICINE 246-256 (1991) ) .
La amiloidosis AA se ha asociado habitualmente con la infección crónica (tal como tuberculosis) o con la inflamación crónica (tal como artritis reumatoide o fiebres hereditarias) . Una forma familiar de la amiloidosis AA es la fiebre del Mediterráneo familiar (FMF) . Este tipo de amiloidosis familiar se hereda genéticamente y se encuentra en grupos específicos de población. En la amiloidosis AL y AA, los depósitos se encuentran en algunos órganos y por tanto se consideran enfermedades amiloides sistémicas.
Las "amiloidosis localizadas" son aquellas que tienden a implicar un único sistema orgánico. Las diferentes amiloidosis se caracterizan también por el tipo de proteína presente en el depósito. Por ejemplo, enfermedades neurodegenerativas tales como temblores, encefalitis espongiforme bovina, enfermedad de Creutzfeldt-Jakob, y similares se caracterizan por la aparición y acumulación de una forma de una proteína priónica resistente a proteasa (denominada AScr o PrP-27) en el sistema nervioso central. De manera similar, la enfermedad de Alzheimer, otro trastorno neurodegenerativo, se caracteriza por placas neuríticas y ovillos neurofibrilares. En este caso, las placas amiloides se encuentran en el parénquima y los vasos sanguíneos se forman mediante la deposición de la proteína amiloide Aβ fibrilar. Otras enfermedades tales como la diabetes de inicio en adultos (diabetes de tipo II) se caracterizan por la acumulación localizada de fibrillas amiloides en el páncreas.
Una vez que se han formado estos amiloides, no existe terapia o tratamiento conocido ampliamente aceptado que disuelva significativamente los depósitos amiloides in situ, evite la deposición adicional de amiloide o evite el inicio de la deposición del amiloide.
Cada proteína amiloidogénica tiene la capacidad de experimentar un cambio conformacional y de organizarse en láminas β y formar fibrillas insolubles que pueden depositarse extracelular o intracelularmente. Cada proteína amiloidogénica, aunque diferente en su secuencia de aminoácidos, tiene la misma propiedad de formar fibrillas y de unirse a otros elementos tales como proteoglicano, amiloide P y el componente del complemento. Además, cada proteína amiloidogénica tiene secuencias de aminoácidos que, aunque diferentes, muestran similitudes tales como
regiones con la capacidad de unirse a la porción de glicosaminoglicano (GAG) del proteoglicano (denominado como sitio de unión a GAG) así como otras regiones que promueven la formación de láminas β. Los proteoglicanos son macromoléculas de diversos tamaños y estructuras que están distribuidas casi en cualquier parte del cuerpo. Se pueden encontrar en el compartimento intracelular, sobre la superficie de las células, y como parte de la matriz extracelular. La estructura básica de todos los proteoglicanos está comprendida por una proteína nuclear y al menos una, pero frecuentemente más, cadenas de polisacáridos (GAG) unidas a la proteína nuclear. Se han descubierto muchos GAG diferentes incluyendo sulfato de condroitina, sulfato de dermatán, sulfato de queratán, heparina, y hialuronano.
Se conocen algunos miméticos de GAG que son útiles para inhibir la deposición amiloide y/o tratar algunas formas de amiloidosis. Véanse los documentos WO 94/22437, WO 96/28187, y en el documento WO 00/64420.
Sumario de la invención La materia sujeto de la presente invención es una composición farmacéutica de acuerdo con la reivindicación 1, comprendiendo dicha composición farmacéutica el ácido 1, 3-propanodisulfónico o una de sus sales farmacéuticamente aceptables para su uso en un método para tratar o prevenir una enfermedad relacionada con la proteína amiloide en un sujeto, en la que el ácido 1, 3-propanodisulfónico o una de sus sales farmacéuticamente aceptables se administra a una dosificación de aproximadamente 1200 mg dos veces al día para un índice de aclaramiento de la creatinina de >80 ml/min, una dosificación de aproximadamente 800 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 30 y 80 ml/min, o una dosificación de aproximadamente 400 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 20 y 30 ml/min.
De acuerdo con la presente invención, la sal farmacéuticamente aceptable puede ser una sal disódica del ácido 1, 3-propanodisulfónico.
De acuerdo con la presente invención, la composición puede comprender además un vehículo farmacéuticamente aceptable.
De acuerdo con la presente invención, la enfermedad relacionada con la proteína amiloide puede ser la amiloidosis AA.
De acuerdo con la presente invención, la formulación farmacéutica puede administrarse sin alimento. La administración sin alimento puede dar como resultado un aumento en la biodisponibilidad de aproximadamente un 25 % o más en comparación con la administración con alimento. Por ejemplo, la formulación puede administrarse al menos 1 o 2 horas antes o después de cualquier comida. En particular, la formulación puede administrarse al menos 1
o 2 horas antes o después de cualquier comida.
En una realización, la aplicación... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica que comprende ácido 1, 3-propanodisulfónico o una de sus sales farmacéuticamente aceptables para su uso en un método para tratar o prevenir una enfermedad relacionada con la proteína amiloide en un sujeto, en donde el ácido 1, 3-propanodisulfónico o una de sus sales farmacéuticamente aceptables se administra a una dosificación de aproximadamente 1200 mg dos veces al día para un índice de aclaramiento de la creatinina de >80 ml/min, una dosificación de aproximadamente 800 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 30 y 80 ml/min o una dosificación de aproximadamente 400 mg dos veces al día para un índice de aclaramiento de la creatinina de entre aproximadamente 20 y 30 ml/min.
2. La composición farmacéutica para su uso de acuerdo con la reivindicación 1, en la que la sal farmacéuticamente aceptable es una sal disódica del ácido 1, 3-propanodisulfónico.
3. La composición farmacéutica para el uso de acuerdo con las reivindicaciones 1 o 2, en donde la composición 15 comprende adicionalmente un vehículo farmacéuticamente aceptable.
4. La composición farmacéutica para el uso de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en la que la enfermedad relacionada con la proteína amiloide es la amiloidosis AA.
5. La composición farmacéutica para el uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en la que la formulación farmacéutica es para administrarse sin alimentos.
6. La composición farmacéutica para su uso de acuerdo con la reivindicación 5, en la que la administración sin alimento da como resultado un aumento en la biodisponibilidad de aproximadamente un 25 % o más en comparación con la 25 administración con alimento.
7. La composición farmacéutica para su uso de acuerdo con la reivindicación 5, en la que la formulación se administra al menos 1 o 2 horas antes o después de cualquier comida.
8. La composición farmacéutica para su uso de acuerdo con la reivindicación 6, en la que la formulación se administra al menos 1 hora antes de una comida o al menos 2 horas después de una comida.
Patentes similares o relacionadas:
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]
Formulación de Mesna y su uso, del 29 de Abril de 2020, de AuXin Surgery SA: Un dispositivo para administrar una formulación de Mesna a tejidos y/u órganos, que comprende una primera cámara que comprende el Mesna en forma sólida, una segunda cámara […]
Composiciones para mejorar la viabilidad celular y los métodos de uso de las mismas, del 15 de Abril de 2020, de Amylyx Pharmaceuticals Inc: Una composición que comprende una cantidad efectiva de ácido tauroursodesoxicólico (TUDCA) o una sal farmacéuticamente aceptable del mismo, […]
Compuesto para su uso en la prevención y el tratamiento de enfermedades neurodegenerativas, del 8 de Abril de 2020, de Universität Wien: Un compuesto que comprende un esqueleto de calixareno para su uso en la prevención o el tratamiento de una enfermedad neurodegenerativa, en donde el compuesto es capaz […]
Nuevos enfoques terapéuticos para tratar la enfermedad de Alzheimer, del 4 de Marzo de 2020, de Pharnext: Una composición para uso en el tratamiento de la enfermedad de Alzheimer (EA) o un trastorno relacionado, que comprende al menos levosimendán, o una sal […]
Inhibidores de IRE 1 alfa, del 26 de Febrero de 2020, de Fosun Orinove Pharmatech, Inc: Compuesto que tiene una fórmula estructural seleccionada entre (3e), (3g) o (3h), cada una representada por: **(Ver fórmula)** o […]
Utilización de la taurina o derivados para el tratamiento de la alopecia, del 25 de Diciembre de 2019, de L'OREAL: Utilización cosmética de la taurina y/o de la hipotaurina y/o de sus sales aceptables, en asociación con al menos un polifenol y/o un extracto que lo […]