FORMULACIONES POLIMERICAS DE SUMINISTRO DE LEUPROLIDA CON EFICACIA MEJORADA.
Una composición fluible adecuada para uso como un implante de liberación controlado,
la composición comprende:
(a) Un poliéster termoplástico biodegradable que es al menos sustancialmente insoluble en un medio acuoso o fluido del cuerpo que es un copolímero de lacturo y glicoluro que tiene un grupo protector carboxi;
(b) Un disolvente aprótico polar biocompatible seleccionado del grupo que consiste de una amida, un éster, un carbonato, una cetona, un éter, y un sulfonilo; en donde el disolvente aprótico polar biocompatible es miscible a dispersable en medio acuoso o fluido del cuerpo; y
(c) Acetato de leuprolida
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05010806.
Solicitante: ATRIX LABORATORIES, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2579 MIDPOINT DRIVE,FORT COLLINS, COLORADO 80525-4.
Inventor/es: DUNN, RICHARD L., GARRETT, JOHN, S., RAVIVARAPU, HARISH, CHANDRASHEKAR, BHAGYA, L.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Septiembre de 2001.
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K47/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K9/00M5D
Clasificación PCT:
- A61K38/09 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona que libera a la hormona luteinizante [LHRH]; Péptidos relacionados.
- A61K47/34 A61K 47/00 […] › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Clasificación antigua:
- A61K38/09 A61K 38/00 […] › Hormona que libera a la hormona luteinizante [LHRH]; Péptidos relacionados.
- A61K47/34 A61K 47/00 […] › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Chipre.
Fragmento de la descripción:
Formulaciones poliméricas de suministro de leuprolida con eficacia mejorada.
Antecedentes de la invención
El acetato de leuprolida es un análogo agonista de LHRH que es útil en el tratamiento paliativo de cáncer de próstata relacionado con hormona, cáncer de mama, endometriosis, y pubertad precoz. Con el uso continuo, el acetato de leuprolida origina la desensibilización y la disminución de la pituitaria para afectar el eje pituitaria-gónadas, que conduce a niveles de circulación suprimidos de hormonas sexuales y leuteinizantes. En pacientes con cáncer de próstata avanzado, lograr niveles de testosterona en la circulación menor o iguales a 0.5 mg/ml (niveles de infestación químicos) es el indicador farmacológico deseado de acción terapéutica.
Originalmente, el acetato de leuprolida fue lanzado en los Estado unidos como inyección subcutánea diaria (S. C.) de la solución análoga. El inconveniente de las inyecciones crónicas repetitivas fue posteriormente eliminado mediante el desarrollo de un producto de depósito de liberación mensual sostenida a base de microesferas de poli (DL-lacturo-co-glicoluro) (Lupron®Depot). Habitualmente, uno, dos, tres y cuatro formulaciones mensuales están ampliamente disponibles como inyecciones intramusculares (i. m.) de microesferas.
Aunque las microesferas habituales Lupron®Depot parecen ser efectivas, los productos de microesfera son difíciles de elaborar, y ellos requieren todos una profunda inyección intramuscular (i. m.) utilizando grandes volúmenes de fluidos para asegurar que todas las microesferas se administran en forma adecuada al paciente.
Estas inyecciones son a menudo doloras y conducen a daño del tejido.
Los polímeros biodegradables diferentes del Lupron®Depot se han empleado en muchas aplicaciones médicas, que incluyen dispositivos de suministro de fármaco. El fármaco se incorpora generalmente en la composición polimérica y se conforma en la forma deseada por fuera del cuerpo. Estos implantes sólidos se insertan típicamente en el cuerpo de un humano, animal, ave y similar a través de una incisión.
Alternativamente, partículas discretas pequeñas compuestas de estos polímeros se pueden inyectar en el cuerpo mediante una jeringa. Preferiblemente, sin embargo, ciertos de estos polímeros se pueden inyectar a través de la jeringa como una composición polimérica líquida.
Se describen composiciones poliméricas líquidas útiles para sistemas de suministro de fármaco de liberación controlada biodegradables, por ejemplo, en las patentes U.S. Nos. 4,938,763; 5,702,716;5,702,716;5,744,153 ;5,990,149; y 5,324,519. Estas composiciones son administradas al cuerpo en un estado líquido, o, alternativamente, como una solución, típicamente a través de jeringa. Una vez en el cuerpo, la composición se coagula en un sólido. Un tipo de composición polimérica incluye un polímero termoplástico no reactivo o un copolímero disuelto en un disolvente dispersable del fluido del cuerpo. Esta solución polimérica se coloca en el cuerpo en donde los polímeros se coagulan o se solidifican en forma desencadenada luego de la disipación o difusión del disolvente en los tejidos circundantes del cuerpo. Se espera que estas composiciones sean tan efectivas como el Lupron®Depot debido a que la leuprolida de estas composiciones es igual que en el Lupron®Depot y los polímeros son similares.
La WO98/27962 describe geles de depósito inyectables. Un posible agente activo es la leuprolida.
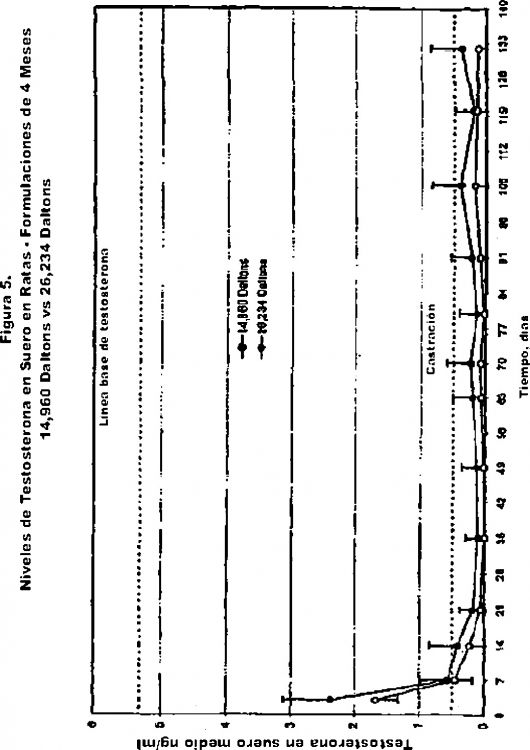
De manera sorprendente, sin embargo, se ha descubierto que las composiciones poliméricas líquidas de acuerdo con la presente invención son más efectivas para suministra acetato de leuprolida Lupron®Depot. Específicamente, los niveles de testosterona obtenidos en las composiciones poliméricas líquidas de la presente invención que contienen acetato de leuprolida son inferiores en tiempos prolongados en perros, comparados con la leuprolida Lupron®Depot y también en el punto de seis meses en humanos. Comparados con el valor reportado en la literatura para leuprolida Lupron®Depot (Sharifi, R., J. Urology, Volumen. 143, Jan., 68 (1990)).
Resumen de la presente invención
La presente invención suministra una composición fluible que es adecuada para uso como un implante de liberación controlado de acetato de leuprolida. La composición fluible incluye un poliéster termoplástico biodegradable que es al menos sustancialmente insoluble en un medio acuoso o el fluido del cuerpo. La composición fluible también incluye un disolvente aprótico polar biocompatible. El disolvente aprótico polar biocompatible puede ser una amida, un éster, un carbonato, una cetona, un éter, o un sulfonilo. El disolvente aprótico polar biocompatible es miscible a dispersable en medio acuoso o en fluido del cuerpo. La composición fluible también incluye acetato de leuprolida. El acetato de leuprolida está preferiblemente presente en aproximadamente 2% en peso a aproximadamente 4% en peso de la composición aproximadamente 4% en peso a aproximadamente 8% en peso en la composición. Preferiblemente, la composición fluible se formula como un sistema de suministro subcutáneo inyectable. La composición inyectable preferiblemente tiene un volumen de aproximadamente 0.20 mL a aproximadamente 0.40 mL o aproximadamente 0.30 mL a aproximadamente 0.50 mL. La composición inyectable se formula preferiblemente para administración aproximadamente una vez por mes, aproximadamente una vez cada tres meses, o aproximadamente una vez cada cuatro meses aproximadamente una vez cada seis meses.
Preferiblemente, la composición fluible es un líquido o una composición de gel, adecuado para inyectar a un paciente.
Preferiblemente, el poliéster termoplástico biodegradable es una polilactida, un poliglicoluro, a una policaprolactona, un copolímero de estos, un terpolímero de estos, o cualquier combinación de estos. Más preferiblemente, el poliéster termoplástico biodegradable es un polilacturo, un poliglicoluro, un copolímero de estos, o terpolímero de estos, o una combinación de estos. Más preferiblemente, el poliéster termoplástico biodegradable adecuado es 50/50 poli (DL-lacturo-co-glicoluro) que tiene un grupo carboxi Terminal o es 75/25 poli (DL-lacturo-co-glicoluro) con un grupo carboxi Terminal que está protegido. El poliéster termoplástico biodegradable adecuado puede estar presente en cualquier cantidad, siempre y cuando el poliéster termoplástico biodegradable sea al menos sustancialmente insoluble en medio acuoso o en el fluido del cuerpo. El poliéster termoplástico biodegradable adecuado está presente preferiblemente en aproximadamente 30% en peso a aproximadamente 40% en peso de la composición fluible o está presente en aproximadamente 40% en peso a aproximadamente 50% en peso de la composición fluible. Preferiblemente, el poliéster termoplástico biodegradable tiene un peso molecular promedio de aproximadamente 23,000 a aproximadamente 45,000 o aproximadamente 15,000 a aproximadamente 24,000.
Preferiblemente, el disolvente aprótico polar biocompatible es N-metil-2-pirrolidona, N,N-dimetilflormamide, dimetil sulfóxido, propil carbonato, caprolactama, triacetina, o cualquier combinación de estos. Más preferiblemente, el disolvente aprótico polar biocompatible es en N-metil-2-pirrolidona.
Preferiblemente, el disolvente aprótico polar está presente en aproximadamente 60% en peso a aproximadamente 70% en peso de la composición o está presente en aproximadamente 45% en peso a aproximadamente 55% en peso de la composición.
La presente invención también suministra un método para forma una composición fluible. La composición fluible es útil como un implante de liberación controlada. El método incluye mezclar o en cualquier otro orden, un poliéster termoplástico biodegradable, un disolvente aprótico polar biocompatible, y acetato de leuprolida. Estos ingredientes, sus propiedades, y las cantidades preferidas se describieron anteriormente. La mezcla se efectúa durante un periodo suficiente de tiempo efectivo para formar la composición fluible para uso como un implante de liberación controlada. Preferiblemente, el poliéster termoplástico biocompatible y el disolvente aprótico polar biocompatible se mezclan juntos para formar una mezcla y la mezcla es luego combinada luego con el acetato de leuprolida para formar una composición fluible.
La presente invención también suministra un implante biodegradable formado in situ, en un paciente. Del producto de implante biodegradable se prepara mediante el proceso de integrar una composición fluible dentro...
Reivindicaciones:
1. Una composición fluible adecuada para uso como un implante de liberación controlado, la composición comprende:
2. La composición de la reivindicación 1 en donde el grupo protector carboxi es un alquilo C1-C12 sustituido con uno o dos hidroxilos.
3. La composición de la reivindicación 2 en donde el alquilo es sustituido por dos hidroxilos
4. La composición de acuerdo con la reivindicación 1, 2, 3, en donde el poliéster termoplástico biodegradable está presente en una cantidad de 30% a 50% en peso, preferiblemente en 40% a 50% en peso de la composición.
5. La composición de la reivindicación 1, 2, 3, en donde el poliéster termoplástico biodegradable tiene un peso molecular promedio de 15,000 a 45,000 preferiblemente de 32,000 a 45,000.
6. La composición de la reivindicación 1, 2 o 3, en donde el disolvente aprótico polar biocompatible es N-mentil-2-pirrolidona, 2 -pirrolidona, N,N-dimetilfonamida, dimetil sulfóxido, propileno carbonado, caprolactama, tri acetina, o cualquier combinación de ellos.
7. La composición de la reivindicación 1, 2 o 3, en donde el disolvente aprótico polar biocompatible es N-mentil-2-pirrolidona.
8. La composición de la reivindicación 1, 2 o 3, en donde el disolvente aprótico polar biocompatible está presente en aproximadamente 60% en peso aproximadamente 70% en peso de la composición.
9. La composición de la reivindicación 1, 2 o 3, en donde el disolvente aprótico polar biocompatible está presente en aproximadamente 45% en peso aproximadamente 55% en peso de la composición.
10. La composición de la reivindicación 1, 2 o 3, en donde el acetato de leuprolida está presente en aproximadamente 2% en peso aproximadamente 4% en peso de la composición.
11. La composición de la reivindicación 1, 2 o 3, en donde el acetato de leuprolida está presente en aproximadamente 4% en peso aproximadamente 8% en peso de la composición.
12. La composición de la reivindicación 1, 2 o 3, que se formula como un sistema de suministro subcutáneo inyectable.
13. La composición de la reivindicación 12 que tiene un volumen de aproximadamente 0.20 mL a aproximadamente 0.40 mL.
14. La composición de la reivindicación 12 que tiene un volumen de aproximadamente 0.30 mL a aproximadamente 0.50 mL.
15. La composición de la reivindicación 12 que se formula para administración aproximadamente una vez cada cuatro meses a aproximadamente una vez cada seis meses.
16. La composición de la reivindicación 12 que se formula para administración aproximadamente cada cuatro o aproximadamente una vez cada tres meses.
17. Un método para formar una composición falible para uso como un implante de como un implante de liberación controlado, que comprende la etapa de mezclar, en cualquier orden;
En donde la mezcla se efectúa durante un periodo suficiente de tiempo efectivo para formar la composición fluible para uso como un implante de liberación controlado.
18. El método de la reivindicación 17 en donde el poliéster biocompatible y el disolvente aprótico a polar biocompatible se mezclan juntos para formar una mezcla y la mezcla luego se mezcla con el acetato de leuprolida para formar la composición fluible.
19. Uso de una composición se comprende un poliéster termoplástico biodegradable, disolvente aprótico a polar biocompatible y acetato de leuprolida para la elaboración de un medicamento para uso del tratamiento de cáncer en donde la composición es un implante biodegradable in situ de liberación controlada que solidifica una vez que se inyecta en el paciente formando un implante biodegradable; el poliéster termoplástico es un copolímero de lacturo y glicoluro que tiene un grupo protector carboxilo, el disolvente aprótico polar biocompatible es una amida, un Ester, un carbonato, una cetona, un Éter, y un sulfonilo, una combinación de los mismos y miscible o dispersable en medio acuso o fluido del cuerpo; y el tratamiento que comprende administrar una cantidad terapéuticamente efectiva de la composición a un paciente.
20. El uso de acuerdo con la reivindicación 19, en donde el paciente es un humano.
21. El uso de acuerdo con la reivindicación 19, en donde el cáncer es cáncer de próstata.
22. Un kit que comprende:
23. El kit de la reivindicación 22 en donde el primer y segundo recipiente son jeringas.
24. El kit de la reivindicación 22 o 23 en donde el acetato de leuprolida es liofilizado.
25. El kit de la reivindicación 22, 23 o 24 en donde el primer recipiente se puede conectar al segundo recipiente directamente.
26. Un implante sólido que comprende:
27. El implante sólido de la reivindicación 26 que comprende además un disolvente orgánico biocompatible que es miscible a dispersable en fluido dispersable en medio acuso o fluido del cuerpo y disuelve el poliéster termoplástico.
28. El implante sólido de la reivindicación 27 en donde la cantidad de disolvente orgánico biocompatible es mínima.
29. El implante sólido de la reivindicación 27 en donde la cantidad de disolvente orgánico biocompatible disminuye durante el tiempo.
Patentes similares o relacionadas:
Nanopartículas estabilizadas con composiciones de ácido nitrofenilborónico, del 15 de Julio de 2020, de CALIFORNIA INSTITUTE OF TECHNOLOGY: Una nanopartícula que comprende un polímero que contiene un poliol y un polímero que contiene un ácido nitrofenilborónico, en donde el polímero que contiene […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Microesferas o micropartículas biodegradables o bioerosionables de liberación con el tiempo en suspensión en una formulación de fármaco inyectable de formación de depósito solidificante, del 8 de Julio de 2020, de ALLERGAN, INC.: Material compuesto para la administración de fármacos, que comprende: una pluralidad de micropartículas dispersas en una composición de medios; en el que las micropartículas […]
Composiciones biodegradables adecuadas para liberación controlada, del 24 de Junio de 2020, de Ingell Technologies Holding B.V: Composición que comprende un copolímero de bloques triples según la fórmula 1 B-A-B en la que A representa un bloque de poli-(etilenglicol) lineal […]
Emulsión de aceite en agua de monetasona y propilenglicol, del 24 de Junio de 2020, de Galenica AB: Un método para preparar una emulsión de aceite en agua que comprende furoato de mometasona, comprendiendo el método a) preparar una fase oleosa mezclando […]
Métodos de tratamiento de afecciones oculares con un implante de administración sostenida de medicamento, del 17 de Junio de 2020, de ALLERGAN, INC.: Implante bioerosionable para su uso en un método para tratar edema macular diabético (EMD), comprendiendo el método inyectar dicho implante bioerosionable en el vítreo de un […]
Polimerosomas de gradiente de pH transmembrana y su uso en la eliminación del amoníaco y sus análogos metilados, del 27 de Mayo de 2020, de ETH ZURICH: Un polimerosoma que comprende (a) una membrana, que comprende un copolimero en bloque de poli(estireno) (PS) y poli(oxido de etileno) (PEO), en […]
FORMA FARMACEUTICA MICROCAPSULADA EN POLVO QUE COMPRENDE UNA CORONA EXTERNA Y UN NUCLEO CON NANOPARTICULAS, del 30 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presenta tecnología corresponde a una forma farmacéutica en polvo con una conformación espacial de forma microcapsular, la cual comprende una corona […]