Formulaciones líquidas de carbocisteína de propiedades mejoradas.
Formulaciones líquidas de carbocisteína de estabilidad y cualidades organolépticas mejoradas.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201201252.
Solicitante: ITF RESEARCH PHARMA, S.L.U.
Nacionalidad solicitante: España.
Inventor/es: PÉREZ HERNANDO,Elena, RAMÍREZ UÑA,Silvia Jezabel.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/198 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Alfa-amino-ácidos, p. ej. alanina, ácido etilendiamino tetraacético (EDTA) (betaína A61K 31/205; prolina A61K 31/401; triptófano A61K 31/405; histidina A61K 31/4172; péptidos no degradados en aminoácidos individuales A61K 38/00).
PDF original: ES-2478692_A1.pdf
Fragmento de la descripción:
FORMULACIONES LÍQUIDAS DE CARBOCISTEÍNA DE PROPIEDADES MEJORADAS
La presente invención se refiere a formulaciones liquidas de carbocisteina de estabilidad y cualidades organolépticas mejoradas.
ESTADO DE LA TÉCNICA
La carbocisteina, también conocida como S-carboxi metil)-L-cisteina o 3[(carboximetil)tio]alanina, es un fármaco mucolitico y expectorante, indicado para el tratamiento de enfermedades del tracto respiratorio caracterizadas por producción de mucosidad excesiva y viscosa.
NH2
La carbocisteina es administrada oralmente en forma sólida o líquida, por ejemplo en comprimidos, cápsulas y jarabes.
Las formulaciones liquidas de carbocisteina son preferidas porque suelen ser mejor aceptadas por los pacientes, pero tienen la desventaja de presentar tiempos de conservación relativamente cortos debido al descenso del titulo de carbocisteina por debajo de especificaciones, la aparición de productos de degradación y, en el caso de soluciones azucaradas, la alteración de las propiedades organolépticas, en particular su oscurecimiento.
Como productos de degradación de la carbocisteina en solución han sido identificados el ácido 4H-1,4-tiazin- 3-ona-5-carboxílico (de aquí en adelante denominado DF 1247) y el S-carboximetil-L-cistein(±)sulfóxido (de aquí en más DF 1860).
RESUMEN DE LA INVENCIÓN
Existe por tanto la necesidad de disponer de formulaciones liquidas de carbocisteina que durante un tiempo más prolongado:
- mantengan el titulo de principio activo dentro de especificaciones,
- no muestren oscurecimiento.
Los inventores de la presente han encontrado que una cuidadosa selección de excipientes y un estricto mantenimiento del pH dentro de ciertos limites permite obtener soluciones acuosas de carbocisteina que cumplen con estos objetivos.
Por una parte han encontrado que, sorprendentemente, el mantenimiento del pH entre 6,5 y 7,25, más preferiblemente entre 6,8 y 7,0 permite un control óptimo de la estabilidad.
Por otra parte han visto que la sustitución del azúcar (sacarosa) por un edulcorante evita el oscurecimiento de la solución.
En consecuencia, un primer aspecto de la presente invención se refiere a formulaciones farmacéuticas orales liquidas que contienen carbocisteina junto con al menos un sistema regulador de pH y al menos un edulcorante.
Un segundo aspecto de la presente invención se refiere al uso de dichas soluciones de carbocisteina en la prevención o el tratamiento de enfermedades del tracto respiratorio caracterizadas por secreción mucosa excesiva y viscosa.
FIGURAS
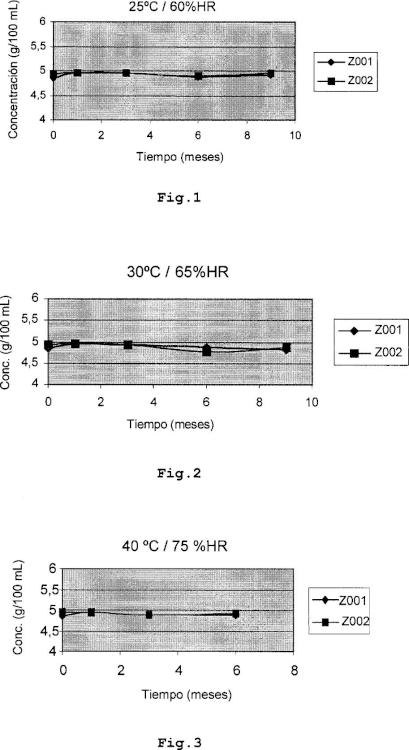
Fig.l: Concentración de carbocisteina en función del
tiempo en soluciones mantenida a 25 °C de temperatura y 60 % de humedad relativa.
Fig.5: Concentración de carbocisteina en función del
tiempo en soluciones a 30 °C y 65 %HR.
Fig.6: Concentración de carbocisteina en función del
tiempo en soluciones a 40 °C y 75 %HR.
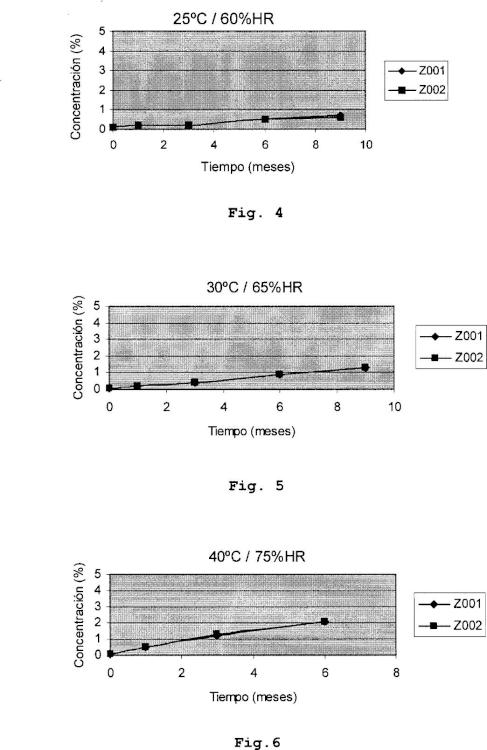
Fig.4: Concentración del producto de degradación DF-
1247 en función del tiempo en soluciones de carbocisteina mantenida a 25 °C y 60 %HR.
Fig.5: Concentración de DF-1247 en función del tiempo en soluciones de carbocisteina a 30 °C y 65 %HR.
Fig.6: Concentración de DF-1247 en función del tiempo
en soluciones de carbocisteina a 40 °C y 75 %HR.
DESCRIPCIÓN DETALLADA
Las formulaciones liquidas de la presente invención comprenden:
carbocisteina;
al menos un agente regulador de pH; al menos un edulcorante; al menos un disolvente.
En una realización preferida, el disolvente es agua.
La concentración de carbocisteina en la solución puede ser cualquiera que permita la administración de una dosis eficaz y no tóxica al paciente.
El limite inferior de dicha concentración viene determinado por la menor cantidad de fármaco que
resulte práctica para preparar soluciones a ser administradas a un paciente y puede ser fácilmente determinado por un experto en la materia. El limite superior está condicionado por la concentración de precipitación del fármaco.
Preferiblemente, la concentración de carbocisteina está entre 2,5 % y 12 % (p/v); más preferiblemente aún entre 5 % y 10 % (p/v).
El agente regulador de pH es elegido entre cualquiera de los farmacéuticamente aceptables conocidos por un experto en la materia.
En una realización preferida, el sistema regulador de pH es un tampón fosfato en una cantidad no tóxica y eficaz para mantener el pH entre 6,5 y 7,25, más preferiblemente entre 6,8 y 7,0.
Más preferiblemente, es una sal de fosfato bibásico en una concentración entre 0,1 % y 0,5 % (p/v), preferiblemente entre 0,15 % y 0,25 % (p/v), más preferiblemente aún es 0,2 ± 5 % (p/v).
El edulcorante es preferiblemente un edulcorante de sabor intenso elegido entre el grupo formado por aspartamo, sacarina sódica, ciclamato sódico, acesulfamo potásico y sus mezclas.
En una realización más preferida, el edulcorante de sabor intenso es seleccionado entre sacarina sódica, ciclamato sódico y sus mezclas en una cantidad eficaz y no tóxica.
Preferiblemente, la sacarina sódica es utilizada en una concentración entre 0,07 % y 0,3 % (p/v), más preferiblemente aún entre 0,07 % y 0,1 % (p/v). El ciclamato sódico es empleado en una concentración entre 0,1 % y 0,5 % (p/v), más preferiblemente aún entre 0,3 % y 0,5 % (p/v).
Las formulaciones líquidas de la presente invención pueden contener además otros excipientes farmacéuticamente aceptables, por ejemplo agentes saborizantes, colorantes, reguladores de la viscosidad y conservantes.
Preferiblemente, las formulaciones contienen un agente conservante seleccionado entre p-hidroxibenzoato de metilo (metilparaben), p-hidroxibenzoato de propilo (propilparaben) y sus mezclas en una cantidad no tóxica y eficaz para asegurar la estabilidad y evitar la contaminación de la solución.
Más preferiblemente, el conservante es metilparaben en una concentración entre 0,1 % y 0,3 % (p/v) , de forma más preferida aún entre 0,15 % y 0,3 % (p/v).
Tanto los excipientes como el principio activo utilizados en estas formulaciones son conocidos y pueden ser obtenidos de fuentes comerciales.
Las formulaciones líquidas de la presente invención se pueden preparar utilizando cualquiera de las técnicas conocidas por un experto en la materia.
Por ejemplo, añadir agua a un reactor hasta alcanzar una parte del volumen final, añadir una base y agitar hasta su completa disolución. A continuación ir incorporando uno a uno los demás componentes de la formulación: carbocisteína, agente regulador del pH, edulcorante(s) y, opcionalmente, los demás ingredientes agitando hasta completa disolución de cada uno de ellos antes de incorporar el siguiente.
En caso de ser necesario añadir un agente viscosante, se puede dispersar previamente en agua en un reactor auxiliar hasta obtener una dispersión homogénea y
traslúcida e incorporarlo al reactor principal bajo agitación.
Finalmente, homogeinizar la solución resultante y comprobar el pH. En caso de que éste caiga fuera del rango 6,8 ± 0,2, ajustar con soluciones ácidas o
básicas, según proceda. Por último, enrasar al volumen final de la solución.
EJEMPLOS
La invención se ilustra con los siguientes ejemplos no limitativos:
Ejemplo 1. Solución de carbocisteina 5 %
Concentración % (p/v)
| Carbocisteina | |
| Fosfato sódico dibásico | 0,2 |
| Sacarina sódica | 0,08 |
| Ciclamato sódico | 0,5 |
| Sal sódica de p-hidroxibenzoato de metilo | 0,17 |
| Esencia de frambuesa | 0,07 |
| Rojo punzó | 0,004 |
| Hidróxido sódico 1 | 2,26 |
| Ácido cítrico anhidro 1 | 0,08 |
| Natrosol HHX | 0,3 |
| Agua purificada | csp 100 mi |
1 La solución podrá llevar hidróxido sódico o ácido cítrico adicional para ajustar el pH
Ejemplo 2. Ensayos de estabilidad de soluciones de carbocisteina 5%
Para determinar la estabilidad se mantienen muestras de soluciones preparadas de acuerdo con el procedimiento antes descrito, denominadas Z001 y Z002, bajo diferentes condiciones atmosféricas.
Cada 3 meses se toman alicuotas de dichas muestras... [Seguir leyendo]
Reivindicaciones:
1. Formulaciones liquidas de carbocisteina que comprenden:
carbocisteina;
al menos un agente regulador de pH; al menos un edulcorante; al menos un disolvente.
2. Formulaciones de acuerdo con la reivindicación 1
caracterizadas porque el disolvente es agua.
3. Formulaciones de acuerdo con la reivindicación 1
caracterizadas porque el agente regulador de pH es un tampón fosfato.
4. Formulaciones de acuerdo con la reivindicación 1
caracterizada porque el edulcorante es elegido del
grupo formado por aspartamo, sacarina sódica, ciclamato sódico, acesulfamo sódico y sus mezclas.
5. Formulaciones de acuerdo con la reivindicación 4
caracterizada porque el edulcorante es seleccionado
entre sacarina sódica, ciclamato sódico y sus mezclas.
6. Formulaciones de acuerdo con la reivindicación 1 que opcionalmente comprende un agente conservante.
7. Formulaciones de acuerdo con la reivindicación 6
caracterizada porque el agente conservante es seleccionado entre p-hidroxibenzoato de metilo, p- hidroxibenzoato de propilo y sus mezclas.
8. Uso de las formulaciones de una cualquiera de las reivindicaciones anteriores en la preparación de un medicamento para el tratamiento o la prevención de enfermedades del tracto respiratorio caracterizadas por 5 producción de mucosidad excesiva y viscosa.
Patentes similares o relacionadas:
Derivados de amida de aminoácidos N-urea sustituidos como moduladores del receptor análogo al receptor 1 de péptido formilado (FPRL-1), del 1 de Julio de 2020, de ALLERGAN, INC.: Compuesto para usar en el tratamiento de un trastorno asociado con la modulación del receptor análogo al receptor 1 de péptido N-formilado representado por la fórmula […]
Formulaciones líquidas de levotiroxina, del 17 de Junio de 2020, de TAP Pharmaceuticals AG: Una disolución farmacéutica que comprende: - de 0,001 % p/v a 0,01 % p/v de una levotiroxina; - al menos 70 % p/p de glicerol; - menos del 30 % p/p […]
Composiciones dietéticas y métodos de protección contra la quimioterapia o radioterapia, del 17 de Junio de 2020, de University Of Southern California, USC Stevens: Una composición dietética para su uso en un método de protección de un animal o humano contra la quimioterapia o radioterapia, incluida la administración […]
Derivados de celastrol para el tratamiento de la obesidad, del 3 de Junio de 2020, de THE CHILDREN'S MEDICAL CENTER CORPORATION: Una formulación farmacéutica para su uso en inducir pérdida de peso o reducir la grasa corporal, o una combinación de las mismas, en un paciente pre-obeso, obeso […]
Composiciones de polifenol, del 3 de Junio de 2020, de Nugerontix Limited: Enoteína B para uso en terapia para tratar, prevenir o retrasar la aparición de disfunción endotelial donde el tratamiento, prevención o retraso comprende […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Formulaciones farmacéuticas que incluyen un compuesto de amina, del 13 de Mayo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un comprimido revestido que comprende: (a) un núcleo de comprimido en donde el núcleo de comprimido comprende (i) opcionalmente al menos un agente antidiabético […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]