FORMULACIONES FARMACEUTICAS QUE COMPRENDEN UN AGONISTA DE BETA2 DE ACCION PROLONGADA PARA SU ADMINISTRACION MEDIANTE NEBULIZACION.
Formulación farmacéutica sin propelente, líquida en forma de preparación lista para su uso para su administración mediante nebulización,
que comprende:
i) una sal soluble en agua fisiológicamente aceptable de 8-hidroxi-5-[(1R)-1-hidroxi-2-[[(1R)-2-(4-metoxifenil)-1-metiletil]amino]etil]-2(1H)-quinolinona (carmoterol) como principio activo;
ii) un disolvente seleccionado de agua o una disolución acuosa que comprende al menos el 50% v/v de agua y un codisolvente miscible con agua;
iii) un agente de tamponamiento en la que el pH de la disolución está comprendido entre 4,0 y 5,0 y el agente de tamponamiento comprende ácido cítrico
Tipo: Resumen de patente/invención. Número de Solicitud: W06007322EP.
Solicitante: CHIESI FARMACEUTICI S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIA PALERMO, 26/A,I-43100 PARMA.
Inventor/es: SOLIANI RASCHINI,ANNAMARIA, BODRIA,ALESSANDRO.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A61K31/4704 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 2-Quinolonas, p. ej. carboestirilo.
- A61K9/00M20B
Clasificación PCT:
- A61K31/4704 A61K 31/00 […] › 2-Quinolonas, p. ej. carboestirilo.
- A61K47/12 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Acidos carboxílicos; Sus sales o anhídridos.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
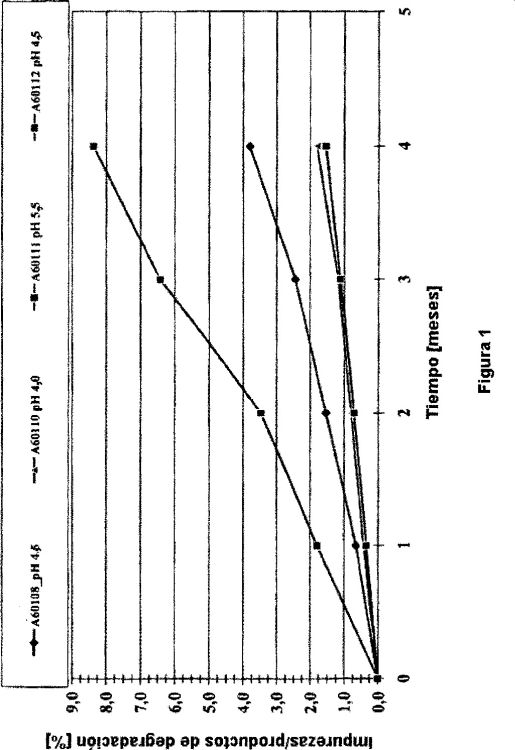
Fragmento de la descripción:
Formulaciones farmacéuticas que comprenden un agonista de beta2 de acción prolongada para su administración mediante nebulización.
La invención se refiere a una formulación farmacéutica sin propelente, líquida en forma de preparación lista para su uso para su administración mediante nebulización que comprende una sal soluble en agua del agonista de beta2 8-hidroxi-5-[1-hidroxi-2-[[2-(4-metoxifenil)-1-metiletil]amino]etil]-2(1H)-quinolinona como principio activo. El principio activo es químicamente estable en la formulación, y dicha formulación está dotada de una vida útil de almacenamiento adecuada para el uso, el almacenamiento y la distribución comerciales.
Antecedentes de la invención
La obstrucción de las vías respiratorias caracteriza a varias enfermedades respiratorias graves incluyendo asma y enfermedad pulmonar obstructiva crónica (EPOC).
En particular, el asma es una enfermedad que está volviéndose cada vez más corriente y es la enfermedad más común de la infancia.
Puesto que el factor más importante en su tratamiento es lograr la relajación de las células del músculo liso bronquial, los compuestos que tiene actividad agonista del receptor adrenérgico beta2 (a continuación en el presente documento agonistas de beta2) son los fármacos de elección para el tratamiento de un estado de este tipo.
Estos agonistas de beta2 incluyen compuestos que pertenecen a la clase de derivados de fenilalquilamino de primera generación tales como salbutamol, procaterol, fenoterol y terbutalina y de segunda generación (agonistas de beta2 de acción prolongada) tales como formoterol {2-hidroxi-5-((1RS)-1-hidroxi-2-(((1RS)-2-(p-metoxifenil)-1-metiletil)amino)etil)formanilida)} y salmeterol, que superan la desventaja de la corta duración de la acción particularmente para pacientes con asma nocturna.
Los agonistas de beta2 se administran actualmente mediante administración pulmonar que se basa en la inhalación de un aerosol a través de la boca y la garganta de modo que la sustancia farmacológica pueda alcanzar los pulmones. Una de las ventajas de la vía inhalatoria con respecto a la sistémica es la posibilidad de administrar el fármaco directamente al sitio de acción, evitando cualquier efecto secundario sistémico, dando como resultado por tanto una respuesta clínica más rápida y un mayor índice terapéutico.
El fármaco puede administrarse como una formulación líquida (acuosa o hidroalcohólica) a través de un nebulizador, como un polvo seco por medio de un inhalador de polvo seco (DPI) o en un propelente de hidrocarburo halogenado que requiere un inhalador presurizado de dosis medida (pMDI) adecuado que libera una dosis medida de medicamento tras cada accionamiento.
Las formulaciones líquidas, en particular formulaciones acuosas, son fáciles de administrar ya que se inhalan durante la respiración normal a través de una boquilla o máscara facial. Por tanto, son particularmente adecuadas para las personas jóvenes y ancianas que son lo más a menudo los pacientes que necesitan tal tratamiento y que experimentan dificultades al usar otros dispositivos.
8-Hidroxi-5-[1-hidroxi-2-[[2-(4-metoxifenil)-1-metiletil]amino]etil]-2(1H)-quinolinona de fórmula I
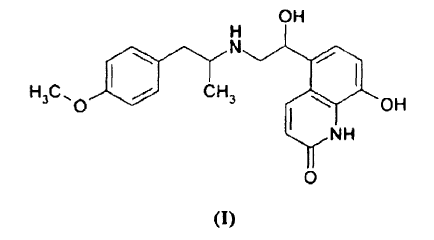
El compuesto de quinolinona de fórmula I puede estar en forma de una mezcla de cuatro estereoisómeros o en forma de una mezcla de dos estereoisómeros, tal como una mezcla de los estereoisómeros (R)(R) y (R)(S) (significando la expresión estereoisómero (R)(S) que el átomo de carbono asimétrico en la posición -CH(CH3)- tiene configuración (R) y el átomo de carbono asimétrico en la posición -CH(OH)- tiene configuración (S)). En una realización preferida, la quinolinona (I) está en forma del enantiómero (R)(R) puro (a continuación en el presente documento indicado con la denominación común internacional (INN) recomendada, carmoterol) que es un agonista de beta2 de acción prolongada sumamente potente caracterizado también por un rápido comienzo de la acción, dado a conocer por primera vez en el documento EP 147719.
En la técnica anterior, su sal de clorhidrato también se ha denominado TA 2005 o CHF 4226.
Desde un punto de vista químico, el carmoterol es un derivado de 2(1H)-quinolinona/carboestirilo caracterizado por la presencia de un anillo de 8-hidroxi-2(1H)-quinolinona/carboestirilo y una cadena lateral de 1-hidroxi-2-[2-(4-metoxifenil)-1-metiletil]amino]etilo.
Como otros agonistas de beta2, el carmoterol puede experimentar problemas de estabilidad química en disolución. En particular, el carmoterol experimenta oxidación del grupo hidroxilo presente en la cadena lateral de alquilamino de la molécula. La oxidación, que va seguida de la escisión de la molécula, está catalizada principalmente por oxígeno molecular y/o impurezas de iones de metales pesados tales como iones férricos que están presentes en la disolución.
Por otra parte, su estructura química puede explicar una tasa de degradación diferente y más y diferentes mecanismos de descomposición con respecto a otros derivados de fenilalquilamino.
Además, el carmoterol está dotado de una potencia particularmente alta, por tanto se formula a una concentración muy baja. Se sabe bien que cuanto más diluido esté el principio activo en la disolución, mayores son los problemas de estabilidad química.
Por tanto, sería sumamente ventajoso encontrar condiciones adecuadas para proporcionar formulaciones líquidas sin propelente, en particular acuosas, en las que el carmoterol sería químicamente estable.
Técnica anterior
El documento EP 147719 dio a conocer por primera vez derivados de carboestirilo y sales de los mismos a cuya fórmula general pertenece el carmoterol. Sólo se notificó información genérica sobre las formulaciones.
Los documentos EP 1157689 y WO 2005/084640 tratan de formulaciones en disolución farmacéutica de aerosoles que van a usarse con inhaladores presurizados de dosis medida (MDI) en las que los agonistas de beta2 que pertenecen a la clase de derivados de fenilalquilamino tales como TA 2005 y formoterol en disolución en un propelente HFA y un codisolvente se estabilizan añadiendo ácido mineral.
Los documentos WO2005/013994 y WO2005/013945 a nombre de Boehringer se refieren a composiciones farmacéuticas que van a administrarse mediante inhalación que comprenden un agonista de beta2 cuya fórmula corresponde a carmoterol, o un enantiómero del mismo, en combinación con agentes anticolinérgicos y esteroides, respectivamente.
Sólo se proporciona una enseñanza genérica y amplia en lo que se refiere a las formulaciones adecuadas para la inhalación. En lo que se refiere a las formulaciones que pueden inhalarse sin propelente, se proponen muchos tipos de posibles formulaciones que contienen una amplia gama de excipientes.
El pH puede ajustarse usando ácidos o bien orgánicos o bien inorgánicos.
Ácidos inorgánicos preferidos son ácidos clorhídrico y sulfúrico, mientras que el ácido ascórbico, ácido fumárico y ácido cítrico son los ácidos orgánicos preferidos.
Se prefiere particularmente el uso de ácido clorhídrico.
El documento WO 02/083079 ('079) a nombre de Dey da a conocer formulaciones en forma de una disolución de agentes broncodilatadores tales como agonistas de beta2 en un fluido farmacológicamente adecuado que contiene agua, que son estables durante el almacenamiento a largo plazo.
Las composiciones pueden contener un tampón. Se proporciona una larga lista de posibles tampones. En una realización, el tampón es tampón ácido cítrico/fosfato, tampón acetato, tampón citrato o tampón fosfato. En otra realización, el tampón es un tampón citrato (ácido cítrico/citrato de sodio).
Las composiciones específicas y la descripción que permite su reproducción sólo se proporcionan para formoterol:
Reivindicaciones:
1. Formulación farmacéutica sin propelente, líquida en forma de preparación lista para su uso para su administración mediante nebulización, que comprende:
en la que el pH de la disolución está comprendido entre 4,0 y 5,0 y el agente de tamponamiento comprende ácido cítrico.
2. Formulación farmacéutica según la reivindicación 1, en la que la sal de carmoterol se selecciona del grupo que consiste en sales con ácidos inorgánicos, tales como sales de clorhidrato, bromhidrato, fosfato y sulfato y sales con ácidos orgánicos, tales como sales de salicilato, citrato, tartrato y mandelato.
3. Formulación farmacéutica según la reivindicación 2, en la que la sal es la sal de clorhidrato, denominada CHF 4226.
4. Formulación farmacéutica según una cualquiera de las reivindicaciones 1 a 3, en la que la concentración de la sal de carmoterol soluble en agua corresponde a un porcentaje p/v de base libre de carmoterol comprendido entre el 0,0001 y el 0,004%.
5. Formulación farmacéutica según la reivindicación 4, en la que la concentración de la sal está comprendida entre el 0,0003 y el 0,002%.
6. Formulación farmacéutica según la reivindicación 5, en la que la concentración de la sal está comprendida entre el 0,0005 y el 0,001%.
7. Formulación farmacéutica según una cualquiera de las reivindicaciones anteriores, en la que el pH de la disolución está comprendido entre 4,0 y 4,5.
8. Formulación farmacéutica según una cualquiera de las reivindicaciones anteriores, en la que el agente de tamponamiento se selecciona del grupo que consiste en el par ácido cítrico/citrato de sodio (tampón citrato) o ácido cítrico/fosfato de disodio.
9. Formulación farmacéutica según la reivindicación 8, en la que el agente de tamponamiento está presente en una concentración comprendida entre 0,1 y 20 mM.
10. Formulación farmacéutica según la reivindicación 9, en la que la concentración está comprendida entre 1 y 15 mM.
11. Formulación farmacéutica según la reivindicación 10, en la que la concentración está comprendida entre 2 y 10 mM.
12. Formulación farmacéutica según una cualquiera de las reivindicaciones anteriores, en la que el disolvente comprende sólo agua.
13. Formulación farmacéutica según la reivindicación 12, que contiene además un agente de ajuste de la tonicidad con el fin de proporcionar una osmolaridad que oscila entre 250 y 450 mOsm/l.
14. Formulación farmacéutica según la reivindicación 13, en la que el agente de ajuste de la tonicidad es cloruro de sodio.
15. Formulación farmacéutica según una cualquiera de las reivindicaciones 1 a 11, en la que el codisolvente es un compuesto polar que contiene uno o más grupos hidroxilo.
16. Formulación farmacéutica según la reivindicación 15, en la que el compuesto polar es propilenglicol.
17. Formulación farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende además un principio activo adicional suspendido o disuelto en el disolvente.
18. Formulación farmacéutica según la reivindicación 17, en la que el principio activo adicional es un corticosteroide.
19. Formulación farmacéutica según la reivindicación 17, en la que el principio activo adicional es un fármaco antimuscarínico/anticolinérgico.
20. Uso de la formulación farmacéutica según una cualquiera de las reivindicaciones anteriores para la fabricación de un medicamento para la prevención o el tratamiento de una enfermedad caracterizada por la obstrucción reversible de las vías respiratorias.
21. Uso según la reivindicación 20, en el que la enfermedad es asma o enfermedad pulmonar obstructiva crónica (EPOC).
22. Kit que comprende:
Patentes similares o relacionadas:
Moléculas pequeñas para inhibir la actividad de las quimiocinas y/o el crecimiento de células cancerosas, del 15 de Julio de 2020, de Biokine Therapeutics Ltd: Un compuesto representado por la Fórmula Ia y/o Ib: **(Ver fórmula)** en donde: A es un alquilo que tiene al menos 4 átomos de carbono de longitud, seleccionándose […]
Composición farmacéutica administrable por vía oral para la prevención o el tratamiento del síndrome del ojo seco, que comprende rebamipida o un profármaco de la misma, del 3 de Junio de 2020, de Samjin Pharmaceutical Co., Ltd: Profármaco de rebamipida seleccionado entre el grupo que consiste en los compuestos de las Fórmulas Químicas II a VII: **(Ver fórmula)** o una sal farmacéuticamente […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Formulación que comprende glicopirrolato, método y aparato, del 25 de Marzo de 2020, de VECTURA LIMITED: Un método de preparación de una formulación en polvo seco, comprendiendo el método la molienda conjunta por chorro de glicopirrolato sin micronizar […]
Derivados de piridin-2-(1H)-ona-quinolinona como inhibidores de isocitrato dehidrogenasa mutante, del 19 de Febrero de 2020, de Forma Therapeutics, Inc: Una composición farmacéutica que comprende el compuesto de Fórmula I-13 o una sal farmacéuticamente aceptable del mismo y un portador farmacéuticamente aceptable: **(Ver […]
Composición farmacéutica que contiene glicopirrolato y un agonista de receptores adrenérgicos beta-2, del 11 de Diciembre de 2019, de NOVARTIS AG: Un medicamento que comprende, por separado o juntos, (A) glicopirrolato; y (B) un compuesto de formula I **(Ver fórmula)** en forma […]
Formulación superfina de formoterol, del 11 de Septiembre de 2019, de CHIESI FARMACEUTICI S.P.A.: Una formulación farmacéutica en aerosol para su administración mediante un inhalador presurizado de dosis medida, que comprende como ingredientes activos fumarato […]
Derivados de ciclohexil y quinuclidinil carbamato que tienen actividades de agonista beta2 adrenérgicos y antagonistas muscarínicos M3, del 4 de Septiembre de 2019, de ALMIRALL, S.A: Un compuesto de Fórmula (I), o una sal farmacéuticamente aceptable o derivado deuterado del mismo:**Fórmula** en la que, R representa un átomo de hidrógeno […]