FORMULACIONES FARMACEUTICAS DE AGENTES DE APERTURA DE CANALES DE POTASIO DEPENDIENTES DE ATP Y USOS DE LOS MISMOS.
Una formulación farmacéutica de liberación retardada de un agente de apertura de canales KATP de
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/030481.
Solicitante: ESSENTIALIS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 7915 CORTE CARDO, CARLSBAD, CA 92009.
Inventor/es: COWEN, NEIL, M., KASHKIN,KENNETH,B.
Fecha de Publicación: .
Fecha Concesión Europea: 7 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/655 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos azoicos (—N=N—), diazóicos (=N 2 ), azoxi ( N—O—N o N(=O)—N ), azido (—N 3 ) o diazoamino (—N=N—N ).
- A61K9/00L4
- A61K9/20H6F2
- A61K9/50H6B
Clasificación PCT:
- A61K31/549 A61K 31/00 […] › teniendo varios átomos de nitrógeno en el mismo ciclo, p. ej. hidroclorotiazida.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/24 A61K 9/00 […] › en dosis unitarias constituidas por capas u hojas.
- A61K9/26 A61K 9/00 […] › Partículas distintas en una matriz soporte.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/32 A61K 9/00 […] › que contienen polímeros sintéticos sólidos.
- A61K9/36 A61K 9/00 […] › que contienen hidratos de carbono o sus derivados (A61K 9/34 tiene prioridad).
- A61K9/52 A61K 9/00 […] › del tipo con liberación prolongada o discontinua.
- A61K9/58 A61K 9/00 […] › que contienen polímeros sintéticos sólidos.
- A61K9/62 A61K 9/00 […] › que contienen hidratos de carbono o sus derivados (A61K 9/60 tiene prioridad).
Fragmento de la descripción:
Formulaciones farmacéuticas de agentes de apertura de canales de potasio dependientes de ATP y usos de los mismos.
Campo de la invención
La presente invención se refiere a formulaciones farmacéuticas de agentes de apertura de canales de potasio dependientes de ATP (KATP) y a su uso para el tratamiento de diversas enfermedades y afecciones tales como la diabetes y la obesidad.
Antecedentes de la invención
La siguiente descripción de los antecedentes de la invención se proporciona simplemente como ayuda a la comprensión de la invención y no se admite que describa o constituya técnica anterior a la invención.
Los canales de potasio sensibles a ATP (KATP) desempeñan papeles importantes en una diversidad de tejidos por acoplamiento del metabolismo celular a la actividad eléctrica. El canal KATP se ha identificado como un complejo octamérico de dos proteínas no relacionadas que se ensamblan en una estequiometría 4:4. La primera es una subunidad formadora de poros, Kir6.x, que forma un canal de K+ rectificador hacia dentro; la segunda es un transportador ABC (casete de unión a ATP), también conocido como el receptor de sulfonilurea (SURx) (Babenko y col., Annu. Rev. Physiol., 60: 667-687 (1998)). La subunidad formadora de poros Kir6.x es común para muchos tipos de canales KATP y tiene dos supuestos dominios transmembrana (identificados como TM1 y TM2), que están unidos mediante un bucle de poro (H5). La subunidad que comprende el receptor SUR incluye múltiples dominios transmembrana y dos plegamientos de unión a nucleótidos.
De acuerdo con su localización tisular, los canales KATP existen en diferentes isoformas o subespecies que se obtienen como resultado del ensamblaje de las subunidades SUR y Kir en múltiples combinaciones. La combinación de la subunidad SUR1 con la Kir6.2 (SUR1/Kir6.2) forma típicamente los canales KATP de tipo células B pancreáticas y adipocitos, mientras que las combinaciones SUR2A/Kir6.2 y SUR2B/Kir6.2 o Kir6.1 forman típicamente los canales KATP tipo cardiaco y tipo muscular liso, respectivamente (Babenko y col., Annu. Rev. Physiol., 60: 667-687 (1998)). También existen pruebas de que el canal puede incluir subunidades Kir2.x. Esta clase de canales de potasio se inhiben por ATP intracelular y se activan por nucleósidos difosfato intracelulares. Dichos canales KATP relacionan el estado metabólico de las células con el potencial de membrana plasmática y de este modo desempeñan un papel clave en la regulación de la actividad celular. En la mayoría de células excitadoras, los canales KATP están cerrados en condiciones fisiológicas normales y se abren cuando el tejido se ve metabólicamente comprometido (por ejemplo, cuando disminuye la proporción (ATP:ADP). Esto promueve el flujo de descarga de K+ y la hiperpolarización celular, evitando de este modo que se abran los canales de Ca2+ accionados por voltaje (VOC). (Prog Res Research, (2001) 31: 77-80).
Los agentes de apertura de canales de potasio (PCO o KCO) (también denominados activadores de canales o agonistas de canales), son un grupo estructuralmente diverso de compuestos sin ningún farmacóforo común aparente que relacione su capacidad para antagonizar la inhibición de canales KATP por nucleótidos intracelulares. El diazóxido es un PCO que estimula los canales KATP en células ß pancreáticas (véase Trube y col., Pfluegers Arch kEur J Physiol, 407, 493-99 (1986)). El pinacidil y el cromakalim son PCO que activan los canales de potasio sarcolémicos (véase Escande y col., Biochem Biophys Res Commun, 154, 620-625 (1988); Babenko y col., J Biol Chem, 275 (2), 717-720 (2000)). Se ha demostrado que la sensibilidad a diazóxido reside en los dominios transmembrana predichos 6 a 11 (TMD6-11) y el primer plegamiento de unión a nucleótidos (NBF1) de la subunidad SUR1.
El diazóxido, que es un derivado no diurético de la benzotiadiazina que tiene la fórmula 1,1-dióxido de 7-cloro-3-metil-2H-1,2,4-benzotiadiazina (fórmula empírica C8H7ClN2O2S), se comercializa en tres formulaciones diferentes para tratar dos indicaciones patológicas diferentes; 1) emergencias hipertensivas y 2) afecciones de hipoglucemia hiperinsulinémica. Las emergencias hipertensivas se tratan con Hyperstat IV, una formulación acuosa de diazóxido para su uso intravenoso ajustada a un pH de 11,6 con hidróxido de sodio. El Hyperstat IV se administra como una dosis en embolada en una vena periférica para tratar la hipertensión maligna o una sobredosis de sulfonilureas. En este uso, el diazóxido actúa abriendo los canales de potasio del músculo liso vascular, estabilizando el potencial de membrana en el nivel de reposo y evitando la contracción del músculo liso vascular.
Las afecciones de hipoglucemia hiperinsulinémica se tratan con Proglycem, una versión farmacéutica oral del diazóxido útil para su administración a lactantes, niños y adultos. Está disponible como una suspensión oral con sabor a menta chocolate que incluye alcohol al 7,25%, sorbitol, aroma de crema de chocolate, propilenglicol, silicato de magnesio y aluminio, carboximetilcelulosa sódica, aroma de menta, benzoato sódico, metilparabeno, ácido clorhídrico para ajustar el pH, poloxámero 188, propilparabeno y agua. El diazóxido también está disponible como una cápsula con 50 ó 100 mg de diazóxido incluyendo lactosa y estearato de magnesio.
Se han ensayado varias formulaciones experimentales de diazóxido en seres humanos y animales. Éstas incluyen una solución oral ensayada en estudios farmacodinámicos y farmacocinéticos y una formulación de comprimidos en desarrollo como antihipertensor, pero que nunca se ha comercializado (véase Calesnick y col., J. Pharm. Sci. 54: 1277-1280 (1965); Reddy y col., AAPS Pharm Sci Tech 4 (4): 1-98, 9 (2003); Patente de Estados Unidos Nº 6.361.795).
Las formulaciones orales actuales de diazóxido están autorizadas para su dosificación dos o tres veces al día a intervalos de 8 ó 12 horas. La mayoría de los pacientes que reciben diazóxido se dosifican tres veces al día. Las formulaciones comerciales y experimentales de diazóxido están caracterizadas por una liberación de fármaco rápida después de la ingestión, completándose la liberación en aproximadamente 2 horas.
Las formulaciones orales actuales de diazóxido en uso terapéutico dan como resultado una variedad de efectos secundarios adversos incluyendo dispepsia, náuseas, diarrea, retención de líquidos, edema, índices de excreción de sodio, cloruro y ácido úrico reducidos, hiperglucemia, vómitos, dolor abdominal, oclusión intestinal, taquicardia, palpitaciones y cefalea (véase el prospecto actual del Proglycem). El tratamiento oral con diazóxido se usa en individuos que padecen una enfermedad grave que si no se trata da como resultado una morbilidad y mortalidad significativas. Los efectos secundarios adversos de la administración oral se toleran debido a que los beneficios del tratamiento son importantes. El perfil de efectos secundarios adversos del diazóxido oral limita la utilidad del fármaco en el tratamiento de pacientes obesos a dosis dentro del intervalo autorizado de 3 a 8 mg/kg al día.
Se ha informado del efecto del diazóxido en modelos animales de diabetes y obesidad (por ejemplo, ratas Zucker obesas y delgadas). Véase, por ejemplo, Alemzadeh y col. (Endocrinology 133: 705-712 (1993), Alemzadeh y col. (Metabolism 45: 334-341 (1996)), Alemzadeh y col. (Endocrinology 140: 3197-3202 (1999)), Stanridge y col. (FASEB J 14: 455-460 (2000)), Alemzadeh y col. (Med Sci Monit 10 (3): BR53-60 (2004)), Alemzadeh y Tushaus (Endocrinology 145 (12): 3476-3484 (2004)), Aizawa y col. (J of Pharma Exp Ther 275 (1): 194-199 (1995)) y Surwit y col. (Endocrinology 141: 3630-3637 (2000)).
Se ha informado del efecto del diazóxido en seres humanos con obesidad o diabetes. Véase, por ejemplo, Wigand y Blackard (Diabetes 28 (4): 287-291 (1979); evaluación del diazóxido sobre receptores de insulina), Ratzmann y col. (Int J Obesity 7 (5): 453-458 (1983); tolerancia a la glucosa y sensibilidad a la insulina en pacientes moderadamente obesos), Marugo y col. (Boll Spec It Biol Sper 53: 1860-1866 (1977); tratamiento con dosis moderadas de diazóxido sobre la pérdida de peso en pacientes obesos), Alemzadeh y col. (J Clin Endocr Metab 83: 1911-1915 (1998); tratamiento con una dosis reducida de diazóxido sobre la pérdida de peso en pacientes hiperinsulinémicos obesos), Guldstrand y col. (Diabetes and Metabolism 28: 448-456 (2002); diazóxido...
Reivindicaciones:
1. Una formulación farmacéutica de liberación retardada de un agente de apertura de canales KATP de
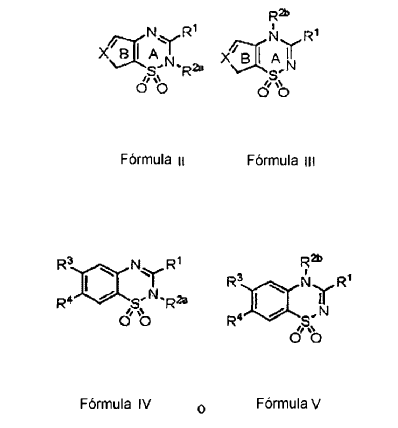
En la que las Fórmulas II y III:
en las que dicha formulación farmacéutica de liberación retardada es adecuada para su administración oral.
2. La formulación de la reivindicación 1, que esta formulada para su administración oral.
3. La formulación de la reivindicación 1 ó 2 para una sola administración que contiene entre 10 y 100 mg del agente de apertura de canales KATP.
4. La formulación de la reivindicación 1 ó 2 para una sola administración que contiene entre 100 y 200 mg del agente de apertura de canales KATP.
5. La formulación de la reivindicación 1 ó 2 para una sola administración que contiene entre 200 y 300 mg del agente de apertura de canales KATP.
6. La formulación de la reivindicación 1 ó 2 para una sola administración que contiene entre 300 y 500 mg del agente de apertura de canales KATP.
7. La formulación de la reivindicación 1 ó 2 para una sola administración que contiene entre 500 y 2000 mg del agente de apertura de canales KATP.
8. La formulación de una cualquiera de las reivindicaciones 1-7, en la que el agente de apertura de canales KATP es diazóxido.
9. La formulación de una cualquiera de las reivindicaciones 1-8 obtenida por al menos uno de los siguientes: (a) reducción del tamaño de partícula que implica trituración, secado por pulverización u otras técnicas de micronización, (b) el uso de una resina de intercambio iónico, (c) el uso de complejos de inclusión, (d) compactación de un compuesto de fórmula II, III, IV o V con un agente solubilizante incluyendo una hipromelosa de baja viscosidad, metilcelulosa de baja viscosidad o excipiente que funcione de forma similar o combinaciones de los mismos, (e) asociación de un compuesto de fórmula II, III, IV o V con una sal antes de la formulación, (f) el uso de una dispersión sólida de un compuesto de fórmula II, III, IV o V, (g) el uso de un sistema autoemulsionante, (h) la adición de uno o más tensioactivos a la formulación o (i) el uso de nanopartículas.
10. La formulación de la reivindicación 2, que incluye al menos un componente que inhibe sustancialmente la liberación del agente de apertura de canales KATP de la formulación hasta después del tránsito gástrico.
11. La formulación de la reivindicación 10, en la que el componente se selecciona del grupo constituido por: (a) un polímero o copolímero sensible a pH aplicado como un recubrimiento por compresión sobre un comprimido, (b) un polímero o copolímero sensible a pH aplicado como una película fina sobre un comprimido, (c) un polímero o copolímero sensible a pH aplicado como una película fina a un sistema de encapsulación, (d) un polímero o copolímero sensible a pH aplicado a micropartículas encapsuladas, (e) un polímero o copolímero no soluble en agua aplicado como un recubrimiento por compresión sobre un comprimido, (f) un polímero o copolímero no soluble en agua aplicado como una película fina sobre un comprimido, (g) un polímero no soluble en agua aplicado como una película fina a un sistema de encapsulación, (h) un polímero no soluble en agua aplicado a micropartículas, (i) incorporación de la formulación en un sistema de bomba osmótica, (j) uso de sistemas controlados por resinas de intercambio iónico y (k) combinaciones de dichos enfoques, en las que el polímero o copolímero sensible a pH es resistente a la degradación en condiciones ácidas.
12. La formulación de una cualquiera de las reivindicaciones 1-7, que comprende además un componente que contribuye a la liberación sostenida del agente de apertura de canales KATP durante un periodo de 2-4 horas después de la administración.
13. La formulación de una cualquiera de las reivindicaciones 1-7, que comprende además un componente que contribuye a la liberación sostenida del agente de apertura de canales KATP durante un periodo de 2-8 horas después de la administración.
14. La formulación de una cualquiera de las reivindicaciones 1-7, que comprende además un componente que contribuye a la liberación sostenida del agente de apertura de canales KATP durante un periodo de 8-24 horas después de la administración.
15. La formulación de las reivindicaciones 12-14, en la que el componente es: (a) un recubrimiento polimérico sensible a pH, (b) un hidrogel, (c) un recubrimiento de película que controla la velocidad de difusión del fármaco desde una matriz recubierta, (d) una matriz erosionable que controla la velocidad de liberación de fármaco, (e) bolitas, gránulos o micropartículas de fármaco recubiertas de polímero que además pueden encapsularse o comprimirse formando un comprimido, (f) un sistema de bomba osmótica que contiene el fármaco, (g) una forma de comprimido recubierto por compresión del fármaco o (h) combinaciones de las mismas.
16. La formulación de una cualquiera de las reivindicaciones 1-7, que comprende además otro agente farmacéuticamente activo.
17. La formulación de la reivindicación 16, en la que el otro agente farmacéuticamente activo es un agente útil para el tratamiento de una afección seleccionada del grupo constituido por obesidad, prediabetes, diabetes, hipertensión, depresión, colesterol elevado, retención de líquidos u otras comorbilidades asociadas con la obesidad, lesión isquémica y de reperfusión o epilepsia, esquizofrenia, manías u otras afecciones psicóticas.
18. La formulación de una cualquiera de las reivindicaciones 1-7 en la que la administración a un individuo obeso, con sobrepeso o con tendencia a la obesidad da como resultado al menos uno de los siguientes:
19. La formulación de una cualquiera de las reivindicaciones 1-7, en la que la administración a un individuo obeso, con sobrepeso o con tendencia a la obesidad da como resultado al menos uno de los siguientes:
20. Uso de la formulación de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para inducir o mantener la pérdida de peso en un sujeto obeso o con sobrepeso, o mantener la pérdida de peso en un sujeto con tendencia a la obesidad, que comprende administrar la formulación no más de dos veces cada 24 horas.
21. El uso de la reivindicación 20, que comprende administrar la formulación una vez cada 24 horas.
22. Uso de una formulación farmacéutica de la reivindicación 1 ó 2, para la fabricación de un producto farmacéutico para inducir la pérdida de peso en un sujeto obeso o con sobrepeso, que comprende administrar dosificaciones diarias de la formulación farmacéutica, en el que las dosificaciones diarias de la formulación de KATP están entre 50 y 180 mg.
23. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para tratar las comorbilidades asociadas con la obesidad en un individuo obeso, con sobrepeso o con tendencia a la obesidad, que comprende administrar una cantidad terapéuticamente eficaz de la formulación no más de dos veces cada 24 horas.
24. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para lograr una pérdida de peso en un individuo obeso, que comprende administrar una cantidad terapéuticamente eficaz de la formulación no más de dos veces cada 24 horas.
25. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para elevar el gasto energético o la beta oxidación de grasas en un individuo con sobrepeso, obeso o con tendencia a la obesidad, que comprende administrar una cantidad eficaz de la formulación no más de dos veces cada 24 horas.
26. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para prevenir la transición a diabetes de un individuo prediabético, que comprende administrar una cantidad eficaz de la formulación no más de dos veces cada 24 horas.
27. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para restaurar la tolerancia normal a la glucosa en un individuo diabético o prediabético, que comprende administrar una cantidad eficaz de la formulación.
28. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 para la fabricación de un producto farmacéutico para retrasar o prevenir la progresión de la diabetes, que comprende administrar una cantidad eficaz de la formulación no más de dos veces cada 24 horas.
29. El uso de una cualquiera de las reivindicaciones 23-26 y 28, en el que dicha administración es una vez cada 24 horas.
30. Uso de una formulación farmacéutica de la reivindicación 1 ó 2 y un fármaco que se selecciona del grupo constituido por sibutramina, orlistat, ribonamant, un diurético que no sea tiazida, un fármaco que disminuya los niveles de colesterol, un fármaco que aumente el colesterol en HDL, un fármaco que disminuya el colesterol en LDL, un fármaco que disminuya la presión arterial, un fármaco que sea un antidepresivo, un fármaco que mejore la sensibilidad a la insulina, un fármaco que mejore la utilización o la captación de la glucosa, un fármaco que sea un antiepiléptico, un fármaco que sea un antiinflamatorio, un fármaco que sea un supresor del apetito, un fármaco que disminuya los triglicéridos circulantes y un fármaco que se use para inducir una pérdida de peso en un individuo con sobrepeso u obeso para la fabricación de un producto farmacéutico para el tratamiento de la obesidad o de las comorbilidades asociadas con la obesidad u otras enfermedades o afecciones que impliquen canales KATP, que comprende la coadministración de una cantidad eficaz de la forma farmacéutica oral sólida de un agente de apertura de canales KATP y el fármaco que se selecciona del grupo constituido por sibutramina, orlistat, ribonamant, un diurético que no sea tiazida, un fármaco que disminuya los niveles de colesterol, un fármaco que aumente el colesterol en HDL, un fármaco que disminuya el colesterol en LDL, un fármaco que disminuya la presión arterial, un fármaco que sea un antidepresivo, un fármaco que mejore la sensibilidad a la insulina, un fármaco que mejore la utilización o la captación de la glucosa, un fármaco que sea un antiepiléptico, un fármaco que sea un antiinflamatorio, un fármaco que sea un supresor del apetito, un fármaco que disminuya los niveles de triglicéridos circulantes y un fármaco que se use para inducir una pérdida de peso en un individuo con sobrepeso u obeso.
31. Uso de una formulación farmacéutica que comprende un agente de apertura de canales KATP para la fabricación de un producto farmacéutico para el tratamiento de enfermedades o afecciones, que comprende reducir la incidencia de efectos adversos de la administración de un agente de apertura de canales KATP mediante el uso de una formulación farmacéutica que retrase la liberación del agente de apertura de canales KATP hasta que se complete el tránsito gástrico.
32. Uso de una formulación farmacéutica que comprende un agente de apertura de canales KATP para la fabricación de un producto farmacéutico de liberación retardada para prevenir o tratar el aumento de peso, la dislipidemia o la tolerancia alterada a la glucosa en un sujeto tratado con un fármaco antipsicótico.
33. Uso de una formulación farmacéutica que comprende un agente de apertura de canales KATP para la fabricación de un producto farmacéutico de liberación retardada para tratar enfermedades caracterizadas por obesidad, hiperfagia, dislipidemia o un gasto energético disminuido incluyendo (a) síndrome de Prader Willi, (b) síndrome de Froelich, (c) síndrome de Cohen, (d) síndrome de Summit, (e) síndrome de Alstrom, (f) síndrome de Borjesen, (g) síndrome de Bardet-Biedl o (h) hiperlipoproteinemia tipo I, II, III y IV.
Patentes similares o relacionadas:
Formulaciones de liberación modificada y procedimientos para el tratamiento de la enfermedad intestinal inflamatoria, del 8 de Mayo de 2019, de Allergan Pharmaceuticals International Limited: Una composición farmacéutica para la administración a un paciente que la necesite que comprende una dosis de un agente activo de aminosalicilato elegido entre […]
Sustancia citotóxica para usar en combinación con radioterapia en el tratamiento del cáncer, del 25 de Abril de 2019, de Fumedica AG: Una preparación que comprende al menos una sustancia quimioterapéutica o citotóxica para usar en el tratamiento de cáncer de un paciente […]
Composición medicinal que mejora la resistencia a la leptina, del 16 de Enero de 2019, de KYOTO UNIVERSITY: Un compuesto de fórmula (I):**Fórmula** en donde R1 es arilo o heteroarilo, en donde el arilo o heteroarilo pueden estar sustituidos con 1 a 3 […]
Métodos para reducir la agregación de IL-1ra, del 19 de Diciembre de 2018, de Swedish Orphan Biovitrum AB (publ): Un método para reducir la agregación de un antagonista del receptor de interleucina-1 (IL-1ra), o reducir la tasa de agregación de un IL-1ra, en una composición acuosa, en el […]
SISTEMA DE LIBERACIÓN CONTROLADA Y MÉTODO DE PREPARACIÓN DEL MISMO, del 30 de Noviembre de 2018, de UNIVERSITAT POLITECNICA DE VALENCIA: La invención describe un sistema de liberación controlada en la región del colon para el tratamiento, la prevención o el diagnóstico de enfermedades, que comprende […]
Derivados de difenilo sustituidos, del 26 de Septiembre de 2018, de Creative Therapeutics GmbH: Derivados de difenilo de la fórmula**Fórmula** en la cual X significa CO o-CR7≥CR8-, R3, R6 significan, independientemente entre sí, hidrógeno, […]
Método de tratamiento del cáncer, del 28 de Marzo de 2018, de NOVARTIS AG: Uso del ácido 3'-{N'-[1-(3,4-Dimetilfenil)-3-metil-5-oxo-1,5-dihidropirazol-4-ilideno]hidrazino}-2'-hidroxibifenil-3- carboxílico y/o una sal farmacéuticamente aceptable […]
Macromoléculas de liberación de óxido nítrico ajustables que tienen múltiples estructuras donantes de óxido nítrico, del 6 de Diciembre de 2017, de Novan, Inc: Una macromolécula de liberación de óxido nítrico que comprende al menos dos estructuras donantes de NO diferentes de la misma clase; o […]