FORMULACIONES DE PROTEINA CONCENTRADAS DE VISCOSIDAD REDUCIDA.
Formulación líquida estable que comprende una inmunoglobulina en una cantidad de por lo menos 80 mg/ml y una sal y/o tampón en una cantidad de por lo menos 100 mM,
y que tiene una viscosidad cinemática de 50 mm 2 /s o menos a 25ºC
Tipo: Resumen de patente/invención. Número de Solicitud: W0142487US.
Solicitante: GENENTECH, INC.
NOVARTIS AG.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY,SOUTH SAN FRANCISCO CALIFOR.
Inventor/es: LIU, JUN, SHIRE, STEVEN, J..
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K47/02 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos inorgánicos.
- A61K47/12 A61K 47/00 […] › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/18B
- A61K9/00M5
Clasificación PCT:
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K47/02 A61K 47/00 […] › Compuestos inorgánicos.
- A61K47/12 A61K 47/00 […] › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/18 A61K 47/00 […] › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
Fragmento de la descripción:
Formulaciones de proteína concentradas de viscosidad reducida.
Antecedentes de la invención
La presente invención pertenece a formulaciones de proteínas concentradas con una viscosidad reducida, que son particularmente adecuadas para la administración subcutánea. La invención también se refiere a un procedimiento de reducción de la viscosidad de las formulaciones de proteínas concentradas.
En los últimos diez años, los avances en la biotecnología han hecho posible la producción de una variedad de proteínas para aplicaciones farmacéuticas utilizando técnicas de ADN recombinante. Como las proteínas son más grandes y más complejas que los fármacos tradicionales orgánicos e inorgánicos (es decir, poseen múltiples grupos funcionales además de las estructuras tridimensionales complejas), la formulación de estas proteínas presenta problemas especiales. Uno de los problemas es el elevado valor de viscosidad de las formulaciones de proteínas, especialmente a alta concentración. El suministro de una concentración de proteínas es a menudo requerido para la administración subcutánea debido a las limitaciones de volumen (= 1,5 ml) y requerimientos de dosis (normalmente = 50 mg, preferiblemente = 100 mg). Por ejemplo, si una proteína debe administrarse a pacientes a 2 mg/kg sobre una base semanal, la dosis semanal promedio será de 130 mg considerando 65 kg como peso promedio de los pacientes. Como volúmenes de inyección mayores de 1,5 mg no se toleran bien para la administración subcutánea, la concentración de proteínas para una administración subcutánea semanal será de aproximadamente 100 mg/ml (130 mg de proteínas en menos de 1,5 ml de volumen). Sin embargo, las formulaciones de proteínas muy concentradas presentan varios problemas. Un problema es la tendencia de las proteínas a formar partículas durante su procesamiento y/o almacenamiento, que hace difícil la manipulación durante el procesamiento adicional. En el caso de formulaciones líquidas reconstituidas, esto se soluciona normalmente añadiendo un surfactante adecuado (por ejemplo, un polisorbato) durante la liofilización o después de la liofilización mientras se reconstituye la formulación. Aunque los surfactantes han mostrado que reduce de manera significativa el grado de formación de partículas de las proteínas, no solucionan otro problema asociado con la manipulación y la administración de formulaciones de proteínas concentradas. Las proteínas tienden a formar soluciones viscosas en alta concentración debido a su naturaleza macromolecular y potencial para interacciones intermoleculares. Además, muchas proteínas a menudo se liofilizan en presencia de grandes cantidades de lioprotectores, tal como azúcar para mantener su estabilidad. El azúcar puede mejorar las interacciones intermoleculares y aumentar la viscosidad. Formulaciones muy viscosas son difíciles de fabricar, colocar en una jeringuilla e inyectar de manera subcutánea. La utilización de fuerzas en la manipulación de las formulaciones viscosas provoca una formación de espuma excesiva, y la acción resultante a modo detergente de la formación de espuma tiene el potencial de desnaturalizar y desactivar la proteína terapéuticamente activa. Además, la solución viscosa aumenta la presión trasera durante el proceso UF/DF y hace difícil la recuperación de la proteína. Esto puede provocar una pérdida considerable del producto de la proteína. No hay una solución satisfactoria de este problema de la técnica anterior. Por lo tanto, existe la necesidad de desarrollar un procedimiento de reducción de la viscosidad de una formulación que contiene una alta concentración de proteínas.
Formulaciones de proteínas liofilizadas isotónicas estables se describen en la publicación PCT WO 97/04801, publicada el 13 febrero de 1997. Las formulaciones liofilizadas descritas se pueden reconstituir para generar formulaciones líquidas con una alta concentración de proteínas sin una pérdida aparente de estabilidad. Sin embargo, los aspectos potenciales asociados con la alta viscosidad de las formulaciones reconstituidas no se contemplan.
Los solicitantes han descubierto que la preparación de una formulación proteinácea liofilizada con 100 mM NaCl de diluyente puede producir una solución ligeramente hipertónica. Se ha creído previamente que las formulaciones farmacéuticas deben mantenerse en un pH fisiológico y ser isotónicas. Esta creencia se basó por lo menos en parte en la percepción que la administración de una formulación hipertónica podría provocar la deshidratación y por lo tanto podría dañar el tejido en el sitio de la inyección. Sin embargo, la creencia del requerimiento de isotonicidad absoluta de una formulación farmacéutica puede no estar bien fundada. Por ejemplo, Zietkiewicz et al., Grzyby Drozdzopodobne 23: 869-870 (1971) han mostrado que la isotonicidad absoluta de los fármacos no es necesaria. Se encontró que es suficiente evitar que las soluciones del fármaco superen los límites críticos de hipertonicidad. Por ejemplo, se observaron daños en los tejidos solamente cuando se administró una solución hipertónica de 1300 mOsmol/Kg (~650 mM NaCl) o mayor de manera subcutánea o intramuscular en animales experimentales. Como resultado, las formulaciones que son ligeramente hipertónicas, o fuera del rango del pH fisiológico no parecen presentar un riesgo de daños en el tejido en el sitio de administración.
La patente EP 0 661 060 describe preparaciones de inmunoglobulina concentrada que tienen una baja osmolaridad y una baja viscosidad.
La patente WO 97/04-801 describe formulaciones de anticuerpos liofilizados isotónicos estables.
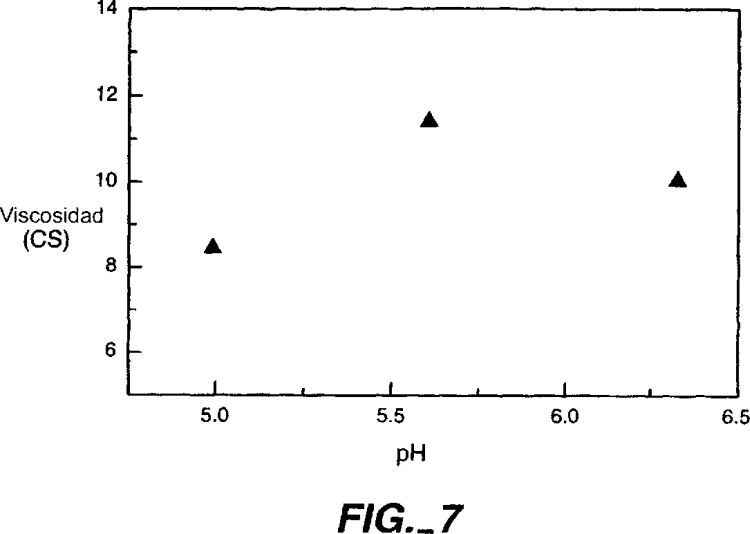
Los solicitantes también han encontrado que las soluciones proteináceas que tienen un pH bajo (4,0-5,3) o elevado (6,5-12,0) también fueron efectivas en la reducción de la viscosidad de las formulaciones de proteínas de alta concentración.
La presente invención se dirige a proporcionar una formulación de inmunoglobulina de alta concentración con una viscosidad reducida, que es fácil de manipular y que es adecuada para la administración subcutánea. La presente invención también se dirige a proporcionar un procedimiento de reducción de la viscosidad de formulaciones de inmunoglobulina concentrada.
Descripción de la invención
La presente invención se refiere a un procedimiento de disminución de la viscosidad de una composición de inmunoglobulina concentrada mediante: aumentar la resistencia iónica total de la formulación a través de la visión de sales o componentes de tampón tal como se define en las reivindicaciones sin comprometer de manera significativa la estabilidad o actividad biológica. En consecuencia, la invención se refiere a procedimientos y medios para reducir la viscosidad de formulaciones de inmunoglobulina concentrada, principalmente para asegurar una fácil manipulación antes y durante la administración a un paciente.
En un aspecto, la presente invención proporciona una formulación estable de viscosidad reducida que comprende inmunoglobulina en una cantidad de por lo menos aproximadamente 80 mg/ml y una sal o un tampón en una cantidad de por lo menos aproximadamente 100 mM, y que tiene una viscosidad cinemática de aproximadamente 50 mm2/s o menos a 25ºC. Las sales y/o tampones son farmacéuticamente aceptables y se derivan de varios ácidos conocidos (inorgánicos y orgánicos) o base que forman metales y aminas. Alternativamente, las sales y/o tampones se pueden derivar de aminoácidos. En un aspecto específico, las sales eligen entre el grupo que consiste en cloruro de sodio, clorhidrato de arginina, tiocianato de sodio, tiocianato de amonio, sulfato de amonio, cloruro de amonio, cloruro de calcio, cloruro de zinc y acetato de sodio. En otro aspecto, las sales o tampones son monovalentes. En otro aspecto, la formulación contiene los componentes de sal o tampón en una cantidad de aproximadamente 100-200 mM, y tiene una viscosidad de aproximadamente 2 a 30 mm2/s. En una realización particular, la inmunoglobulina en la formulación tiene un peso molecular de por lo menos aproximadamente 15-20 kD. Otra vez en particular, la formulación es hipertónica. En otro aspecto particular, la formulación también puede comprender un surfactante tal como polisorbato. La invención también contempla una formulación reconstituida que también comprende un lioprotector tal como el azúcar. En otro aspecto, el azúcar lioprotector puede ser, por ejemplo, sacarosa o trehalosa, y puede estar presente en una cantidad...
Reivindicaciones:
1. Formulación líquida estable que comprende una inmunoglobulina en una cantidad de por lo menos 80 mg/ml y una sal y/o tampón en una cantidad de por lo menos 100 mM, y que tiene una viscosidad cinemática de 50 mm2/s o menos a 25ºC.
2. Formulación según la reivindicación 1, que comprende:
(a) dicha sal y/o tampón en una cantidad de 100-200 mM; o
(b) dicha sal y/o tampón en una cantidad de 200 mM.
3. Formulación según la reivindicación 1, en la que dicha sal y/o tampón deriva de:
(a) un ácido orgánico o inorgánico y un metal o una amina que forman una base; o
(b) un aminoácido.
4. Formulación según la reivindicación 3, en la que:
(a) el metal que forma la base se selecciona entre el grupo que consiste en metales alcalinos, metales alcalinotérreos, Al, Zn y Fe; o
(b) la amina que forma la base es NR4+, donde R es independientemente H o C1-4 alquilo.
5. Formulación según la reivindicación 1, en la que la sal y/o tampón derivan de un aminoácido.
6. Formulación según la reivindicación 1, en la que dicha sal se selecciona entre el grupo que consiste en cloruro de sodio, tiocianato de sodio, tiocianato de amonio, sulfato de amonio, cloruro de amonio, cloruro de calcio, clorhidrato de arginina, cloruro de zinc y acetato de sodio.
7. Formulación según la reivindicación 1, que:
(a) tiene una viscosidad cinemática de 40 mm2/s o menos a 25ºC; o
(b) tiene una viscosidad cinemática de 30 mm2/s o menos a 25ºC; o
(c) tiene una viscosidad cinemática de 20 mm2/s o menos a 25ºC; o
(d) tiene una viscosidad cinemática de 10 a 30 mm2/s a 25ºC.
8. Formulación según la reivindicación 1, que también comprende un lioprotector.
9. Formulación según la reivindicación 8, en la que dicho lioprotector es un azúcar.
10. Formulación según la reivindicación 9, en la que dicho azúcar es sacarosa o trehalosa.
11. Formulación según la reivindicación 9, que comprende dicho azúcar en una cantidad de 60-300 mM.
12. Formulación según la reivindicación 1, que también comprende un tensoactivo.
13. Formulación según la reivindicación 1, que es hipertónica.
14. Formulación según la reivindicación 1, que es una formulación reconstituida.
15. Formulación según la reivindicación 14, en la que la concentración de proteína inmunoglobulina en la formulación reconstituida es 2-40 veces mayor que la concentración de proteína inmunoglobulina en la mezcla antes de la liofilización.
16. Formulación según la reivindicación 1, en la que dicha inmunoglobulina tiene un peso molecular de por lo menos 15-20 kD.
17. Formulación según la reivindicación 1, en la que dicha inmunoglobulina es un anticuerpo dirigido contra un antígeno específico.
18. Formulación según la reivindicación 17, en la que dicho anticuerpo está dirigido contra IgE, un elemento de la familia de receptores HER, una molécula de adhesión celular o una subunidad de la misma, o un factor de crecimiento.
19. Formulación según la reivindicación 18, en la que el anticuerpo es rhuMAb-E25, rhuMAb-E26 o rhuMAb-E27.
20. Formulación según la reivindicación 1, que es una formulación farmacéutica líquida.
21. Formulación según la reivindicación 20, que es para administración subcutánea.
22. Procedimiento de reducción de la viscosidad cinemática de una formulación que contiene una inmunoglobulina en una cantidad de por lo menos 80 mg/ml, que comprende la adición de una sal y/o tampón en una cantidad de por lo menos 100 mM.
23. Procedimiento según la reivindicación 22, en el que dicha sal se selecciona entre el grupo que consiste en cloruro de sodio, tiocianato de sodio, tiocianato de amonio, sulfato de amonio, cloruro de amonio, cloruro de calcio e clorhidrato de arginina.
24. Procedimiento según la reivindicación 22, en el que dicha inmunoglobulina es un anticuerpo dirigido contra un antígeno específico.
25. Procedimiento según la reivindicación 24, en el que dicho anticuerpo está dirigido contra IgE.
26. Procedimiento según la reivindicación 25, en el que el anticuerpo es rhuMAb-E25, rhuMAb-E26 o rhuMAb-E27.
27. Procedimiento según la reivindicación 22, en el que dicha formulación es una formulación reconstituida.
28. Procedimiento según la reivindicación 22, en el que la formulación es hipertónica.
29. Procedimiento según la reivindicación 27, en el que la concentración de proteína en dicha formulación reconstituida es 2-40 veces mayor que la concentración de proteína en la mezcla antes de la liofilización.
30. Procedimiento según la reivindicación 22, en el que la viscosidad cinemática de dicha formulación se reduce a 50 mm2/s o menos tal como se determina a 25ºC.
31. Artículo de fabricación que comprende un recipiente que contiene la formulación según una cualquiera de las reivindicaciones 1 a 21.
32. Artículo de fabricación según la reivindicación 31, que también comprende instrucciones para la administración de dicha formulación.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]