Formulaciones de insulina de acción prolongada.
Una formulación farmacéutica acuosa que comprende 300 U/mL de insulina glargina, que es equimolar a 300 UI de insulina humana.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11166415.
Solicitante: SANOFI.
Nacionalidad solicitante: Francia.
Dirección: 54, RUE LA BOETIE 75008 PARIS FRANCIA.
Inventor/es: WERNER, ULRICH, DR., LOOS, PETRA, MUELLER, WERNER, BECKER, REINHARD, DR., BODERKE,PETER, HAHN,ANNKE DR, FUERST,CHRISTIANE DR, TERTSCH,KATRIN DR, SCHOETTLE,ISABELL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/28 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Insulinas.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
PDF original: ES-2509943_T3.pdf




Fragmento de la descripción:
Formulaciones de insulina de acción prolongada
La solicitud se refiere a una formulación farmacéutica acuosa que comprende 300 U/mL [equimolar a 300 Ul de insulina humana] de insulina glargina, y a su uso.
La insulina glargina es 31B-32B'Di-Arg insulina humana, un análogo de insulina humana, con una sustitución adicional de asparagina en posición A21 por glicina.
Lantus® es un producto de insulina que contiene insulina glargina que proporciona un suministro de insulina basal de 24 horas después de una inyección subcutánea de una sola dosis.
El efecto glucodinámico de Lantus® se distingue del de otros productos de insulina comercializados actualmente por una absorción retrasada y predecible de insulina glargina desde el sitio de inyección subcutáneo, que da como resultado una concentración a lo largo del tiempo en 24 horas y un perfil de acción uniformes, sin un pico definido. Lantus® se desarrolló para satisfacer la necesidad médica de un producto de insulina de acción prolongada que pudiera administrarse como una sola inyección diaria para producir un control de glucosa en sangre normal o casi normal con un perfil de insulina basal tan uniforme como sea posible durante un periodo de 24 horas. Dicha preparación proporciona un buen control de la glucosa en sangre todo el día, mientras que minimiza la tendencia a producir hipoglucemia observada con otras preparaciones de insulina con un efecto "pico" más definido.
Un número considerable de pacientes, en particular los que tienen una resistencia a la insulina aumentada debido a la obesidad, usan grandes dosis para controlar la glucosa en sangre. Por ejemplo, una dosis de 100 U requiere la inyección de 1 mL de Lantus® U100, lo cual puede producir algunas molestias; cada mi de Lantus® U100 contiene 100 U (3,6378 mg) de insulina glargina. Para reducir el volumen de inyección, se ha desarrollado una formulación que contiene 300 U de insulina glargina por mL. Los estudios clínicos descritos en el presente documento se realizaron con una formulación de insulina glargina U 300; cada mL de insulina glargina U300 contiene 300 U (10,9134 mg) de insulina glargina. Esta formulación permitiría que los pacientes se inyectaran el mismo número de unidades de insulina glargina en un tercio del volumen de inyección. Era de esperar que las dos formulaciones de insulina glargina, U100 y U300, proporcionaran la misma exposición a la insulina y la misma eficacia, es decir, los mismos perfiles de tiempo.
DESCRIPCIÓN DETALLADA
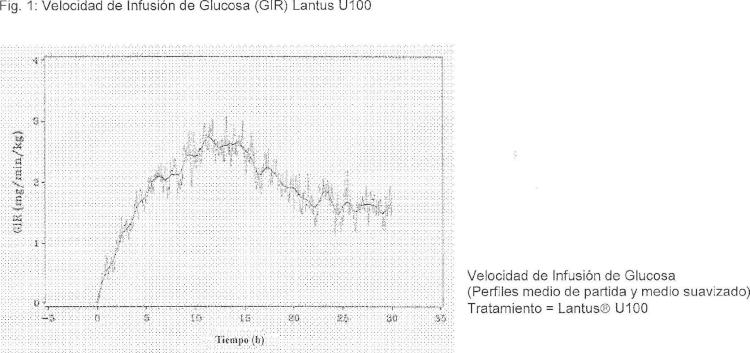
Se ensayó la exposición y actividad de insulina glargina U300, la medicación de ensayo (T), en sujetos sanos no diabéticos en pinzamientos euglucémicos para comprobar la equivalencia en exposición y actividad a Lantus U100, el producto de referencia (R) aprobado. Para representar la larga duración de acción de la insulina glargina después de la administración subcutánea se seleccionaron 30 horas. La exposición se evaluó a partir de perfiles de concentración de insulina glargina frente al tiempo después de la administración subcutánea, mientras que la actividad se evaluó simultáneamente como utilización de glucosa por unidad de insulina.
Un diseño repetido permitió limitar el número de sujetos para evaluar la bioequivalencia y variabilidad como recomiendan las directrices de la FDA "Guidance for Industry, Statistical Approaches to Establishing Bioequivalence".
Se esperaba que el estudio clínico respectivo estableciera equivalencia en exposición y actividad.
Para este estudio se seleccionó una dosis de 0,4 U/kg; corresponde a la dosis media de insulina basal en los pacientes. En sujetos sanos no diabéticos, esta dosis produce una elevación considerable en la concentración plasmática de insulina y un efecto duradero de reducción de glucosa que puede cuantificarse en escenarios de pinzamiento euglucémico.
El diseño repetido preferido por las directrices requiere dos inyecciones repetidas de una sola dosis de IP (R: Lantus® U100, T: insulina glargina U300) en secuencias cruzadas de cuatro vías predefinidas (RTTR o TRRT) asignadas por el plan de aleatorización. Esto se hizo en Periodos (P) 1 - 4 en cuatro días diferentes. Como resultado, cada sujeto recibió dos dosis subcutáneas individuales repetidas de 0,4 U/kg de Lantus® U100 (R) e insulina glargina U300 (T), alternando entre dos sitios opuestos del área periumbilical.
Los días de dosificación se separaron por un periodo de eliminación de 4 a 18 días. La longitud del periodo de eliminación variaba individualmente, permitiendo que tanto el participante como el Investigador lo ajustaran a sus necesidades. Por experiencia, 4 días constituyen un periodo mínimo de recuperación, permitiendo 1 pinzamiento por semana para un participante, mientras que 18 días representan una ruptura de 3 semanas entre días de pinzamiento, permitiendo a los sujetos más libertad para cumplir con las obligaciones no relacionadas con el estudio.
Antes de las visitas de pinzamiento euglucémico, en la SCR (visita de selección), los sujetos se someten a una selección de elegibilidad, y en la visita EOS (final del estudio) los sujetos se someten a un examen final para
asegurar un estado de salud normal. La selección y el P1 no tienen que estar separados por más de 21 días, mientras que las visitas EOS no deben producirse antes que el mismo día de la semana que el Día 1 de P4 la semana siguiente, es decir, después de 4 días más, y no deben producirse después de una quincena después del Día 2 de P4, es decir, después de 14 días más.
Éste es un estudio de una sola dosis con un total de 4 administraciones repetidas. El efecto de los IP tenía que durar al menos aproximadamente 24 horas, lo cual es la causa de que los sujetos hayan permanecido en el instituto durante 2 días. Los sujetos se exponen al tratamiento 4 veces.
El objetivo primario del estudio fue evaluar la bioequivalencia media (ABE) de Lantus® U100 (formulación comercial) e insulina glargina U300 en biodisponibilidad (exposición) y bioeficacia (actividad) usando la técnica de pinzamiento euglucémico.
El objetivo secundario del estudio fue evaluar la seguridad y tolerancia de la insulina glargina U300.
Como se ha mencionado anteriormente, era de esperar que las formulaciones de insulina glargina U100 y U300 proporcionaran la misma exposición a la insulina y la misma eficacia. Sin embargo, sorprendentemente, se demostró que la exposición a la insulina y la eficacia no eran ¡guales. La insulina glargina U 100 y la insulina glargina U 300 no son equivalentes en biodisponibilidad (exposición) y bioeficacia (actividad). La exposición y actividad después de la administración de insulina glargina U300 eran aproximadamente 40% menores en comparación con la exposición y actividad después de la administración de la misma cantidad (0,4 U/kg) de insulina glargina U100.
Sin embargo, la insulina glargina U300 muestra un perfil de PD (actividad) y PK (exposición) incluso más plano que la insulina glargina U100, lo cual sería deseable para una insulina basal. Éstas diferencias sorprendentes e inesperadas en exposición y actividad entre las formulaciones de insulina glargina U100 e insulina glargina U300 después de la misma dosis s.c. en sujetos sanos se muestran eficazmente las figuras presentadas más adelante. Debe tenerse en cuenta que al mismo tiempo la glucosa en sangre era constante.
El efecto reductor de la glucosa en sangre de la insulina glargina se evaluó adicionalmente en perros Beagle normoglucémicos sanos. Al aumentar la concentración de insulina glargina, el tiempo medio de acción aumentaba de 6,8 h (U100) a 7,69 h (U300), respectivamente. Al aumentar la concentración de glargina de 100 a 300 U/mL, el perfil de acción-tiempo de reducción de la glucosa en sangre cambiaba hacia una actividad más plana y prolongada en el perro. Los datos actuales en perros son coherentes con los datos en humanos, lo que demuestra que las mayores concentraciones de fármaco de insulina glargina están correlacionadas positivamente con el perfil y la mayor duración de la acción.
Además, los precipitados de formulaciones de insulina glargina que tienen concentraciones de 100 U/mL, 300 U/mL, 500 U/mL, 700 U/mL y 1000 U/mL se han investigado por microscopía. Estas investigaciones revelaron diferencias en las características de las precipitaciones, que conducían a partículas notablemente más grandes al aumentar las concentraciones.
También se investiga la influencia de las mayores concentraciones de formulaciones de insulina glargina con respecto a las propiedades de disolución usando un sistema de ensayo in vitro. Para hacer esto, se realizan estudios de precipitación usando un tampón fosfato con un pH de 7,4,... [Seguir leyendo]
Reivindicaciones:
1. Una formulación farmacéutica acuosa que comprende 300 U/mL de insulina glargina, que es equimolar a 300 Ul de insulina humana.
2. La formulación acuosa de la reivindicación 1, que comprende un análogo de exendina-4, seleccionado del grupo que consiste en lixisenatida, exenatida y liraglutida.
3. La formulación acuosa de la reivindicación 2, que comprende de 0,1 pg a 10 pg de lixisenatida por U de insulina glargina.
4. La formulación acuosa de la reivindicación 3, que comprende de 0,2 pg a 1 pg de lixisenatida por U de insulina glargina.
5. La formulación acuosa de la reivindicación 4, que comprende de 0,25 pg a 0,7 pg de lixisenatida por U de insulina glargina.
6. La formulación acuosa de cualquiera de las reivindicaciones anteriores, que comprende uno o más excipientes seleccionados entre un grupo que comprende cinc, m-cresol, glicerol, polisorbato 20 y sodio.
7. La formulación acuosa de la reivindicación 6, que comprende 90 pg/mL de cinc, 2,7 mg/mL de m-cresol y 20 mg/mL de glicerol al 85%.
8. La formulación acuosa de la reivindicación 6, que comprende 90 pg/mL de cinc, 2,7 mg/mL de m-cresol, 20 pg/mL de polisorbato 20 y 20 mg/mL de glicerol al 85%.
9. La formulación acuosa de cualquiera de las reivindicaciones anteriores, en la que el pH está comprendido entre 3,4 y 4,6.
10. La formulación acuosa de la reivindicación 9, en la que el pH es 4.
11. La formulación acuosa de la reivindicación 9, en la que el pH es 4,5.
12. Una formulación farmacéutica acuosa que comprende insulina glargina en una concentración de 300 U/mL, que es equimolar a 300 Ul de insulina humana, para uso en el tratamiento de Diabetes Mellitus de Tipo I y Tipo II en un paciente.
13. La formulación acuosa para uso de la reivindicación 12, en donde dicha composición farmacéutica comprende, además, excipientes seleccionados del grupo que consiste en cinc, m-cresol, glicerol, polisorbato 20 y sodio.
14. La formulación acuosa para uso de la reivindicación 12, en donde dicha composición farmacéutica comprende, además, 0,1 pg a 10 pg de lixisenatida por U de insulina glargina.
15. Una composición farmacéutica acuosa que comprende insulina glargina en una concentración de 300 U/mL, que es equimolar a 300 Ul de insulina humana, para uso en prolongar la duración de exposición de una insulina de acción prolongada en el tratamiento de Diabetes Mellitus de Tipo I y Tipo II en un paciente.
16. La formulación acuosa para uso de la reivindicación 15, en donde dicha composición farmacéutica comprende, además, excipientes seleccionados del grupo que consiste en cinc, m-cresol, glicerol, polisorbato 20 y sodio.
17. La formulación acuosa para uso de la reivindicación 15, en donde dicha composición farmacéutica comprende, además, de 0,1 pg a 10 pg de lixisenatida por U de insulina glargina.
18. Una composición farmacéutica acuosa que comprende insulina glargina en una concentración de 300 U/mL, que es equimolar a 300 Ul de insulina humana, para uso en reducir la incidencia de hipoglucemia en el tratamiento de Diabetes Mellitus de Tipo I y Tipo II en un paciente con insulina de acción prolongada.
19. La formulación acuosa para uso de la reivindicación 18, en el que dicha composición farmacéutica comprende, además, excipientes seleccionados del grupo que consiste en cinc, m-cresol, glicerol, polisorbato 20 y
sodio.
20. La formulación acuosa para uso de la reivindicación 18, en donde dicha composición farmacéutica comprende, además, de 0,1 pg a 10 pg de lixisenatida por U de insulina glargina.
21. Una composición farmacéutica acuosa que comprende insulina glargina en una concentración de 300 U/mL, que es equimolar a 300 Ul de insulina humana, para uso en proporcionar una insulina basal de acción prolongada sin picos en el tratamiento de Diabetes Mellitus de Tipo I y Tipo II en un paciente.
22. La formulación acuosa para uso de la reivindicación 21, en donde dicha composición farmacéutica comprende, además, excipientes seleccionados del grupo que consiste en cinc, m-cresol, glicerol, polisorbato 20 y sodio.
23. La formulación acuosa para uso de la reivindicación 21, en donde dicha composición farmacéutica
comprende, además, de 0,1 pg a 10 pg de lixisenatida por U de insulina glargina.
24. La formulación acuosa de acuerdo con cualquiera de las reivindicaciones anteriores, para uso en el tratamiento de Diabetes Mellitus de Tipo I y la Diabetes Mellitus de Tipo II.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Terapia para la diabetes, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un inhibidor de DPP-4, que es linagliptina, para uso terapéutico por administración subcutánea.
Formulaciones farmacéuticas estabilizadas de análogos de insulina y/o derivados de insulina, del 29 de Abril de 2020, de SANOFI: Una formulación farmacéutica que comprende (a) al menos un análogo y/o derivado de insulina, en donde dicho análogo de insulina se selecciona del grupo que […]
Dispositivo, composición y método para el diagnóstico basado en tejidos, del 29 de Abril de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un dispositivo para licuar al menos parcialmente un tejido de un sujeto vivo, que comprende: un depósito que se configura para acoplar operativamente […]
Dispositivo tragable para la administración de fármacos, del 22 de Abril de 2020, de Rani Therapeutics, LLC: Un dispositivo ingerible para la administración de un agente terapéutico hacia el interior de una pared luminal del tubo gastrointestinal de un paciente, […]
Sistemas a base de conjugados para la administración controlada de fármacos, del 18 de Marzo de 2020, de Smartcells, Inc: Un conjugado que comprende una molécula de insulina conjugada a dos o más ligandos de sacáridos, en el que los dos o más ligandos son cada uno aminoetiltrimanosa (AETM) y en […]