Formulación de una composición sanguínea rica en plaquetas y/o factores de crecimiento, con proteínas gelificadas y método de preparación de la misma.
Formulación que comprende o se deriva de una composición sanguínea inicial rica en plaquetas y/o factores de crecimiento y proteínas provenientes de la propia composición sanguínea inicial,
donde dichas proteínas se encuentran en estado gelificado. Se reivindica asimismo un método de preparación de dicha formulación, que comprende los pasos de calentar y posteriormente enfriar la composición sanguínea inicial a unas determinadas temperaturas y tiempos. Entre otras ventajas, la formulación según la invención es biocompatible y biodegradable, presenta las propiedades biológicas o médicas deseables proporcionadas por la presencia de plaquetas o factores de crecimiento, y además presenta una elevada estabilidad dimensional a lo largo del tiempo.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300718.
Solicitante: BIOTECHNOLOGY INSTITUTE, I MAS D, S.L.
Nacionalidad solicitante: España.
Inventor/es: ANITUA ALDECOA,EDUARDO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Plasma sanguíneo; Suero sanguíneo (sangre del cordón umbilical A61K 35/51).
- A61K38/18 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
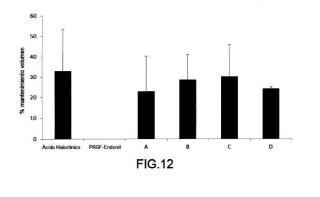
Fragmento de la descripción:
Sector de la técnica
La invención se refiere a una formulación con propiedades 10 biológicas o médicas deseables, obtenida de una composición sanguínea inicial rica en plaquetas y/o factores de crecimiento. La invención se refiere asimismo a un método de preparación de dicha formulación.
Estado de la técnica
En el estado de la técnica se conoce la preparación de composiciones a partir de la sangre humana o animal, donde la sangre es procesada de manera que se obtiene un plasma rico en plaquetas (PRP) y/o un plasma rico en factores de crecimiento (PRGF) que presentan 20 útiles propiedades biológicas y médicas. Dichos PRP o PRGF vienen siendo utilizados con éxito en aplicaciones ex vivo, por ejemplo como medio de cultivo celular, e in vivo, por ejemplo para realizar un proceso de regeneración ósea en un paciente o para tratar a un paciente de una dolencia articular mediante infiltraciones. En el caso de que dichas 25 composiciones vayan a ser utilizadas en aplicaciones in vivo para tratar a un paciente, la tecnología de preparación de formulaciones PRP y PRGF ha ido evolucionando hacia la preparación de composiciones autólogas, es decir, obtenidas de la sangre del propio paciente. Ejemplos de este tipo de composiciones y métodos de preparación pueden encontrarse en las 30 patentes US6569204 y ES2221770.
En los últimos años la tecnología también está evolucionando con el objetivo de conseguir que las composiciones ricas en plaquetas y/o en factores de crecimiento puedan obtenerse en forma de composiciones 35 galénicas o formas farmacéuticas. Se entiende como composición galénica o forma farmacéutica a la disposición individualizada a que se
adaptan los fármacos o principios activos, ya sean de origen químico o de origen biológico (como es el caso de las proteínas del PRP o PRGF), para facilitar su administración. La composición galénica o forma farmacéutica de un medicamento es clave porque determina la eficacia y seguridad del 5 medicamento, ya que controla la dosis y la cesión de las moléculas del medicamento al tejido. Además, la composición galénica o forma farmacéutica del medicamento es determinante para que la preparación del medicamento, su dosificación y su administración sean conocidas, estén controladas y sean ejecutables con relativa facilidad y de manera 10 repetible. En resumidas palabras, una composición galénica o forma farmacéutica pretende facilitar la manipulación, conservación, transporte, administración y en conjunto las propiedades de cualquier fármaco o sustancia con actividad terapéutica.
Una de las formulaciones de mayor aplicación médica del PRP o
PRGF es la conocida como gel de fibrina o malla de fibrina, que es una formulación cuya consistencia semisólida resulta muy conveniente para ciertas aplicaciones. El procedimiento de preparación del gel o malla de fibrina generalmente comienza con una primera fase en la cual se obtiene 20 el PRP o PRGF por un método aplicable, por ejemplo centrifugando sangre extraída de un paciente hasta que la sangre se separa en varias fracciones, y extrayendo la fracción superior, es decir la fracción de plasma rico en plaquetas (PRP) o plasma rico en factores de crecimiento (PRGF). Posteriormente, se realiza la activación de las plaquetas 25 contenidas en el PRP o PRGF (entendiéndose por activación la acción de provocar que las plaquetas liberen ciertos factores de crecimiento contenidos en su interior) por ejemplo mediante la adición de cloruro cálcico. Como consecuencia de la activación, y si se espera un tiempo suficiente, se produce la eventual polimerización de fibrina a partir del 30 fibrinógeno contenido en el plasma, obteniéndose un compuesto final que es un coágulo de fibrina (también denominado gel o malla de fibrina por su consistencia semisólida, como una especie de esponja biológica). Este procedimiento es el que suele realizarse para obtener un gel de fibrina a partir de una sangre modificada con un anticoagulante, como por ejemplo 35 con citrato sódico. Pero también se puede procesar la sangre sin mezclar ésta previamente con anticoagulante; en este caso, al centrifugar la
sangre se consigue tanto separar el plasma de los glóbulos rojos como, al mismo tiempo, obtenerse el gel de fibrina sin necesidad de añadir cloruro cálcico u otro activador de las plaquetas. Algunos ejemplos de aplicación del gel o malla de fibrina son: formar un andamiaje biológico para rellenar defectos óseos; ser aplicado sobre heridas o lesiones para la liberación progresiva de los factores de crecimiento: ser empleado como matriz para el cultivo de células madre; ser empleado como una membrana para poder cerrar defectos o úlceras; ser empleado en la fabricación de tejidos, lo que se conoce como ingeniería de tejidos, donde además de células y factores de crecimiento es de especial importancia contar con una matriz o andamiaje donde las células puedan crecer.
El gel o malla de fibrina presenta algunas limitaciones importantes. La principal limitación del gel o malla de fibrina es que es inestable y tiende a retraerse; por ello, el gel o malla de fibrina no es capaz de mantener un volumen estable a lo largo del tiempo ni de proporcionar un soporte tisular estable a lo largo del tiempo. Si bien esta tendencia a retraerse puede ser positiva en algunas aplicaciones, resulta negativa en otras. Por ejemplo, en una técnica de cirugía dental conocida como elevación del seno maxilar, el biomaterial que se emplea para regenerar el defecto óseo debe tener propiedades osteoconductoras pero además debe ser capaz de mantener el espacio físico durante un largo periodo de tiempo hasta que la matriz ósea se conforme, ya que en caso contrario habría un colapso del espacio que afectaría a la regeneración vertical del hueso alveolar. Otro ejemplo es el caso de una extirpación mamaria (mastectomía), durante la cual el biomaterial o gel que se emplee para rellenar el espacio mamario debe tener una resistencia mecánica adecuada y proporcionar un espacio y volumen a largo plazo de forma que no se colapse dicho espacio. Otro ejemplo aún es el caso de los fillers o agentes de relleno estético (por ejemplo el ácido hialurónico), que son materiales de relleno (por lo tanto dan y mantienen volumen) ampliamente usados en el campo de la estética para aumentar el volumen en las comisuras y arrugas y corregir dichos defectos, dando un aspecto rejuvenecido; cualquier agente que esté dirigido a funcionar como filler o agente de relleno debe ser mecánicamente estable y resistente a la compresión de forma que mantenga el volumen del tejido. Por otra parte,
la tendencia del gel o malla de fibrina a retraerse dificulta e incluso impide el empleo del gel o malla como agente de liberación de agentes externos, fármacos, proteínas, etc.
Otro aspecto limitado del gel o malla de fibrina es su imposibilidad de poder ser infiltrado o canulado en su estado normal, semisólido, lo que impide su administración como relleno en la piel, en dermocosmética, en traumatología y en otros campos de la biología o medicina.
La presente invención tiene como objetivo conseguir una formulación con propiedades biológicas o médicas deseables, obtenida de una composición sanguínea inicial rica en plaquetas y/o factores de crecimiento, que no tienda a retraerse y por tanto permita mantener un volumen estable a lo largo del tiempo. Entre otras aplicaciones, se desea que la formulación sirva como alternativa al gel o malla de fibrina en determinadas aplicaciones donde se requiere una composición estable.
Descripción breve de la invención
Es objeto de la invención una formulación con propiedades biológicas o médicas deseables, que comprende o se deriva de una composición sanguínea inicial (de origen humano o animal; autóloga, homóloga u heteróloga), rica en plaquetas y/o factores de crecimiento y que comprende proteínas provenientes de la propia composición sanguínea inicial, con la particularidad de que dichas proteínas se encuentran en estado gelificado por un tratamiento térmico de calentamiento y enfriamiento. En particular, las proteínas gelificadas son preferentemente albúmina, glicoproteínas, globulinas y/o fibrinógeno. La formulación de acuerdo con la invención podría calificarse como un gel de proteínas (usando una terminología análoga a la utilizada para referirse al gel de fibrina) debido a que presenta una consistencia gelificada que viene dada por las proteínas en estado gelificado. Además, la formulación es deformable. La composición presenta una configuración morfológica y biomecánica nueva en comparación con el resto de geles de relleno, composiciones sanguíneas ricas en plaquetas y/o factores de crecimiento, y similares conocidos en el estado de la técnica.
...
Reivindicaciones:
1. Formulación, que se caracteriza por que comprende un plasma sanguíneo, un coágulo de fibrina obtenido a partir de un plasma sanguíneo o un sobrenadante obtenido tras la retracción de un coágulo de fibrina obtenido a partir de un plasma sanguíneo, siendo dicho plasma, coágulo o sobrenadante de origen humano o animal y rico en plaquetas y/o factores de crecimiento liberados, y por que comprende además proteínas en estado gelificado.
2. Formulación, según la reivindicación 1, que se caracteriza por que las proteínas son albúmina, glicoproteínas, globulinas y/o fibrinógeno.
3. Formulación según la reivindicación 1, que se caracteriza por que comprende uno o más agentes bioactivos seleccionados entre proteínas, péptidos, ácidos nucleicos, polisacáridos, lípidos, sustancias orgánicas no proteicas y sustancias inorgánicas.
4. Formulación según la reivindicación 1, que se caracteriza por que comprende uno o más polímeros biodegradables seleccionados entre: ácido hialurónico, sales de hialuronato, chondroitín 4 sulfato, chondroitín 6 sulfato, dextrán, gel de sílice, alginato, hidroxipropilmetilcelulosa, derivados de chitín, preferiblemente chitosano, goma xanthan, agarosa; polietileno glicólicos (PEG), polihidroxietilenometacrilato (HEMA), proteínas sintéticas o naturales, colágenos.
5. Formulación según la reivindicación 1, que se caracteriza por que comprende uno o más polímeros orgánicos seleccionados del grupo de policarpolactona, poliglicólico, poliláctico, y sus co-polímeros.
6. Formulación según la reivindicación 1, que se caracteriza por que comprende uno o más de entre los siguientes agentes: antibióticos, antimicrobianos, anticancerígenos, analgésicos, factores de crecimiento, hormonas.
7. Formulación según la reivindicación 1, que se caracteriza por que comprende uno o más componentes inorgánicos seleccionados del grupo de sales de calcio, sales de magnesio, y/o sales de estroncio.
8. Método de preparación de una formulación con propiedades
biológicas o médicas deseables, caracterizado por que comprende los pasos de:
a) disponer de un plasma sanguíneo, un coágulo de fibrina obtenido a partir de un plasma sanguíneo o un sobrenadante obtenido tras la retracción de un coágulo de fibrina obtenido a partir de un plasma sanguíneo, siendo dicho plasma, coágulo o sobrenadante de origen humano o animal y rico en plaquetas y/o factores de crecimiento liberados;
b) calentar dicho plasma, dicho coágulo o dicho sobrenadante a una temperatura entre 60 y 100°C durante al menos 1 minuto;
c) enfriar el plasma, el coágulo o el sobrenadante durante al menos 1 minuto.
9. Método según la reivindicación 8, que se caracteriza por que la
composición sanguínea inicial se calienta a una temperatura de entre 70 y 85°C.
10. Método según la reivindicación 8, que se caracteriza por que el 25 método comprende el paso de, antes de calentar, activar las plaquetas y esperar hasta que se forme una fibrina provisional.
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]